名校
1 . 回答下列问题:
(1)某二元酸(分子式用 表示)在水中的电离方程式是:
表示)在水中的电离方程式是: ;HB-
;HB- H+B2-在0.1
H+B2-在0.1 的
的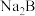 溶液中,下列粒子浓度关系式正确的是___________。
溶液中,下列粒子浓度关系式正确的是___________。
(2)亚磷酸( )是具有强还原性的二元弱酸。某温度下,0.10
)是具有强还原性的二元弱酸。某温度下,0.10 的
的 溶液中
溶液中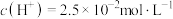 ,则第一步电离平衡常数
,则第一步电离平衡常数
___________ ( 第二步电离忽略不计,列出精确计算式);向此
第二步电离忽略不计,列出精确计算式);向此 溶液中滴加NaOH溶液至中性,所得溶液中:
溶液中滴加NaOH溶液至中性,所得溶液中:
___________ 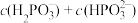 (填“>”、“<”或“=”,下同);在
(填“>”、“<”或“=”,下同);在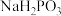 溶液中,
溶液中,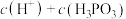
___________ 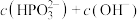 。
。
(3)25℃时,在20mL 0.1 氢氟酸中加入V mL 0.1
氢氟酸中加入V mL 0.1 NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。
NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。

(4)25℃时, 和
和 水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:

①以酚酞为指示剂(变色范围pH8.2∼10.0),将NaOH溶液逐滴加入到 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为___________ ;
② 第二步电离的电离常数为
第二步电离的电离常数为 ,则
,则
___________ ( )。
)。
(1)某二元酸(分子式用
 表示)在水中的电离方程式是:
表示)在水中的电离方程式是: ;HB-
;HB- H+B2-在0.1
H+B2-在0.1 的
的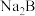 溶液中,下列粒子浓度关系式正确的是___________。
溶液中,下列粒子浓度关系式正确的是___________。A. | B.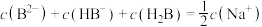 |
C. | D.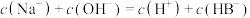 |
(2)亚磷酸(
 )是具有强还原性的二元弱酸。某温度下,0.10
)是具有强还原性的二元弱酸。某温度下,0.10 的
的 溶液中
溶液中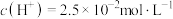 ,则第一步电离平衡常数
,则第一步电离平衡常数
 第二步电离忽略不计,列出精确计算式);向此
第二步电离忽略不计,列出精确计算式);向此 溶液中滴加NaOH溶液至中性,所得溶液中:
溶液中滴加NaOH溶液至中性,所得溶液中:
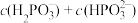 (填“>”、“<”或“=”,下同);在
(填“>”、“<”或“=”,下同);在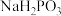 溶液中,
溶液中,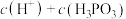
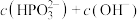 。
。(3)25℃时,在20mL 0.1
 氢氟酸中加入V mL 0.1
氢氟酸中加入V mL 0.1 NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。
NaOH溶液,测得混合溶液pH的变化曲线如图所示,下列说法正确的是___________。
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的 相等 相等 |
B.①点时pH=6,此时溶液中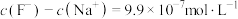 |
| C.②点时,溶液中的c(F-)=c(Na+)=0.05mol/L |
D.③点时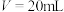 ,此时溶液中c(OH-)<c(H+)<c(F-)<c(Na+)=0.05mol/L ,此时溶液中c(OH-)<c(H+)<c(F-)<c(Na+)=0.05mol/L |
(4)25℃时,
 和
和 水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
水溶液中所有含砷的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示:
①以酚酞为指示剂(变色范围pH8.2∼10.0),将NaOH溶液逐滴加入到
 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为②
 第二步电离的电离常数为
第二步电离的电离常数为 ,则
,则
 )。
)。
您最近一年使用:0次
名校
2 . 下列说法或有关计算不正确的是(混合浓液忽略体积的变化)
| A.相同温度下,pH相同的Na2CO3和Na2SO3溶液中,水电离程度较大的是Na2CO3溶液 |
| B.c(OH-)<c(H+)的水溶液一定呈酸性 |
C.某温度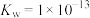 ,某溶液中由水电离的 ,某溶液中由水电离的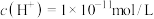 ,则该溶液的pH能11或2 ,则该溶液的pH能11或2 |
D.常温下 的氨水和 的氨水和 的盐酸等体积混合后刚好完全反应,则原氨水中 的盐酸等体积混合后刚好完全反应,则原氨水中 占含氮微粒总数的1% 占含氮微粒总数的1% |
您最近一年使用:0次
名校
3 . 室温下,将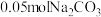 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
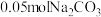 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是| 加入的物质 | 结论 | |
| A. | 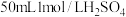 | 反应结束后, |
| B. | 0.05molCaO | 溶液中 增大 增大 |
| C. | 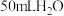 | 由水电离出的 的乘积不变 的乘积不变 |
| D. | 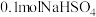 固体 固体 | 反应完全后,溶液pH减小, 不变 不变 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 25℃时,向20 mL 0.1 mol·L−1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L−1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
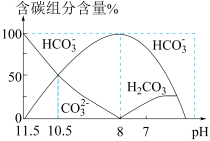
| A.pH = 8时,溶液中水的电离程度最大 |
B.当溶液中c(HCO ):c(CO ):c(CO ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) ) = 2:1时,溶液的pH = 10.2(已知lg2取0.3) |
C.在同一溶液中,H2CO3、HCO 、CO 、CO 能大量共存 能大量共存 |
D.pH = 7时,溶液中离子浓度大小关系为:c(Na+) > c(HCO ) > c(Cl−) ) > c(Cl−) |
您最近一年使用:0次
2023-12-31更新
|
883次组卷
|
6卷引用:宁夏开元学校2023-2024学年高二上学期期末考试化学试题
宁夏开元学校2023-2024学年高二上学期期末考试化学试题黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题四川省广安第二中学校2023-2024学年高三上学期12月月考理科综合试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
5 . 常温条件下,向20mL 0.01
 溶液中逐滴加入0.01
溶液中逐滴加入0.01 的NaOH溶液,溶液中水电离的
的NaOH溶液,溶液中水电离的 随加入NaOH溶液的体积变化如图所示,下列说法正确的是
随加入NaOH溶液的体积变化如图所示,下列说法正确的是


 溶液中逐滴加入0.01
溶液中逐滴加入0.01 的NaOH溶液,溶液中水电离的
的NaOH溶液,溶液中水电离的 随加入NaOH溶液的体积变化如图所示,下列说法正确的是
随加入NaOH溶液的体积变化如图所示,下列说法正确的是
| A.b、d两点溶液的pH相同 |
B.e点所示溶液中, |
C.b点时: |
| D.从a到c,对醋酸的电离既有促进作用也有抑制作用 |
您最近一年使用:0次
2023-03-02更新
|
510次组卷
|
4卷引用:宁夏石嘴山市平罗中学2022-2023学年高二下学期3月月考化学试题
宁夏石嘴山市平罗中学2022-2023学年高二下学期3月月考化学试题 黑龙江省哈尔滨市第九中学2022-2023学年高二上学期期末化学试题广西柳州地区民族高级中学2022-2023学年高二下学期期中考试化学试题(已下线)专题07 盐类水解-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
解题方法
6 . 下列叙述中不正确的是
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应: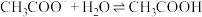 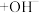 ,使溶液中 ,使溶液中 |
B.常温下,10 0.02 0.02 盐酸与10 盐酸与10 0.02 0.02  溶液混合,若混合后溶液的体积为20 溶液混合,若混合后溶液的体积为20 ,则溶液的 ,则溶液的 |
C.0.1  溶液中: 溶液中: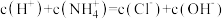 |
D.浓度均为1 的 的 溶液与盐酸等体积混合,混合溶液中: 溶液与盐酸等体积混合,混合溶液中: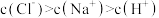  |
您最近一年使用:0次
2023-02-15更新
|
182次组卷
|
6卷引用:宁夏银川市长庆高级中学2020-2021学年高二上学期期末考试化学试题
解题方法
7 . 回答下列问题
(1)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的_______ (填写物质的名称)。把FeSO4溶液蒸干,灼烧,最后得到的主要固体产物是_______ (填化学式)
(2)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=_______
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4.溶液中c( )从小到大顺序为
)从小到大顺序为_______ (填序号)。
(4)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因_______ (用离子方程式和相应的文字叙述)。
②在Na2A水溶液中各离子浓度的大小关系是_______
(1)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的
(2)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4.溶液中c(
 )从小到大顺序为
)从小到大顺序为(4)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因
②在Na2A水溶液中各离子浓度的大小关系是
您最近一年使用:0次
解题方法
8 . 用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g 含有少量中性易溶杂质的样品,配成500 mL 待测溶液。称量时,样品可放在_______ (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用_______ (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视_______ ;在铁架台上垫一张白纸,其目的是_______
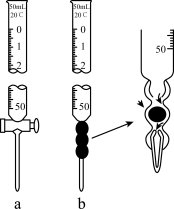
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_______ mol·L-1,烧碱样品的纯度是_______ 。
(5)如下图所示仪器a是_______ 滴定管、仪器b是_______ 滴定管,滴定时除上述两种滴定管、铁架台、滴定管夹外,还需要_______ 、_______ 。
(6)已知草酸是二元弱酸,常温下测得0.1 mol·L-1的KHC2O4的pH为4.8,则此KHC2O4溶液中c( )
)_______ c(H2C2O4)(填“大于”“小于”或“等于”)。
(7)常温下pH=11的CH3COONa溶液中由水电离产生的c(OH—)=_______ ,将此溶液加水稀释,则pH_______ (填“增大”或“减小”)。
(1)准确称量8.2 g 含有少量中性易溶杂质的样品,配成500 mL 待测溶液。称量时,样品可放在
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |

(6)已知草酸是二元弱酸,常温下测得0.1 mol·L-1的KHC2O4的pH为4.8,则此KHC2O4溶液中c(
 )
)(7)常温下pH=11的CH3COONa溶液中由水电离产生的c(OH—)=
您最近一年使用:0次
名校
解题方法
9 . Na2SO3、NaHSO3是常见的化工原料,常用作还原剂。
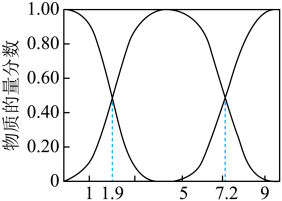
(1)25℃,H2SO3、HSO 、SO
、SO 的物质的量分数[
的物质的量分数[ ]与pH的关系如图所示。
]与pH的关系如图所示。
①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为_____ 时应停止通入。
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是_____ (用溶液中所含微粒的物质的量浓度表示)。
③NaHSO3溶液的酸碱性:_____ 。
④若测得25℃时,某溶液中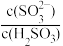 =10,则溶液的pH为
=10,则溶液的pH为____ 。
(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol•L-1I2标准溶液28mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000mol•L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16mL。
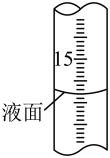
①如何判断滴定终点:______ 。
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为_____ mL。
③计算久置Na2SO3固体中Na2SO3的质量分数为____
④下列情况会造成样品中Na2SO3含量测定结果偏低的是____ (填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
(1)25℃,H2SO3、HSO
 、SO
、SO 的物质的量分数[
的物质的量分数[ ]与pH的关系如图所示。
]与pH的关系如图所示。
①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是
③NaHSO3溶液的酸碱性:
④若测得25℃时,某溶液中
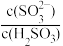 =10,则溶液的pH为
=10,则溶液的pH为(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol•L-1I2标准溶液28mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000mol•L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16mL。
①如何判断滴定终点:
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为

③计算久置Na2SO3固体中Na2SO3的质量分数为
④下列情况会造成样品中Na2SO3含量测定结果偏低的是
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
2022-12-08更新
|
937次组卷
|
4卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高二上学期1月期末化学试题
14-15高二上·湖北荆州·期末
名校
解题方法
10 . NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______ (用离子方程式说明)。
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c( )
)_______ (填“等于”“大于”或“小于”)0.1mol∙L-1NH4HSO4溶液中的c( )。
)。
(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。
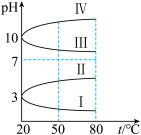
①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4Al(SO4)2溶液的pH随温度变化的原因是_______ 。
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c c
c 3cAl3=
3cAl3=_______ molL1。
(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c
 c
c 3cAl3=
3cAl3=(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2022-12-01更新
|
1389次组卷
|
57卷引用:宁夏育才中学2017-2018学年高二上学期期末考试化学试题
宁夏育才中学2017-2018学年高二上学期期末考试化学试题(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷2016-2017学年内蒙古包头九中高二上10月月考化学卷2016-2017学年四川省成都七中高二上11月考试化学卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题河北省永年县第二中学2017-2018学年高二12月月考化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题高二人教版选修4 期末学业测评(一)山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月5日 《每日一题》人教选修4-周末培优吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题四川省武胜烈面中学校2019-2020学年高二上学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷(已下线)2019年12月30日 《每日一题》人教版(选修4)——盐类水解的影响因素河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题山东省淄博市2019-2020学年高二上学期期中考试化学试题四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)3.3.3 盐类水解的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题四川省资阳中学2021-2022学年高二下学期3月月考化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题黑龙江省大庆铁人中学2023-2024学年高二上学期期中考试化学试题(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测安徽省皖南八校2022届高三上学期摸底联考化学试题(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题(已下线)专题十三水溶液中的离子平衡(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)盐类的水解山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷



