名校
1 .  排放到空气中会引起酸雨等环境问题,严重危害人类健康,
排放到空气中会引起酸雨等环境问题,严重危害人类健康, 水溶液中存在下列平衡:
水溶液中存在下列平衡:
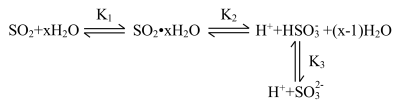
已知: ,
, ,
, 为各步反应的平衡常数,且
为各步反应的平衡常数,且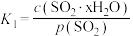 [
[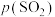 表示
表示 的平衡压强]。下列说法正确的是
的平衡压强]。下列说法正确的是
 排放到空气中会引起酸雨等环境问题,严重危害人类健康,
排放到空气中会引起酸雨等环境问题,严重危害人类健康, 水溶液中存在下列平衡:
水溶液中存在下列平衡: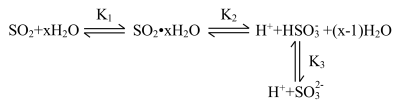
已知:
 ,
, ,
, 为各步反应的平衡常数,且
为各步反应的平衡常数,且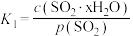 [
[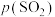 表示
表示 的平衡压强]。下列说法正确的是
的平衡压强]。下列说法正确的是A.由上图平衡可知 溶液和 溶液和 溶液都可以水解,溶液一定呈碱性 溶液都可以水解,溶液一定呈碱性 |
B.氨水也可吸收 ,防止大气污染,同时通入 ,防止大气污染,同时通入 能进一步提高 能进一步提高 去除率 去除率 |
C.当 的平衡压强为p时,测得 的平衡压强为p时,测得 ,则溶液 ,则溶液 |
D.用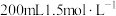 的氢氧化钠溶液吸收0.2mol的 的氢氧化钠溶液吸收0.2mol的 ,则溶液中存在关系式: ,则溶液中存在关系式: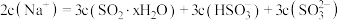 |
您最近一年使用:0次
名校
2 . 石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素主要化合价是-2价),对设备、环境等造成严重危害。已知:H2S有剧毒;常温下溶解度为1:2.6(体积)。
(1)如图为常温下H2S、HS—、S2—在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:

①当pH≈8时,含硫废水中最主要的含硫微粒为___________ 。
②NaHS溶液呈___________ (填“酸性”、“碱性”或“中性”),NaHS水解的离子方程式为:___________ 。
③由图判断,NaHS在常温下发生水解的平衡常数Kh=___________ 。
(2)沉淀法处理含硫废水:向pH≈8的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低,用化学平衡移动的原理解释溶液pH降低的原因:___________ 。
(3)氧化还原法处理含硫废水:向pH≈8的含硫废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。不同pH时,硫化物去除率随时间的变化曲线如图所示,试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。

(4)已知:Ksp(AgI)=8.5×10-17、Ksp(AgCl)=1.8×10-10,向浓度均为0.1mol•L-1的NaCl和NaI的混合液中逐渐加入AgNO3粉末,当溶液中I—浓度下降到___________ mol•L-1时(保留一位小数),AgCl开始沉淀。
(1)如图为常温下H2S、HS—、S2—在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:

①当pH≈8时,含硫废水中最主要的含硫微粒为
②NaHS溶液呈
③由图判断,NaHS在常温下发生水解的平衡常数Kh=
(2)沉淀法处理含硫废水:向pH≈8的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低,用化学平衡移动的原理解释溶液pH降低的原因:
(3)氧化还原法处理含硫废水:向pH≈8的含硫废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。不同pH时,硫化物去除率随时间的变化曲线如图所示,试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(4)已知:Ksp(AgI)=8.5×10-17、Ksp(AgCl)=1.8×10-10,向浓度均为0.1mol•L-1的NaCl和NaI的混合液中逐渐加入AgNO3粉末,当溶液中I—浓度下降到
您最近一年使用:0次
名校
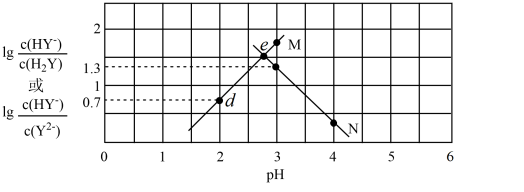
3 . 常温下,向二元弱酸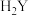 溶液中滴加
溶液中滴加 溶液,所得混合溶液的
溶液,所得混合溶液的 与离子浓度变化的关系如图所示。下列有关说法正确的是
与离子浓度变化的关系如图所示。下列有关说法正确的是
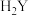 溶液中滴加
溶液中滴加 溶液,所得混合溶液的
溶液,所得混合溶液的 与离子浓度变化的关系如图所示。下列有关说法正确的是
与离子浓度变化的关系如图所示。下列有关说法正确的是
A.曲线 表示 表示 与 与 的变化关系 的变化关系 |
B. 的数量级为 的数量级为 |
C. 点溶液中: 点溶液中: |
D.交点 的溶液中: 的溶液中: |
您最近一年使用:0次
名校
解题方法
4 . 硫及其化合物在生产生活中有广泛应用。SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,其吸收SO2反应的离子方程式为___________ 。
(2)已知H2SO3的电离常数为Ka1=1.54×10-2mol·L-1,Ka2=1.024×10-7mol·L-1;H2CO3的电离常数为Ka1=4.30×10-7mol·L-1,Ka2=5.60×10-11mol·L-1,则下列微粒不能大量共存的是___________(填字母)。
(3)Na2SO3溶液吸收SO2的过程中,水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图:
随pH的分布如图:
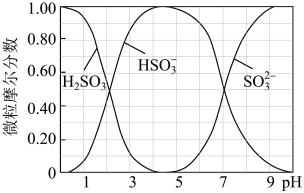
①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为___________ 。
②在0.1mol·L-1NaHSO3溶液中离子浓度关系不正确的是___________ (填字母)。
A.c平(Na+)=c平(SO )+c平(HSO
)+c平(HSO )+c平(H2SO3)
)+c平(H2SO3)
B.c平(H2SO3)+c平(H+)=c平(SO )+c平(OH—)
)+c平(OH—)
C.c平(Na+)>c平(HSO )>c平(OH—)>c平(SO
)>c平(OH—)>c平(SO )
)
D.c平(Na+)+c平(H+)=c平(SO )+c平(HSO
)+c平(HSO )+c平(OH—)
)+c平(OH—)
(4)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈-1价;SOCl2遇水可生成SO2,请回答下列问题:
蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的化学方程式和必要的文字描述解释原因:___________ 。
(5)25℃时,向20mL0.1mol·L-1Na2S溶液中逐滴加入0.1mol·L-1的盐酸40mL,溶液的pH逐渐降低,溶液中含硫元素微粒的物质的量浓度的百分含量(纵轴)也发生变化,如图所示:

①B点对应的溶液中大量存在的溶质是___________ 。
②混合溶液的pH=___________ 时,溶液中开始有H2S气体放出。
③反应到A点时,加入0.1mol·L-1盐酸的体积___________ 20mL(填“>”“=”或“<”)。
(1)钠碱循环法中,吸收液为Na2SO3溶液,其吸收SO2反应的离子方程式为
(2)已知H2SO3的电离常数为Ka1=1.54×10-2mol·L-1,Ka2=1.024×10-7mol·L-1;H2CO3的电离常数为Ka1=4.30×10-7mol·L-1,Ka2=5.60×10-11mol·L-1,则下列微粒不能大量共存的是___________(填字母)。
A.CO 和HSO 和HSO | B.HCO 和HSO 和HSO | C.SO 和HCO 和HCO | D.H2SO3和HCO |
(3)Na2SO3溶液吸收SO2的过程中,水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图:
随pH的分布如图:
①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为
②在0.1mol·L-1NaHSO3溶液中离子浓度关系不正确的是
A.c平(Na+)=c平(SO
 )+c平(HSO
)+c平(HSO )+c平(H2SO3)
)+c平(H2SO3)B.c平(H2SO3)+c平(H+)=c平(SO
 )+c平(OH—)
)+c平(OH—)C.c平(Na+)>c平(HSO
 )>c平(OH—)>c平(SO
)>c平(OH—)>c平(SO )
)D.c平(Na+)+c平(H+)=c平(SO
 )+c平(HSO
)+c平(HSO )+c平(OH—)
)+c平(OH—)(4)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈-1价;SOCl2遇水可生成SO2,请回答下列问题:
蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的化学方程式和必要的文字描述解释原因:
(5)25℃时,向20mL0.1mol·L-1Na2S溶液中逐滴加入0.1mol·L-1的盐酸40mL,溶液的pH逐渐降低,溶液中含硫元素微粒的物质的量浓度的百分含量(纵轴)也发生变化,如图所示:

①B点对应的溶液中大量存在的溶质是
②混合溶液的pH=
③反应到A点时,加入0.1mol·L-1盐酸的体积
您最近一年使用:0次
名校
5 . 叠氮化钠( )可用于汽车安全气囊的制造,
)可用于汽车安全气囊的制造, 与
与 发生反应可以生成
发生反应可以生成 ,反应方程式为
,反应方程式为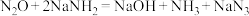 。下列有关说法错误的是
。下列有关说法错误的是
 )可用于汽车安全气囊的制造,
)可用于汽车安全气囊的制造, 与
与 发生反应可以生成
发生反应可以生成 ,反应方程式为
,反应方程式为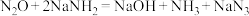 。下列有关说法错误的是
。下列有关说法错误的是A.键角: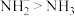 | B.电负性: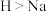 |
C. 溶液显碱性 溶液显碱性 | D.1 mol  中含2 mol σ键 中含2 mol σ键 |
您最近一年使用:0次
2024-02-01更新
|
456次组卷
|
3卷引用:福建省厦门第一中学2023-2024学年高二下学期第一次月考化学试题
解题方法
6 . 25℃时,醋酸的 ,磷酸的
,磷酸的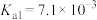 、
、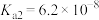 、
、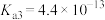 。下列说法不正确的有
。下列说法不正确的有
 ,磷酸的
,磷酸的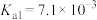 、
、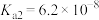 、
、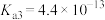 。下列说法不正确的有
。下列说法不正确的有A.0.1mol⋅L  溶液: 溶液: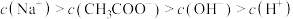 |
B.0.1mol⋅L  溶液: 溶液: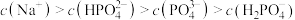 |
C.浓度均为0.1mol⋅L  和 和 混合溶液: 混合溶液: |
D.浓度均为0.1mol⋅L 醋酸和NaOH溶液等体积混合 醋酸和NaOH溶液等体积混合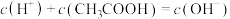 |
您最近一年使用:0次
名校
解题方法
7 . 常温下,用0.1000mol/L的NaOH溶液滴定20.00mL浓度分别为 、
、 的一元酸(HA)、二元酸(
的一元酸(HA)、二元酸( )溶液,得到如图滴定曲线,其中
)溶液,得到如图滴定曲线,其中 、
、 为两种酸恰好完全中和的化学计量点。忽略溶液混合时体积变化。下列叙述正确的是
为两种酸恰好完全中和的化学计量点。忽略溶液混合时体积变化。下列叙述正确的是
 、
、 的一元酸(HA)、二元酸(
的一元酸(HA)、二元酸( )溶液,得到如图滴定曲线,其中
)溶液,得到如图滴定曲线,其中 、
、 为两种酸恰好完全中和的化学计量点。忽略溶液混合时体积变化。下列叙述正确的是
为两种酸恰好完全中和的化学计量点。忽略溶液混合时体积变化。下列叙述正确的是
A.X曲线代表 ,Y曲线代表HA, ,Y曲线代表HA, |
| B.两种酸恰好完全中和时,均可用酚酞或甲基橙作指示剂 |
C.若 ,对于HA而言,滴定过程中有 ,对于HA而言,滴定过程中有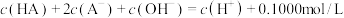 |
D.若 点 点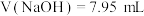 ,则 ,则 点 点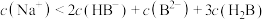 |
您最近一年使用:0次
2023-12-05更新
|
531次组卷
|
6卷引用:福建省厦门外国语学校2023-2024学年高二上学期期末模拟考试化学试题
福建省厦门外国语学校2023-2024学年高二上学期期末模拟考试化学试题湖南省九校联盟2023届高三上学期第一次联考化学试题湖南省九校联盟2023届高三上学期第一次联考化学试题湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山西运城新康国际中学2023-2024学年高三上学期一轮复习检测化学试卷
名校
解题方法
8 . 25℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol/L,1gc(CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离平衡常数,下列说法正确的是


| A.P点时,c(CH3COOH)>c(CH3COO-)>c(OH-)>c(H+) |
| B.O点时,pH=-lgKa |
| C.25℃时,Ka(CH3COOH)的数量级为10-5 |
| D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大 |
您最近一年使用:0次
2023-11-16更新
|
449次组卷
|
2卷引用:福建省莆田第一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . NA为阿伏加德罗常数的值,下列说法正确的是
A.将含0.1mol FeCl3的溶液滴入煮沸的蒸馏水中,制得的 胶体粒子数目小于0.1NA 胶体粒子数目小于0.1NA |
| B.0.1mol/L AlCl3溶液中含有Al3+数目小于0.1NA |
C.向1L 0.1mol/L CH3COOH溶液通氨气至中性,NH 离子数为0.1NA 离子数为0.1NA |
| D.常温下,1L pH=10的Na2CO3溶液中水电离出的OH-数目为NA×10-10 |
您最近一年使用:0次
2023-11-16更新
|
334次组卷
|
2卷引用:福建省莆田第一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 常温下,浓度均为 的四种盐溶液,其pH如表所示,下列说法正确的是
的四种盐溶液,其pH如表所示,下列说法正确的是
 的四种盐溶液,其pH如表所示,下列说法正确的是
的四种盐溶液,其pH如表所示,下列说法正确的是| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A.等浓度的CH3COOH和HClO溶液,pH小的是HClO |
| B.Na2CO3和NaHCO3溶液中离子种类相同 |
| C.溶液中水的电离程度:①>②>④>③ |
D.NaHCO3溶液中: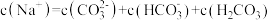 |
您最近一年使用:0次
2023-09-01更新
|
156次组卷
|
21卷引用:福建省长乐高级中学2018-2019学年高二下学期期末考试化学试题
福建省长乐高级中学2018-2019学年高二下学期期末考试化学试题福建省连城县第一中学2023-2024学年高二上学期12月月考化学试题黑龙江省大庆中学2017-2018学年高二上学期期末考试化学试题安徽省安庆市第二中学2018-2019学年高二下学期开学考试化学试题陕西省榆林市第二中学2019-2020学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期末考试化学试题河北省沧州市盐山中学2019-2020学年高二上学期期末考试(B)化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期10月月考化学试题(已下线)第03章 水溶液中的离子平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 作业帮海南省海口市第四中学2020-2021学年高二上学期期中考试化学试题辽宁省抚顺市2020-2021学年高二上学期期中考试化学试题浙江省浙北G2联盟(湖州中学、嘉兴一中)2021-2022学年高二下学期期中联考化学试题湖北省华中师范大学潜江附属中学2021-2022学年高二上学期10月月考化学试题广东省珠海市斗门第一中学2022-2023学年高二上学期期中考试化学试题天津市崇化中学2022-2023学年高二 上学期阶段性质量监测化学试卷山东省潍坊第一中学2022-2023学年高二上学期期末考试化学试题江西省乐平中学2022-2023学年高二上学期11月期中考试化学试题辽宁省辽河油田第二高级中学2020届高三期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)



