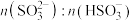烟气中的SO2可以用钠碱循环法加以处理,用Na2SO3溶液作为吸收液,当吸收液与SO2反应至pH为6左右时,可将吸收液通入电解槽进行再生,吸收液pH随微粒组成的变化关系见表:
| 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
回答下列问题:
(1)吸收液pH由8.2下降至6.2过程中发生反应的离子方程式为
(2)当吸收液呈中性时,溶液中

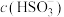 (填“>”“<”或“=”,下同);pH=7.2时,
(填“>”“<”或“=”,下同);pH=7.2时,
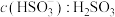 第二步电离平衡常数
第二步电离平衡常数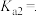
(3)NaHSO3﹣Na2SO3、H2CO3﹣NaHCO3,Na2HPO4﹣NaH2PO4都可组成缓冲溶液,缓冲溶液中lgx[x表示
 或
或 ]与pH的关系如图,当lgx数值在﹣1~1之间时具有可实用价值的缓冲能力,曲线
]与pH的关系如图,当lgx数值在﹣1~1之间时具有可实用价值的缓冲能力,曲线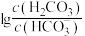 与pH的变化关系,应控制Na2HPO4﹣NaH2PO4缓冲溶液的pH范围为
与pH的变化关系,应控制Na2HPO4﹣NaH2PO4缓冲溶液的pH范围为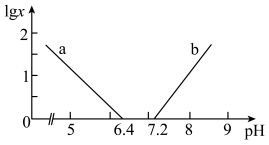
更新时间:2024-03-25 17:01:36
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】某小组设计了如下实验探究某未知浓度的酸HA相关性质。
(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
据此小组同学得出HA为弱电解质的结论,理由是___________ 。
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是________ (填序号)。
a.混合后离子浓度满足等式: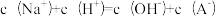
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制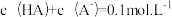 的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数
的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数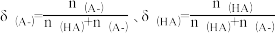 与所加NaOH物质的量的关系如图所示。
与所加NaOH物质的量的关系如图所示。
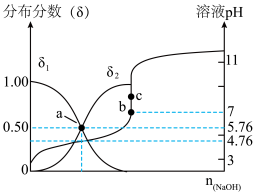
①δ1表示___________ (填微粒符号)的分布分数曲线。
②25℃时,HA的电离平衡常数Ka=___________ (已知100.24=1.75)。
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=___________ 。
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为___________ 。
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被___________ 消耗,导致溶液中游离的H+浓度几乎不变,溶液的pH也几乎不变。
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是________ (填序号)
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
| 序号 | 原HA溶液体积/mL | 水的体积/mL | pH |
| I | 40.00 | / | 2.88 |
| II | 4.00 | 36.0 | 3.38 |
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是
a.混合后离子浓度满足等式:
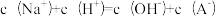
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制
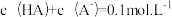 的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数
的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数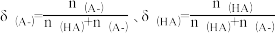 与所加NaOH物质的量的关系如图所示。
与所加NaOH物质的量的关系如图所示。
①δ1表示
②25℃时,HA的电离平衡常数Ka=
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的电子式是___________ 。
(2)该反应的热化学方程式为___________ 。
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的海盐,则反应的化学方程式为___________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是___________ 。
(5)在2L恒容密闭容器中充入0.6molN2H4(g),一定温度下发生反应:3N2H4(g) 4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示:
4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示:___________ ,该温度下此反应的平衡常数为___________ 。
②下列能够表明上述反应已达到平衡状态的有___________ 。
A.3 v正(N2H4) = 4 v逆(NH3) B.气体密度不再改变
C.混合气体的平均相对分子质量不再改变 D.体系与环境不再有净热交换
③写出一种提高N2H4平衡转化率的方法___________ 。
(6)已知醋酸是一种常见的弱酸,回答下列有关问题:
①常温下,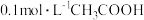 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是___________ 。
A. B.
B.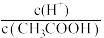 C.
C.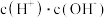 D .
D . E.
E.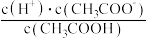
②25℃时,在一定体积pH=2的CH3COOH溶液中,加水稀释至体积为原体积的1000倍,稀释后的溶液pH的范围为___________ 。
(7)已知Kw为水的离子积常数,回答下列有关问题
①在某温度(t℃)下,Kw=1×10-12,则该温度t℃(填大于,小于或等于)_______ 25℃,理由是:___________________________________________ 。
②该温度下,已知pH=9的氢氧化钠溶液,由水电离得到的 =
=______________ 。
(1)过氧化氢的电子式是
(2)该反应的热化学方程式为
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的海盐,则反应的化学方程式为
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: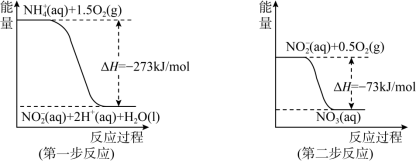
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是(5)在2L恒容密闭容器中充入0.6molN2H4(g),一定温度下发生反应:3N2H4(g)
 4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示:
4NH3(g)+N2(g) ΔH=-32.9kJ·mol-1,N2H4的转化率随时间变化情况如图所示: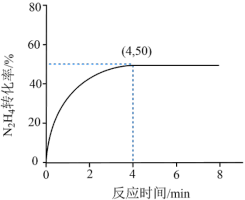
②下列能够表明上述反应已达到平衡状态的有
A.3 v正(N2H4) = 4 v逆(NH3) B.气体密度不再改变
C.混合气体的平均相对分子质量不再改变 D.体系与环境不再有净热交换
③写出一种提高N2H4平衡转化率的方法
(6)已知醋酸是一种常见的弱酸,回答下列有关问题:
①常温下,
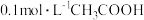 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是A.
 B.
B.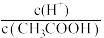 C.
C.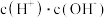 D .
D . E.
E.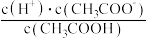
②25℃时,在一定体积pH=2的CH3COOH溶液中,加水稀释至体积为原体积的1000倍,稀释后的溶液pH的范围为
(7)已知Kw为水的离子积常数,回答下列有关问题
①在某温度(t℃)下,Kw=1×10-12,则该温度t℃(填大于,小于或等于)
②该温度下,已知pH=9的氢氧化钠溶液,由水电离得到的
 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】(1)某温度下,纯水的c(H+)=2×10- 7 mol·L-1,则此时c(OH-)为_______ ;若温度不变,滴入稀盐酸使c(H+)=5×10- 4 mol·L-1则溶液中由水电离产生的c(H+)为_______ ,此时温度_______ (填“高于”、“低于”或“等于”)25℃。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH2=-242.0 kJ/mol
O2(g)=H2O(g) ΔH2=-242.0 kJ/mol
③CO(g)+ O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:_______ 。
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为_______ 。(溶液体积变化忽略不计)
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为( 、
、 、
、 、OH- 和H +)
、OH- 和H +)_______ 。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+
 O2(g)=H2O(g) ΔH2=-242.0 kJ/mol
O2(g)=H2O(g) ΔH2=-242.0 kJ/mol③CO(g)+
 O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)=CO2(g) ΔH3=-283. 0 kJ/mol写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为(
 、
、 、
、 、OH- 和H +)
、OH- 和H +)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】回答下列问题
(1)根据相关物质的电离常数(25℃),回答下列问题:
①
 HCN
HCN 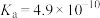

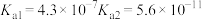
相同pH的① ,②
,② ,③
,③ ,④
,④ 溶液,物质的量浓度由大到小的顺序:
溶液,物质的量浓度由大到小的顺序:______ 。
②室温时 的电离平衡常数
的电离平衡常数 ,向 a L
,向 a L  溶液中加入b
溶液中加入b  固体
固体 (溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原
(溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原 溶液的浓度为
溶液的浓度为______ 
③实验室在制备 常用饱和食盐水除去其中混有的
常用饱和食盐水除去其中混有的 (g),请用化学平衡移动原理解释
(g),请用化学平衡移动原理解释 难溶于饱和食盐水的原因
难溶于饱和食盐水的原因______ 。
(2)常温下,将pH均为3,体积均为 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随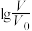 的变化如图所示。
的变化如图所示。______ (填写序号)。
①溶液中溶质的物质的量浓度HA>HB; ②溶液中溶质的物质的量浓度HA<HB;
③开始反应时的速率HA>HB; ④开始反应时的速率HA=HB;
⑤HA溶液里有锌剩余; ⑥HB溶液里有锌剩余
(3)亚磷酸( )是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
)是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
常温下,已知 溶液中含磷粒子的浓度之和为
溶液中含磷粒子的浓度之和为 ,溶液中含磷粒子的物质的量分数(
,溶液中含磷粒子的物质的量分数( )与溶液pH的关系如图所示。
)与溶液pH的关系如图所示。 溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为
溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为______ 。
(4)利用草酸( )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。
某次实验抽取血样10.00mL,加适量的草酸铵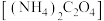 溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的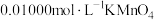 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液12.00mL。
溶液12.00mL。
相关离子方程式为: 。
。
①达到滴定终点的现象是______ 。
②血液样品中 浓度为
浓度为______  (保留4位有效数字)。
(保留4位有效数字)。
③下列操作可使所测结果偏高的是______ (填标号)。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
(5)常温下,向浓度为 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: 的电离常数K=
的电离常数K=______ (保留一位有效数字)
②比较b、c、d三点时的溶液中,由水电离出的 由大到小顺序为
由大到小顺序为______ 。
③根据以上滴定曲线判断下列说法正确的是______ (溶液中N元素只存在 和
和 两种形式)。
两种形式)。
A.点b所示溶液中: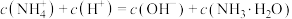
B.点c所示溶液中:
C.点d所示溶液中: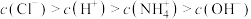
D.滴定过程中可能有: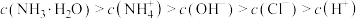
(1)根据相关物质的电离常数(25℃),回答下列问题:
①

 HCN
HCN 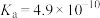

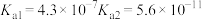
相同pH的①
 ,②
,② ,③
,③ ,④
,④ 溶液,物质的量浓度由大到小的顺序:
溶液,物质的量浓度由大到小的顺序:②室温时
 的电离平衡常数
的电离平衡常数 ,向 a L
,向 a L  溶液中加入b
溶液中加入b  固体
固体 (溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原
(溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原 溶液的浓度为
溶液的浓度为
③实验室在制备
 常用饱和食盐水除去其中混有的
常用饱和食盐水除去其中混有的 (g),请用化学平衡移动原理解释
(g),请用化学平衡移动原理解释 难溶于饱和食盐水的原因
难溶于饱和食盐水的原因(2)常温下,将pH均为3,体积均为
 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随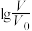 的变化如图所示。
的变化如图所示。
①溶液中溶质的物质的量浓度HA>HB; ②溶液中溶质的物质的量浓度HA<HB;
③开始反应时的速率HA>HB; ④开始反应时的速率HA=HB;
⑤HA溶液里有锌剩余; ⑥HB溶液里有锌剩余
(3)亚磷酸(
 )是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
)是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。常温下,已知
 溶液中含磷粒子的浓度之和为
溶液中含磷粒子的浓度之和为 ,溶液中含磷粒子的物质的量分数(
,溶液中含磷粒子的物质的量分数( )与溶液pH的关系如图所示。
)与溶液pH的关系如图所示。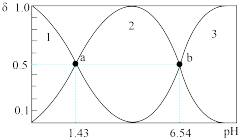
 溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为
溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为(4)利用草酸(
 )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。某次实验抽取血样10.00mL,加适量的草酸铵
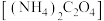 溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的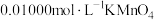 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液12.00mL。
溶液12.00mL。相关离子方程式为:
 。
。①达到滴定终点的现象是
②血液样品中
 浓度为
浓度为 (保留4位有效数字)。
(保留4位有效数字)。③下列操作可使所测结果偏高的是
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
(5)常温下,向浓度为
 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: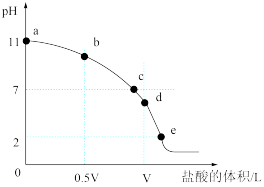
 的电离常数K=
的电离常数K=②比较b、c、d三点时的溶液中,由水电离出的
 由大到小顺序为
由大到小顺序为③根据以上滴定曲线判断下列说法正确的是
 和
和 两种形式)。
两种形式)。A.点b所示溶液中:
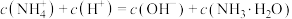
B.点c所示溶液中:

C.点d所示溶液中:
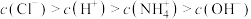
D.滴定过程中可能有:
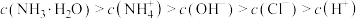
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】华为Mate 60 Pro手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国的芯片技术的飞速发展。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
(1)硅元素的相对原子量为___________ (保留两位小数),12 g SiO2中29Si的质量为___________ (保留两位小数)。
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由___________ 。
(3)下列能说明碳的非金属大于硅的是___________。
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为___________ 。
(5)下列关于石墨烯的说法错误的是___________。
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼( )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。
已知:水合肼是一种二元弱碱,其电离常数为: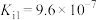 ,
, 。
。
(6)溶液A中含量最高的阳离子的化学式为___________ ,写出水合肼与溶液A反应的离子方程式___________ 。
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点___________ 。
(8)写出水合肼一级电离的方程式___________ 。
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度: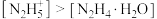 ,需调节的pH范围为
,需调节的pH范围为___________ 。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
| 核素符号 | 相对原子量 | 丰度(%) |
| 28Si | 27.977 | 92.23 |
| 29Si | 28.976 | 4.67 |
| 30Si | 29.974 | 3.10 |
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由
(3)下列能说明碳的非金属大于硅的是___________。
| A.甲烷的分解温度高于SiH4 | B.碳与SiO2高温下置换出硅 |
| C.二氧化碳通入硅酸钠溶液得到白色沉淀 | D.CH4中氢为+1价,SiH4中氢为-1价 |
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为
(5)下列关于石墨烯的说法错误的是___________。
| A.石墨烯是一种多烯烃 |
| B.石墨烯中碳原子与苯环中碳原子杂化类型相同 |
| C.石墨烯与金刚石互为同分异构体 |
| D.石墨烯只存在非极性键 |
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼(
 )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。已知:水合肼是一种二元弱碱,其电离常数为:
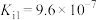 ,
, 。
。(6)溶液A中含量最高的阳离子的化学式为
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点
(8)写出水合肼一级电离的方程式
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度:
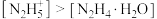 ,需调节的pH范围为
,需调节的pH范围为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】25℃时,草酸 H2C2O4的 Ka1=5.6×10⁻2, Ka2=1.5×10⁻4,草酸钙 CaC2O4的 Ksp=4.0×10⁻8。回答以下问题:
(1)用标准浓度的草酸滴定未知浓度的 KMnO4溶液,可标定 KMnO4溶液的浓度。判断到达滴定终点的现象为___________ 。
(2)H2C2O4在水中的电离方程式___________ ;
(3)25℃时, NaHC2O4 溶液的 pH___________ 7 ( 选填“ > ”“ <” 或“ = ”), 通过计算说明原因:___________ 。
(4)25℃时,H2CO3的 Ka1=4.4×10⁻7, Ka2=4.7×10⁻11,写出少量草酸和过量碳酸钠溶液反应的离子方程式___________ 。
(5)25℃时,将 1 mL 某浓度的 H2C2O4溶液加水稀释,其溶液 pH 与稀释后溶液体积的关系如图所示。

① 图中能代表 H2C2O4溶液稀释情况的是___________ (选填“A: 曲线 I”或“B: 曲线 II”);
② 稀释过程中,下列量始终增大的是___________ 。
A、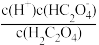 B、
B、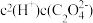 C、
C、 D、
D、
(6)25℃时,向 20 mL 0.1 mol·L-1的 NaHC2O4溶液中缓慢滴加 pH=13 的 NaOH 溶液,混合溶液的温度 T 与滴加 NaOH 溶液体积的关系如下图所示。
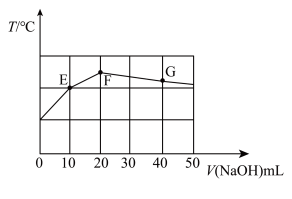
① 图中 E, F, G 三点中,水的电离程度最大的是___________ 点。
② 下列关系式中正确的是___________ 。
A.E 点存在 2c(Na+)=3c(H2C2O4)+3c(HC2O )+3c(C2O
)+3c(C2O )
)
B.F 点存在 c(H+)=c(OH-)+c(HC2O )+c(H2C2O4)
)+c(H2C2O4)
C.G 点存在 c(Na+)>c(OH-)>c(HC2O )>c(C2O
)>c(C2O )
)
(7)草酸钙结石是草酸和高钙食物在人体内形成的一种结石,计算下列反应的平衡常数: H2C2O4(aq)+Ca2+(aq)⇌CaC2O4(s)+2H+(aq),K=___________ 。(算出具体数值)
(1)用标准浓度的草酸滴定未知浓度的 KMnO4溶液,可标定 KMnO4溶液的浓度。判断到达滴定终点的现象为
(2)H2C2O4在水中的电离方程式
(3)25℃时, NaHC2O4 溶液的 pH
(4)25℃时,H2CO3的 Ka1=4.4×10⁻7, Ka2=4.7×10⁻11,写出少量草酸和过量碳酸钠溶液反应的离子方程式
(5)25℃时,将 1 mL 某浓度的 H2C2O4溶液加水稀释,其溶液 pH 与稀释后溶液体积的关系如图所示。

① 图中能代表 H2C2O4溶液稀释情况的是
② 稀释过程中,下列量始终增大的是
A、
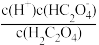 B、
B、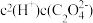 C、
C、 D、
D、
(6)25℃时,向 20 mL 0.1 mol·L-1的 NaHC2O4溶液中缓慢滴加 pH=13 的 NaOH 溶液,混合溶液的温度 T 与滴加 NaOH 溶液体积的关系如下图所示。

① 图中 E, F, G 三点中,水的电离程度最大的是
② 下列关系式中正确的是
A.E 点存在 2c(Na+)=3c(H2C2O4)+3c(HC2O
 )+3c(C2O
)+3c(C2O )
)B.F 点存在 c(H+)=c(OH-)+c(HC2O
 )+c(H2C2O4)
)+c(H2C2O4)C.G 点存在 c(Na+)>c(OH-)>c(HC2O
 )>c(C2O
)>c(C2O )
)(7)草酸钙结石是草酸和高钙食物在人体内形成的一种结石,计算下列反应的平衡常数: H2C2O4(aq)+Ca2+(aq)⇌CaC2O4(s)+2H+(aq),K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】氮是最重要的生命必需元素之一,与之相关的碱较多。部分碱在常温下的电离平衡常数如下表。
回答以下问题:
(1)常温下, 氨水的电离度为
氨水的电离度为_______ 。
(2)液氨能发生类似于水的自偶电离: ,基于此,液氨可以与亚硫酰氯(
,基于此,液氨可以与亚硫酰氯( )发生氨解反应生成
)发生氨解反应生成 ,则另一产物为
,则另一产物为_______ 。
(3)用化学用语表示羟胺溶液显碱性的原因_______ ,据此分析羟胺的 小于甲胺
小于甲胺 的原因
的原因_______ (从电负性、电子云密度角度作答)。
(4)常温时,浓度相同的① ②
②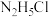 ③
③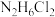 ④
④ ⑤
⑤ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是_______ (填序号)。
(5)用 的标准盐酸滴定
的标准盐酸滴定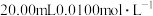 的
的 溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是
溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是
| 名称 | 氨 | 联氨 | 羟胺 | 甲胺 |
| 化学式 |  |  | 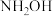 |  |
| 电离常数 |  | 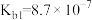 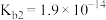 |  |  |
(1)常温下,
 氨水的电离度为
氨水的电离度为(2)液氨能发生类似于水的自偶电离:
 ,基于此,液氨可以与亚硫酰氯(
,基于此,液氨可以与亚硫酰氯( )发生氨解反应生成
)发生氨解反应生成 ,则另一产物为
,则另一产物为(3)用化学用语表示羟胺溶液显碱性的原因
 小于甲胺
小于甲胺 的原因
的原因(4)常温时,浓度相同的①
 ②
②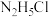 ③
③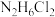 ④
④ ⑤
⑤ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是(5)用
 的标准盐酸滴定
的标准盐酸滴定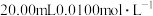 的
的 溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是
溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是A.当 时,反应的离子方程式为 时,反应的离子方程式为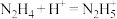 |
| B.滴定过程中,应选用酚酞作指示剂 |
C.当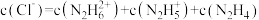 时,溶液呈中性 时,溶液呈中性 |
D.常温下,反应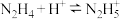 的平衡常数 的平衡常数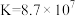 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究:
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下
H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______ (填“能”或“不能”)自发进行。
(2)已知在 400℃时,N2(g) + 3H2(g) 2NH3(g)的 K=0.5
2NH3(g)的 K=0.5
①在400℃时,2NH3(g) N2(g) + 3H2(g)的 K'=
N2(g) + 3H2(g)的 K'=_________ (填数值)。
②400℃时,在 0.5L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物质的量分别为 2mol、1mol、2mol,则此时反应 v(N2)正_____________ v(N2)逆(填 “>”、“<”、“=”或“不能确定”)。
③已 知 H—H 键 键 能 为 436kJ/mol , N—H 键 键 能 为 391kJ/mol , N N 键 键 能 为945.6kJ/mol,则反应N2(g)+ 3H2(g) 2NH3(g)的△H=
2NH3(g)的△H= ____________ 。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________ (填“向左”、 “向右”或“不”)移动;使用催化剂_____________ (填“增大”、“减小”或“不改变”)反 应的△H。
(3)在 25℃下,将 a mol/L 的氨水和 0.01mol/L 的盐酸等体积混合,反应平衡时溶液中的 c(NH4+)=c(Cl-),则溶液显__________ (填“酸”、“碱”或“中”)性;用含 a 的代数式表示 NH3•H2O 电离常数 Kb= ______________________________________ 。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)
 H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下
H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下(2)已知在 400℃时,N2(g) + 3H2(g)
 2NH3(g)的 K=0.5
2NH3(g)的 K=0.5①在400℃时,2NH3(g)
 N2(g) + 3H2(g)的 K'=
N2(g) + 3H2(g)的 K'=②400℃时,在 0.5L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物质的量分别为 2mol、1mol、2mol,则此时反应 v(N2)正
③已 知 H—H 键 键 能 为 436kJ/mol , N—H 键 键 能 为 391kJ/mol , N N 键 键 能 为945.6kJ/mol,则反应N2(g)+ 3H2(g)
 2NH3(g)的△H=
2NH3(g)的△H= (3)在 25℃下,将 a mol/L 的氨水和 0.01mol/L 的盐酸等体积混合,反应平衡时溶液中的 c(NH4+)=c(Cl-),则溶液显
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】滴定是化学学科中一个很重要的测定方法。
在化学实验课上,小明进行了如下探究:
Ⅰ. 小明先为酸碱滴定实验做准备,在将酸稀释的过程中进行了探究:
(1)常温下,小明将 均为3、体积均为V0的HX和HY溶液,分别加水稀释至体积为V,测得
均为3、体积均为V0的HX和HY溶液,分别加水稀释至体积为V,测得 随
随 的变化,将数据用计算机描绘如图所示,老师给出如下命题,请你帮小明选出所有正确的命题
的变化,将数据用计算机描绘如图所示,老师给出如下命题,请你帮小明选出所有正确的命题________ (填标号)

A.等浓度的盐溶液的
B.水的电离程度: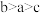
C.若初始时将两种溶液混合:

D.
E.pH=2的HX溶液与pH=12的YOH溶液任意比混合:c(H+) + c(Y+)=c(OH-) + c(X-)
F.常温下,若0.1 mol/L酸HY pH=3,0.1 mol/L碱XOH pH=13,则盐XY溶液的pH<7
Ⅱ.在接下来有关KI溶液的实验中,小明发现新配置的无色的KI溶液逐渐变成了棕黄色,小明查阅资料得知这是因为碘离子被氧化为碘单质,老师又告诉她含单质碘的KI溶液中存在可逆反应: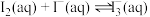 ,小明为测定该反应的平衡常数K进行如下实验,设计了实验步骤如下:
,小明为测定该反应的平衡常数K进行如下实验,设计了实验步骤如下:
Ⅰ.在装有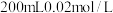 的
的 溶液的碘量瓶中加入足量I2,充分搅拌溶解,待过量的固体碘沉于瓶底后,取
溶液的碘量瓶中加入足量I2,充分搅拌溶解,待过量的固体碘沉于瓶底后,取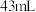 上层清液,用
上层清液,用 萃取,充分振荡、静置、分液,得到
萃取,充分振荡、静置、分液,得到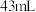 萃取后的水溶液、
萃取后的水溶液、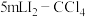 溶液。
溶液。
Ⅱ.取萃取后的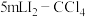 溶液于碘量瓶中,加水充分振荡,再加入质量分数为
溶液于碘量瓶中,加水充分振荡,再加入质量分数为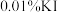 溶液,充分振荡后,静置5分钟,用
溶液,充分振荡后,静置5分钟,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗 溶液。
溶液。
Ⅲ.将萃取后的水溶液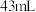 移入碘量瓶中,用
移入碘量瓶中,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗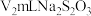 溶液。
溶液。
已知:① ;②
;② 与
与 难溶于
难溶于 ;③室温下,达到溶解平衡后,
;③室温下,达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比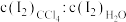 为86∶1
为86∶1
回答下列问题:
(2)下列萃取分液操作中没有用到的仪器有_______(填标号)。
(3) 易溶于
易溶于 的原因是
的原因是_______ 。
(4)滴定过程中 标准溶液应装在
标准溶液应装在_______ 中,滴定终点的现象是_______ 。
(5)步骤Ⅱ中加入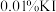 溶液的目的是
溶液的目的是_______ 。
(6)步骤Ⅲ测得萃取后的水溶液中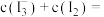
_______  ,平衡常数
,平衡常数
_______ (列出计算式即可)。
(7)下列关于实验误差分析的说法正确的是_______(填标号)。
在化学实验课上,小明进行了如下探究:
Ⅰ. 小明先为酸碱滴定实验做准备,在将酸稀释的过程中进行了探究:
(1)常温下,小明将
 均为3、体积均为V0的HX和HY溶液,分别加水稀释至体积为V,测得
均为3、体积均为V0的HX和HY溶液,分别加水稀释至体积为V,测得 随
随 的变化,将数据用计算机描绘如图所示,老师给出如下命题,请你帮小明选出所有正确的命题
的变化,将数据用计算机描绘如图所示,老师给出如下命题,请你帮小明选出所有正确的命题
A.等浓度的盐溶液的

B.水的电离程度:
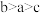
C.若初始时将两种溶液混合:


D.

E.pH=2的HX溶液与pH=12的YOH溶液任意比混合:c(H+) + c(Y+)=c(OH-) + c(X-)
F.常温下,若0.1 mol/L酸HY pH=3,0.1 mol/L碱XOH pH=13,则盐XY溶液的pH<7
Ⅱ.在接下来有关KI溶液的实验中,小明发现新配置的无色的KI溶液逐渐变成了棕黄色,小明查阅资料得知这是因为碘离子被氧化为碘单质,老师又告诉她含单质碘的KI溶液中存在可逆反应:
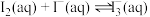 ,小明为测定该反应的平衡常数K进行如下实验,设计了实验步骤如下:
,小明为测定该反应的平衡常数K进行如下实验,设计了实验步骤如下:Ⅰ.在装有
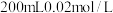 的
的 溶液的碘量瓶中加入足量I2,充分搅拌溶解,待过量的固体碘沉于瓶底后,取
溶液的碘量瓶中加入足量I2,充分搅拌溶解,待过量的固体碘沉于瓶底后,取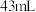 上层清液,用
上层清液,用 萃取,充分振荡、静置、分液,得到
萃取,充分振荡、静置、分液,得到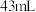 萃取后的水溶液、
萃取后的水溶液、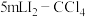 溶液。
溶液。Ⅱ.取萃取后的
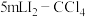 溶液于碘量瓶中,加水充分振荡,再加入质量分数为
溶液于碘量瓶中,加水充分振荡,再加入质量分数为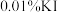 溶液,充分振荡后,静置5分钟,用
溶液,充分振荡后,静置5分钟,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗 溶液。
溶液。Ⅲ.将萃取后的水溶液
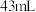 移入碘量瓶中,用
移入碘量瓶中,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗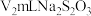 溶液。
溶液。已知:①
 ;②
;② 与
与 难溶于
难溶于 ;③室温下,达到溶解平衡后,
;③室温下,达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比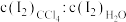 为86∶1
为86∶1回答下列问题:
(2)下列萃取分液操作中没有用到的仪器有_______(填标号)。
A. | B. | C. | D. |
 易溶于
易溶于 的原因是
的原因是(4)滴定过程中
 标准溶液应装在
标准溶液应装在(5)步骤Ⅱ中加入
 溶液的目的是
溶液的目的是(6)步骤Ⅲ测得萃取后的水溶液中
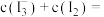
 ,平衡常数
,平衡常数
(7)下列关于实验误差分析的说法正确的是_______(填标号)。
A.步骤I中碘量瓶若没有充分振荡,则导致所测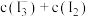 值偏大 值偏大 |
| B.步骤I中吸取上层清液时,不慎吸入碘固体,则测得的K偏小 |
| C.步骤Ⅱ中滴定前滴定管有气泡,滴定后气泡消失,则测得的K偏大 |
| D.步骤Ⅲ中滴定终点时俯视读数,则测得的K偏小 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)下列有关碳及其化合物的说法正确的是_______
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g) 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
①升高温度K值_______ (增大、减小),T温度时化学平衡常数K=_______ mol-1·L。
②从0~2s该反应的平均速率v(NO2)=_______ 。
③对可逆反应2NO(g)+O2(g) 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是_______ 。
A.混 合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.NO2、O2、NO的物质的量之比为2:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_______ (写出主要反应的离子方程式),该溶液中,c(Na+)_______ 2c(SO )+c(HSO
)+c(HSO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
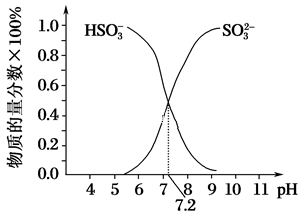
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO 的第一步水解平衡常数=
的第一步水解平衡常数=_______ 。
(1)下列有关碳及其化合物的说法正确的是_______
| A.CO2是导致酸雨的主要气体 |
B.CO2的电子式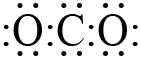 |
| C.金刚石、石墨与C60都是碳的同素异形体 |
| D.在高温条件下,碳能使CO2转变成CO |
 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值
②从0~2s该反应的平均速率v(NO2)=
③对可逆反应2NO(g)+O2(g)
 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是A.混 合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.NO2、O2、NO的物质的量之比为2:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
 )+c(HSO
)+c(HSO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。②在某NaHSO3、Na2SO3混合溶液中HSO
 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO 的第一步水解平衡常数=
的第一步水解平衡常数=
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
(1)Z在元素周期表中位于___________ 族。
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是___________ (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是___________ (填序号)。
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为_____________________ 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是_________________________ ,混合后溶液中离子浓度由大到小的顺序是__________________________ 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。
能确定混合物中Y的质量分数的数据有___________ (填序号)。
A.m、n B.m、y C.n、y
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元 素形成的简单离 子中,离子半径 最小 | 最高正价与最 低负价之和为 零 |
(1)Z在元素周期表中位于
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是
(3)①下列可作为比较X和Y金属性强弱的依据是
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中Y的质量分数的数据有
A.m、n B.m、y C.n、y
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】回答下列问题
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=___________ 。
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO )在溶液中呈紫红色。
)在溶液中呈紫红色。

①电解过程中,X极溶液的pH___________ (填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和___________ 。
(3)已知常温下:
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是___________ (用“>”连接,下同)。
②S2-、HS-、CO 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是___________ 。
③NaHSO3的水解常数Kh=___________ (保留 2位有效数字)。
④CH3COONH4溶液显___________ 性;NH4HCO3溶液显___________ 性。
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
①电解过程中,X极溶液的pH
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和
(3)已知常温下:
| 弱电解质 | H2S | H2CO3 | H2SO3 | CH3COOH | NH3· H2O |
| 电离常数 | Ka1=1.1 ×10 -7 Ka2=1.3 ×10-13 | Ka1=4.5 ×10-7 Ka2=4.7 ×10-11 | Ka1=1.4 ×10-2 Ka2=6.0 ×10-8 | Ka=1.8 ×10-5 | Kb=1.8 ×10-5 |
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是
②S2-、HS-、CO
 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是③NaHSO3的水解常数Kh=
④CH3COONH4溶液显
您最近一年使用:0次