名校
解题方法
1 . 大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂( )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的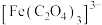 ,
,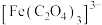 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g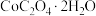 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定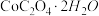 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。
 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
已知:
 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的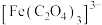 ,
,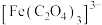 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)(3)将溶液中的
 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是(4)为证明操作④获得的
 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入(5)取3.66 g
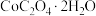 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为 ,
,
(6)某同学设计如图装置测定
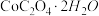 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
您最近一年使用:0次
名校
2 . 工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:

(1)“粉磨”的目的是_______ 。
(2)写出“滤渣1”的一种用途_______ 。
(3)“滤渣2”的主要成分是_______ (填化学式),“沉锰”过程_______ (填“能”或“不能”)用Na2CO3代替NH4HCO3。
(4)经检测,“浸取液”中无Fe2+,“浸取”时MnO2发生反应的离子方程式为_______ 。
(5)在“沉锰”操作中发生反应的离子方程式为_______ 。

(6)为测定“滤渣2”中铝元素的含量,设计以下方案:
①将m g滤渣2处理成a mL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为b mmol/L;
③另取少量①中溶液,用盐酸羟胺将Fe3+还原为Fe2+;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。该样品中Al元素的质量分数为_______ (用含字母的表达式表示,不必化简)。

(1)“粉磨”的目的是
(2)写出“滤渣1”的一种用途
(3)“滤渣2”的主要成分是
(4)经检测,“浸取液”中无Fe2+,“浸取”时MnO2发生反应的离子方程式为
(5)在“沉锰”操作中发生反应的离子方程式为

(6)为测定“滤渣2”中铝元素的含量,设计以下方案:
①将m g滤渣2处理成a mL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为b mmol/L;
③另取少量①中溶液,用盐酸羟胺将Fe3+还原为Fe2+;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。该样品中Al元素的质量分数为
您最近一年使用:0次
解题方法
3 . A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
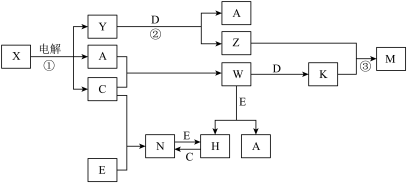
(1)Y的电子式为_____________ ,构成E单质的元素在周期表中位于______________ 。
(2)反应①的离子方程式为_________________ 反应③的离子方程式为________________
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式_________________________
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:_______________________ ,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为________________ (保留到小数点后两位)。

(1)Y的电子式为
(2)反应①的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
您最近一年使用:0次
2017-02-17更新
|
424次组卷
|
2卷引用:2017届江西省兴国中学、兴国三中等四校高三上第一次联考化学卷
4 . 某湿法炼锌的萃余液中含有 、
、 、
、 、
、 、
、 、
、 及
及 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:

已知:
(1)常温下,测得某种萃余液中硫酸的浓度为 ,则此溶液中
,则此溶液中
___________  。
。
(2)在酸性条件下,加入 氧化时,
氧化时, 转化为
转化为 除去,生成
除去,生成 反应的离子方程式为
反应的离子方程式为___________ 。
(3)常温下,中和时,先调节 约为1,加入适量的
约为1,加入适量的 氧化,再调节
氧化,再调节 为4.0,“沉渣”的主要成分除
为4.0,“沉渣”的主要成分除 外还有
外还有___________ ;若加入过量 ,钴元素将会进入“沉渣”中,则水解后的溶液中
,钴元素将会进入“沉渣”中,则水解后的溶液中 约为
约为___________  。
。
(4)“沉锌”时,在近中性条件下加入 可得碱式碳酸锌[
可得碱式碳酸锌[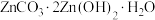 ]固体,同时产生大量气体,产生大量气体的原因是
]固体,同时产生大量气体,产生大量气体的原因是___________ 。
(5)不同质量分数的 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含
晶体的物种如图所示。欲从含
 及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”为
,“操作a”为___________ 。

 、
、 、
、 、
、 、
、 、
、 及
及 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图所示。回答下列问题:
已知:
| 沉淀物 |  |  |  |  |  |
 | 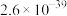 |  | 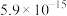 |  | 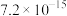 |
(1)常温下,测得某种萃余液中硫酸的浓度为
 ,则此溶液中
,则此溶液中
 。
。(2)在酸性条件下,加入
 氧化时,
氧化时, 转化为
转化为 除去,生成
除去,生成 反应的离子方程式为
反应的离子方程式为(3)常温下,中和时,先调节
 约为1,加入适量的
约为1,加入适量的 氧化,再调节
氧化,再调节 为4.0,“沉渣”的主要成分除
为4.0,“沉渣”的主要成分除 外还有
外还有 ,钴元素将会进入“沉渣”中,则水解后的溶液中
,钴元素将会进入“沉渣”中,则水解后的溶液中 约为
约为 。
。(4)“沉锌”时,在近中性条件下加入
 可得碱式碳酸锌[
可得碱式碳酸锌[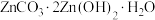 ]固体,同时产生大量气体,产生大量气体的原因是
]固体,同时产生大量气体,产生大量气体的原因是(5)不同质量分数的
 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含
晶体的物种如图所示。欲从含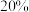
 及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”为
,“操作a”为
您最近一年使用:0次
2023·全国·模拟预测
名校
5 . 利用钛白废酸[含 、
、 、
、 等]和粉煤灰可资源再利用制备无机高分子絮凝剂−聚合硫酸硅酸铁铝(PFASS),工艺流程如下:
等]和粉煤灰可资源再利用制备无机高分子絮凝剂−聚合硫酸硅酸铁铝(PFASS),工艺流程如下:
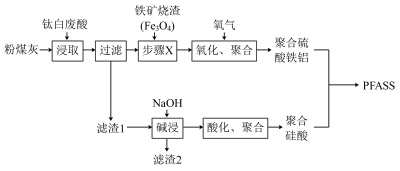
已知:①粉煤灰在酸中只有有限的溶解能力;
②粉煤灰的化学组成:
回答下列问题:
(1)一种铁−铝合金晶胞结构如图所示,该晶体的化学式为_______ 。其中基态铁原子价层电子排布式为_______ 。

(2)为提高浸取率,可采取的措施有_______ (填序号)。
A.加入合适的助溶剂 B.将粉煤灰加热处理 C.适当延长浸取时间
(3)“酸化、聚合”步骤加入的最佳试剂为_______ ;“碱浸”后所得滤液的主要成分为_______ 。
(4)通入氧气时发生反应的离子方程式:_______ 。
(5)步骤X加入铁矿烧渣的目的是_______ 。
(6)根据所学知识推测,与传统净水剂PAC(聚合氯化铝)相比,聚合硫酸硅酸铁铝聚合程度更_______ (填“大”或“小”),理由是_______ 。
(7)聚合硫酸硅酸铁铝可表示成 ,则
,则
_______ 。
 、
、 、
、 等]和粉煤灰可资源再利用制备无机高分子絮凝剂−聚合硫酸硅酸铁铝(PFASS),工艺流程如下:
等]和粉煤灰可资源再利用制备无机高分子絮凝剂−聚合硫酸硅酸铁铝(PFASS),工艺流程如下:
已知:①粉煤灰在酸中只有有限的溶解能力;
②粉煤灰的化学组成:
| 化学成分 |  |  |  | 其他 |
| 质量分数/% | 52.26 | 22.42 | 11.96 | 13.36 |
(1)一种铁−铝合金晶胞结构如图所示,该晶体的化学式为

(2)为提高浸取率,可采取的措施有
A.加入合适的助溶剂 B.将粉煤灰加热处理 C.适当延长浸取时间
(3)“酸化、聚合”步骤加入的最佳试剂为
(4)通入氧气时发生反应的离子方程式:
(5)步骤X加入铁矿烧渣的目的是
(6)根据所学知识推测,与传统净水剂PAC(聚合氯化铝)相比,聚合硫酸硅酸铁铝聚合程度更
(7)聚合硫酸硅酸铁铝可表示成
 ,则
,则
您最近一年使用:0次
名校
6 . 某湿法炼锌的萃余液中含有Na+、Zn2+、Fe2+、Mn2+、Co2+、Cd2+及30~60g·L-1H2SO4等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
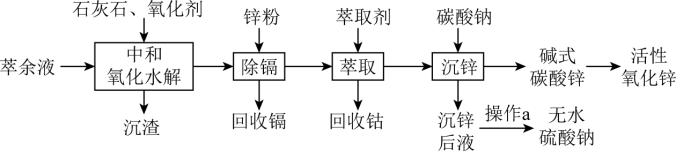
已知:
回答下列问题:
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的Na2S2O8;再加入石灰石调节溶液的pH为4.0。
①氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为_______ 。
②“沉渣”的主要成分除MnO2外还有_______ 。
③“氧化”时若加入过量的Na2S2O8,钴元素将会进入“沉渣”中,则水解后溶液中含钴微粒的浓度为_______ mol·L-1。
(2)“除镉”时,主要反应的离子方程式为_______ 。
(3)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。产生大量气体的原因是_______ 。
(4)不同质量分数的Na2SO4溶液在不同温度下析出Na2SO4晶体的物种如图所示。欲从含20%Na2SO4及微量杂质的“沉锌后液”中直接析出无水Na2SO4,“操作a”为_______ 。


已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Cd(OH)2 |
| Ksp | 2.6×10-39 | 4.9×10-17 | 5.9×10-15 | 1.6×10-44 | 7.2×10-15 |
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的Na2S2O8;再加入石灰石调节溶液的pH为4.0。
①氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为
②“沉渣”的主要成分除MnO2外还有
③“氧化”时若加入过量的Na2S2O8,钴元素将会进入“沉渣”中,则水解后溶液中含钴微粒的浓度为
(2)“除镉”时,主要反应的离子方程式为
(3)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。产生大量气体的原因是
(4)不同质量分数的Na2SO4溶液在不同温度下析出Na2SO4晶体的物种如图所示。欲从含20%Na2SO4及微量杂质的“沉锌后液”中直接析出无水Na2SO4,“操作a”为

您最近一年使用:0次
名校
解题方法
7 . 铬元素是一种重金属元素,工业上处理含铬废水并将其资源化的工艺有多种,其中两种工艺如下图所示:
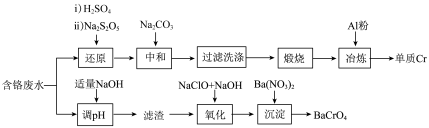
已知;①含铬废水中铬元素主要有 和
和 两种价态,
两种价态, 价铬在酸性环境中氧化性更强。
价铬在酸性环境中氧化性更强。
② 。
。
回答下列问题:
(1)“还原”时,先加入 酸化,再加入
酸化,再加入 固体,其发生反应的离子方程式为
固体,其发生反应的离子方程式为___________ ,若不加 酸化,可能造成的后果是
酸化,可能造成的后果是___________ 。
(2)“中和”过程中,有大量气泡生成,写出中和时产生 的离子方程式:
的离子方程式:___________ 。
(3)“过滤洗深”时,证明沉淀已洗涤干净的操作为:___________ 。
(4)“冶炼”时,该反应的能量主要转化形式为___________ 。
(5)“氧化”时,发生反应的化学方程式为:___________ 。
(6)已知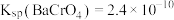 ,利用氧化法除铬时,欲使废液中铬元素的含量不高于
,利用氧化法除铬时,欲使废液中铬元素的含量不高于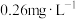 ,则此滤液中
,则此滤液中 的范围为
的范围为___________ 。

已知;①含铬废水中铬元素主要有
 和
和 两种价态,
两种价态, 价铬在酸性环境中氧化性更强。
价铬在酸性环境中氧化性更强。②
 。
。回答下列问题:
(1)“还原”时,先加入
 酸化,再加入
酸化,再加入 固体,其发生反应的离子方程式为
固体,其发生反应的离子方程式为 酸化,可能造成的后果是
酸化,可能造成的后果是(2)“中和”过程中,有大量气泡生成,写出中和时产生
 的离子方程式:
的离子方程式:(3)“过滤洗深”时,证明沉淀已洗涤干净的操作为:
(4)“冶炼”时,该反应的能量主要转化形式为
(5)“氧化”时,发生反应的化学方程式为:
(6)已知
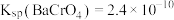 ,利用氧化法除铬时,欲使废液中铬元素的含量不高于
,利用氧化法除铬时,欲使废液中铬元素的含量不高于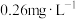 ,则此滤液中
,则此滤液中 的范围为
的范围为
您最近一年使用:0次
8 . 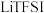 是一种亲水有机盐,其结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
是一种亲水有机盐,其结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是

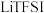 是一种亲水有机盐,其结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
是一种亲水有机盐,其结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
| A.C是空气中含量最高的元素 |
B.简单气态氢化物的稳定性: |
C. 与E的简单阴离子在溶液中能大量共存 与E的简单阴离子在溶液中能大量共存 |
| D.该化合物中只有A、C、D元素原子的最外层满足8电子稳定结构 |
您最近一年使用:0次
9 . 科学合理地从污泥中提取铜、镍等有价金属,无论从经济利益还是环保利益上都有深远的意义。氨浸-沉淀法金属回收率高,但是氨易挥发,相关技术目前还有待提升。常见的氨浸-沉淀法回收电镀污泥(主要金属元素及含量Ni:0.81%,Cu:0.94%,Fe:0.39%,Cr:1.14%,Ca:1.49%,Mg:2.02%)中的铜,大致流程如下:

已知:①氨浸液采用 缓冲体系;
缓冲体系;
②滤渣溶于稀硫酸后,金属元素存在形式:Fe2+、Fe3+、Cr3+、Ca2+、Mg2+;
③标准摩尔生成Gibbs自由能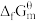 可以用来估算一个反应自发的趋势,如
可以用来估算一个反应自发的趋势,如 ,
,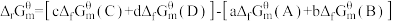
(1)沉淀1的主要成分是_______ (填化学式),操作2的名称为_______ 。
(2)标准状况下,氨浸过程中镍元素发生的主要反应为
 ,相关物质的标准摩尔生成焓如下表。
,相关物质的标准摩尔生成焓如下表。
①试分析该反应在_______ (填“高温”或“低温”)时有利于镍元素的浸取。
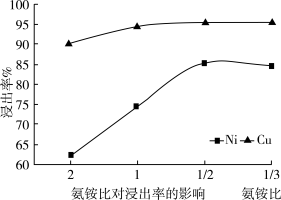
②氨浸液在总氨量一定前提下,相同条件下氨铵比对铜、镍浸出率影响情况如图所示,试从化学角度分析,当氨铵比从 变化至
变化至 时,镍的浸出率降低的可能原因是
时,镍的浸出率降低的可能原因是_______ 。
(3)实验证明溶解滤渣用的稀硫酸溶液,浓度以2mol/L最合适,结合流程信息分析,硫酸浓度不易过高或者过低的原因:_______ 。
(4)通常采用H2O2进行氧化过程,试写出铬元素在此过程中发生反应的离子方程式:_______ 。
(5)系列操作中,通常采用先水洗,再酸洗,然后反萃取得到含铜的溶液,而不采用先酸洗,再水洗的方式,试分析原因:_______ 。
(6)①电镀污泥在氨浸以后,如果能提前进行化学除杂,将对后续分离铜、镍有很大的帮助,通常我们用(NH4)3PO4溶液处理金属浸出液,查数据可知,此时 与(NH4)3PO4溶液反应的离子方程式为
与(NH4)3PO4溶液反应的离子方程式为 ;
; ,
,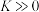 ,试回答可以用磷酸铵预处理浸出液的原因:
,试回答可以用磷酸铵预处理浸出液的原因:_______ 。
②常温下,关于0.05mol/L (NH4)3PO4溶液,下列说法正确的是_______ (填字母序号)。
A.可以用0.1mol/L的H3PO4溶液与0.1mol/L的NH3∙H2O溶液等体积混合制得(忽略混合时微小的体积变化)
B.由水电离的c(H+)=10-7mol∙L-1
C.溶液中粒子数目最多的是
D.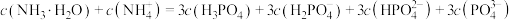

已知:①氨浸液采用
 缓冲体系;
缓冲体系;②滤渣溶于稀硫酸后,金属元素存在形式:Fe2+、Fe3+、Cr3+、Ca2+、Mg2+;
③标准摩尔生成Gibbs自由能
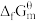 可以用来估算一个反应自发的趋势,如
可以用来估算一个反应自发的趋势,如 ,
,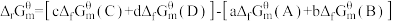
(1)沉淀1的主要成分是
(2)标准状况下,氨浸过程中镍元素发生的主要反应为

 ,相关物质的标准摩尔生成焓如下表。
,相关物质的标准摩尔生成焓如下表。标准摩尔生成焓 | ||||
 |  |  |  |  |
| -447.3 | -26.57 | -79.37 | -255.7 | -237.14 |
②氨浸液在总氨量一定前提下,相同条件下氨铵比对铜、镍浸出率影响情况如图所示,试从化学角度分析,当氨铵比从
 变化至
变化至 时,镍的浸出率降低的可能原因是
时,镍的浸出率降低的可能原因是
(3)实验证明溶解滤渣用的稀硫酸溶液,浓度以2mol/L最合适,结合流程信息分析,硫酸浓度不易过高或者过低的原因:
(4)通常采用H2O2进行氧化过程,试写出铬元素在此过程中发生反应的离子方程式:
(5)系列操作中,通常采用先水洗,再酸洗,然后反萃取得到含铜的溶液,而不采用先酸洗,再水洗的方式,试分析原因:
(6)①电镀污泥在氨浸以后,如果能提前进行化学除杂,将对后续分离铜、镍有很大的帮助,通常我们用(NH4)3PO4溶液处理金属浸出液,查数据可知,此时
 与(NH4)3PO4溶液反应的离子方程式为
与(NH4)3PO4溶液反应的离子方程式为 ;
; ,
,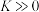 ,试回答可以用磷酸铵预处理浸出液的原因:
,试回答可以用磷酸铵预处理浸出液的原因:②常温下,关于0.05mol/L (NH4)3PO4溶液,下列说法正确的是
A.可以用0.1mol/L的H3PO4溶液与0.1mol/L的NH3∙H2O溶液等体积混合制得(忽略混合时微小的体积变化)
B.由水电离的c(H+)=10-7mol∙L-1
C.溶液中粒子数目最多的是

D.
您最近一年使用:0次
10 . 下列离子方程式正确的是
A.用次氯酸钠溶液吸收少量二氧化硫气体: |
B.少量草酸溶液加入到酸性高锰酸钾溶液中: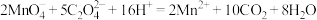 |
C.向 溶液中加入 溶液中加入 溶液得到沉淀的化学式可以表示为 溶液得到沉淀的化学式可以表示为 ,则发生的离子方程式为 ,则发生的离子方程式为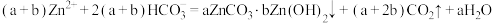 |
D.用酸性重铬酸钾溶液测定白酒中乙醇的含量: |
您最近一年使用:0次



