名校
解题方法
1 . 下列说法不正确的是
| A.在一定条件下,Na2S溶液加入CuSO4固体,HS-浓度减小 |
| B.加水稀释,水解常数Kh增大,pH减小 |
| C.25℃时,Ka(HCOOH)=1.0×10-4,该温度下HCOO-的水解常数为1.0×10-10 |
| D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大 |
您最近一年使用:0次
2023-08-14更新
|
689次组卷
|
4卷引用:河南省宜阳县第一高级中学2023-2024学年高二上学期能力达标测试化学试题
名校
解题方法
2 . X、Y、Z、M、W五种主族元素位于前四周期,原子序数依次增大,且这五种元素的最外层电子数之和为16。其中X、Y、Z、M为短周期主族元素,M的最外层电子数为Z的两倍,只有Y、M位于同一主族,且只有Z、M位于同一周期。
回答下列问题:
(1)X、Y、M的有关化学键键能如表所示,简要分析和解释下列有关事实:
①Y与M位于同一主族,但Y元素形成的物质种类远多于M元素形成的物质种类,原因为______ 。
②稳定性:YX4_____ (填“>”或“<”)MX4。
(2)由Y原子与M原子以1∶1的个数比相互交替结合形成晶体(Q)。则Q的化学式为______ 。
(3)在元素周期表中,某些主族元素与其右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则,在前三周期元素中,若元素R与元素Z是“对角关系”,则在加热条件下,单质R与氧气发生反应的化学方程式为______ 。
(4)常温下,X3WO4的电离平衡常数如表所示:
①请根据结构与性质的关系解释X3WO4第一步电离大于第二步电离的原因:______ 。_______ (lg2≈0.3)。
回答下列问题:
(1)X、Y、M的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | Y-Y | Y-X | M-M | M-X |
| 键能/(kJ•mol-1) | 356 | 413 | 226 | 318 |
②稳定性:YX4
(2)由Y原子与M原子以1∶1的个数比相互交替结合形成晶体(Q)。则Q的化学式为
(3)在元素周期表中,某些主族元素与其右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则,在前三周期元素中,若元素R与元素Z是“对角关系”,则在加热条件下,单质R与氧气发生反应的化学方程式为
(4)常温下,X3WO4的电离平衡常数如表所示:
| 电离平衡常数 | Ka1 | Ka2 | Ka3 |
| X3WO4 | 5×10-3 | 2×10-7 | 4.0×10-12 |
②已知磷酸的结构式为 ,请画出X3WO4分子的结构:
,请画出X3WO4分子的结构:
您最近一年使用:0次
2023-04-16更新
|
110次组卷
|
4卷引用:河南省周口市项城市五校联考2022-2023学年高二下学期4月月考化学试题
3 . 某研究小组利用电位滴定法研究盐酸滴加亚磷酸钠 溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法
溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法不正确 的是 是二元弱酸,其电离常数分别是
是二元弱酸,其电离常数分别是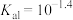 ,
, ]
]
 溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法
溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法
 是二元弱酸,其电离常数分别是
是二元弱酸,其电离常数分别是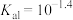 ,
, ]
]A.a点对应溶液的溶质为 和 和 , , |
B.第二次电极电位突跃发生的化学反应为: |
C.c点对应的溶液中可能存在: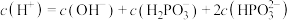 |
| D.水的电离程度:a>b |
您最近一年使用:0次
2023-04-13更新
|
1770次组卷
|
14卷引用:河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题-高中化学
河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题-高中化学湖州、衢州、丽水三地市2023届高三4月教学质量检测试化学试题(已下线)化学-2023年高考押题预测卷01(江苏卷)(含考试版、全解全析、参考答案、答题卡)(已下线)化学-2023年高考押题预测卷01(浙江卷)(含考试版、全解全析、参考答案、答题卡)(已下线)专题8 新概念应用湖北省荆州市沙市中学2023届高三模拟预测化学试题湖北省武昌实验中学2023届高三下学期高考适应性考试化学试题湖南省衡阳市第八中学2023届高三模拟预测化学试题(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖北省武汉市第十一中学2023-2024学年高三上学期10月月考化学试题(已下线)选择题11-15广西名校2023-2024学年高三上学期仿真卷(一)化学试题 四川省成都市第七中学2023-2024学年高三上学期期末考试理科综合试卷-高中化学(已下线)压轴题07 水溶液中微粒变化图像题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
2023·河北石家庄·一模
名校
4 . 已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中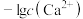 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
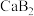 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中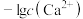 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
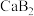 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数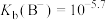 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1856次组卷
|
12卷引用:化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升
(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)热点18 电解质溶液图像分析
名校
5 . 回答下列问题:
(1)已知25℃时, 的
的 mol·L
mol·L ,则当溶液中
,则当溶液中 时,溶液的
时,溶液的
_______ 。
(2)0.1 mol·L
 溶液中
溶液中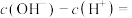
_______ (用含 、
、 的关系式表示)。
的关系式表示)。
(3)向 溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:_______ 。
(4)用电解法将 转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生
转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生 的电极反应式为
的电极反应式为_______ ,若阴极只产生HCOOH,则相同条件下Pt电极产生的 与Cu电极上产生的HCOOH的物质的量之比为
与Cu电极上产生的HCOOH的物质的量之比为_______ 。

(1)已知25℃时,
 的
的 mol·L
mol·L ,则当溶液中
,则当溶液中 时,溶液的
时,溶液的
(2)0.1 mol·L

 溶液中
溶液中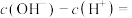
 、
、 的关系式表示)。
的关系式表示)。(3)向
 溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:(4)用电解法将
 转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生
转化为燃料是实现碳循环的一种途径,原理如图所示。铜电极上产生 的电极反应式为
的电极反应式为 与Cu电极上产生的HCOOH的物质的量之比为
与Cu电极上产生的HCOOH的物质的量之比为
您最近一年使用:0次
6 . 室温下某湖水中几种微粒的浓度与pH的关系如下图所示。已知水中现存的CO₂以H2CO₃形式计算作数据近似处理。下列说法错误的是


A.室温下 的水解常数Kh=10-7.7 的水解常数Kh=10-7.7 |
| B.向交点②所示的溶液中通入少量HCl气体可变为交点① |
| C.交点③对应溶液pH≈5.65 |
D.上述溶液室温下pH=8.3时:c( )>c(OH-)>c( )>c(OH-)>c( ) ) |
您最近一年使用:0次
名校
7 . 乙二酸( 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
(1)草酸第一步电离的电离方程式为___________________________ 。
(2)草酸可用来测定未知浓度的 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。
①实验过程中,草酸应用___________ (填“酸式”或“碱式”)滴定管盛装。
②判断达到滴定终点时的现象为_______________________________________________________ 。
③若滴定完成后仰视读数,则测得的 溶液浓度
溶液浓度___________ (“偏高”、“偏低”或“无影响”)。
(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:
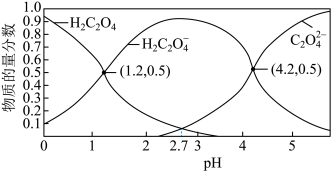
已知:常温下, 的电离平衡常数
的电离平衡常数 ,
, 。
。
①常温下,草酸的电离平衡常数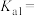
___________ 。
②相同条件下,物质的量浓度均为0.1 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH__________ (填“大”或“小”)。
③常温下,向10mL 0.1
 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中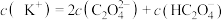 时,加入的V(KOH溶液)
时,加入的V(KOH溶液)___________ (填“>”、“=”或“<”)10mL,若加入KOH溶液体积为10mL溶液中 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为________________________ 。
 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。(1)草酸第一步电离的电离方程式为
(2)草酸可用来测定未知浓度的
 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。①实验过程中,草酸应用
②判断达到滴定终点时的现象为
③若滴定完成后仰视读数,则测得的
 溶液浓度
溶液浓度(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:

已知:常温下,
 的电离平衡常数
的电离平衡常数 ,
, 。
。①常温下,草酸的电离平衡常数
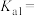
②相同条件下,物质的量浓度均为0.1
 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH③常温下,向10mL 0.1

 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中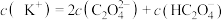 时,加入的V(KOH溶液)
时,加入的V(KOH溶液) 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为
您最近一年使用:0次
2023-02-11更新
|
186次组卷
|
2卷引用:河南省名校2022-2023学年高二下学期开学考试化学试题
8 . 已知25℃时:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=4.0×10-8、lg2=0.3;Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=2.6×10-9。
(1)0.4 mol/LHClO溶液的pH=_______ 。
(2)0.4 mol/LNaClO溶液的pH=_______ 。向该溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3_______ mol(忽略过程中溶液体积的变化)。
(1)0.4 mol/LHClO溶液的pH=
(2)0.4 mol/LNaClO溶液的pH=
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3
您最近一年使用:0次
9 . 一种捕集烟气中CO2的过程如图所示。室温下以0.1mol∙L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c( )+c(
)+c( )。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是
)。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是

 )+c(
)+c( )。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是
)。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是 
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c( ) ) |
B.KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c( )+c(H2CO3) )+c(H2CO3) |
C.KOH溶液吸收CO2,c总=0.1mol∙L-1溶液中:c(H2CO3)>c( ) ) |
| D.如图所示的“吸收”“转化”过程中,溶液的温度下降 |
您最近一年使用:0次
2022-07-21更新
|
8720次组卷
|
21卷引用:河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学(宏奥班)试题
河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学(宏奥班)试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题1-13(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)天津市第一中学2022-2023学年高三下学期第四次月考化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题11-13)(已下线)专题卷13 溶液中粒子浓度大小比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第4讲 盐类的水解(已下线)微专题 溶液中“粒子”浓度关系福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷
解题方法
10 . 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)
(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是_______ (填字母)。
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量_______ (填“增加”“减小”或“不变”)。
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_______ 。
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:_______ 。
②pH=2.2时,溶液c(H2A):c(HA-)=_______ 。
③0.1 mol∙L−1NaHA溶液显_______ (填“酸性 ”碱性”或“中性”) 。
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是_______ (填化学式)。

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=_______ 。
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:
②pH=2.2时,溶液c(H2A):c(HA-)=
③0.1 mol∙L−1NaHA溶液显
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=
您最近一年使用:0次



