1 . 氧族元素及其化合物在生产、生活中发挥着重要的作用。回答下列问题:
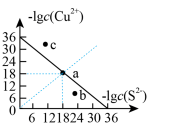
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下 饱和溶液中,
饱和溶液中,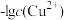 和
和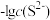 关系如图所示,
关系如图所示,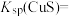
___________ ;图中a、b、c三点对应的溶液中,一定存在 沉淀的是
沉淀的是___________ (填序号)。
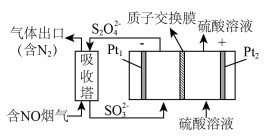
(2)工业上常用连二亚硫酸钠 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为___________ 。吸收塔内每吸收 的
的 ,理论上
,理论上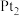 电极上会放出
电极上会放出___________  气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸( )和硒酸(
)和硒酸( ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸( )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
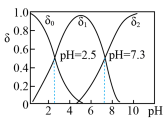
①将 滴入
滴入 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是___________ 。
②25℃时,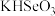 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:___________ 。
③已知硒酸的电离方程式为: ,
, 。25℃时,下列关于
。25℃时,下列关于
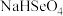 溶液的说法错误的是
溶液的说法错误的是___________ 。
A.
B.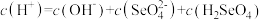
C.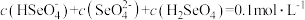
D.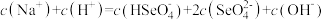
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下
 饱和溶液中,
饱和溶液中,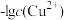 和
和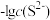 关系如图所示,
关系如图所示,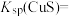
 沉淀的是
沉淀的是
(2)工业上常用连二亚硫酸钠
 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为 的
的 ,理论上
,理论上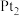 电极上会放出
电极上会放出 气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(
 )和硒酸(
)和硒酸(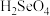 ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸( )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
①将
 滴入
滴入 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是②25℃时,
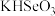 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:③已知硒酸的电离方程式为:
 ,
, 。25℃时,下列关于
。25℃时,下列关于
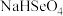 溶液的说法错误的是
溶液的说法错误的是A.

B.
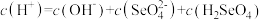
C.
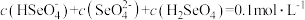
D.
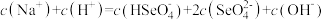
您最近一年使用:0次
解题方法
2 . 水体中的含氮化合物是引起富营养化的主要污染物,控制水体中的含氮污染物,对水资源的循环利用意义重大。
25℃时,亚硝酸( )和连二次硝酸(
)和连二次硝酸( )的电离常数如下表所示:
)的电离常数如下表所示:
(1)下列不能说明 是弱电解质的是
是弱电解质的是___________ (填序号)。
A.室温下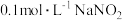 溶液的
溶液的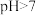
B.用一定浓度的 溶液做导电实验,灯泡很暗
溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和 溶液分别与足量锌反应,
溶液分别与足量锌反应, 溶液放出的氢气较多
溶液放出的氢气较多
(2) 溶液呈
溶液呈___________ 性(填“酸”“碱”或“中”),原因是___________ (用离子方程式表示)。
(3)室温下,物质的量浓度相同的溶液: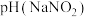
___________ 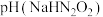 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)25℃时,用 的
的 溶液滴定
溶液滴定 溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为
溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为___________ 。
(5)亚硝酸盐对人体健康的损害不亚于农药,可采用电解含 、
、 废水的方法除去
废水的方法除去 (生成物为
(生成物为 ,同时再生
,同时再生 ,其原理如图所示。
,其原理如图所示。
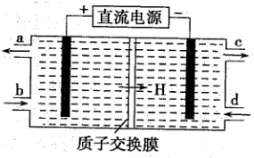
① 从电解槽的
从电解槽的___________ (填字母)口流出。
②写出阴极的电极反应式___________ 。
(6)新的研究表明,将含 的废水与含
的废水与含 的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为
的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为___________ 。
25℃时,亚硝酸(
 )和连二次硝酸(
)和连二次硝酸( )的电离常数如下表所示:
)的电离常数如下表所示:| 化学式 |  |  |
| 电离常数 | 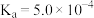 | 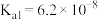 、 、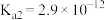 |
(1)下列不能说明
 是弱电解质的是
是弱电解质的是A.室温下
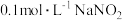 溶液的
溶液的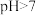
B.用一定浓度的
 溶液做导电实验,灯泡很暗
溶液做导电实验,灯泡很暗C.等pH、等体积的盐酸和
 溶液分别与足量锌反应,
溶液分别与足量锌反应, 溶液放出的氢气较多
溶液放出的氢气较多(2)
 溶液呈
溶液呈(3)室温下,物质的量浓度相同的溶液:
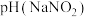
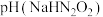 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)25℃时,用
 的
的 溶液滴定
溶液滴定 溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为
溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为(5)亚硝酸盐对人体健康的损害不亚于农药,可采用电解含
 、
、 废水的方法除去
废水的方法除去 (生成物为
(生成物为 ,同时再生
,同时再生 ,其原理如图所示。
,其原理如图所示。
①
 从电解槽的
从电解槽的②写出阴极的电极反应式
(6)新的研究表明,将含
 的废水与含
的废水与含 的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为
的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为
您最近一年使用:0次
解题方法
3 . (1)已知常温下浓度为 的几种溶液的
的几种溶液的 如表
如表
①同温度同浓度下,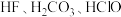 三种酸由强到弱的顺序为
三种酸由强到弱的顺序为_______
② 溶液呈碱性的原因
溶液呈碱性的原因_______ (离子方程式表示)
③下列能说明碳与硫两种元素非金属性强弱的是_______
A、酸性:
B、相同条件下水溶液的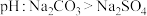
C、S与 的化合比C与
的化合比C与 的化合更容易
的化合更容易
④“84”消毒剂(有效成分为 ),可用它浸泡、擦拭物品,喷洒空气,对地面进行消毒,以达到杀灭大多数病菌和部分病毒的目的。
),可用它浸泡、擦拭物品,喷洒空气,对地面进行消毒,以达到杀灭大多数病菌和部分病毒的目的。 的电子式为
的电子式为_______ “84”消毒剂在空气中能生成 杀菌消毒的离子方程式
杀菌消毒的离子方程式_______
⑤常温下, 的
的 溶液中,
溶液中,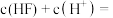
_______ 
(2)工业上可用 溶液吸收法处理
溶液吸收法处理 ,已知亚硫酸的电离常数
,已知亚硫酸的电离常数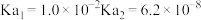
①说明 溶液显酸性的原因:
溶液显酸性的原因:_______
② 时,用
时,用 的
的 溶液吸收
溶液吸收 ,当溶液
,当溶液 时,溶液中各离子浓度的大小关系为
时,溶液中各离子浓度的大小关系为_______ (忽略溶液体积的变化);若向该溶液中加入少量的 ,则溶液中
,则溶液中 将
将_______ (填“增大”减小”或“不变”)
 的几种溶液的
的几种溶液的 如表
如表| 溶质 |  |  |  |  |
 | 7.5 | 11.6 | 8.3 | 9.7 |
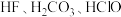 三种酸由强到弱的顺序为
三种酸由强到弱的顺序为②
 溶液呈碱性的原因
溶液呈碱性的原因③下列能说明碳与硫两种元素非金属性强弱的是
A、酸性:

B、相同条件下水溶液的
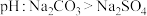
C、S与
 的化合比C与
的化合比C与 的化合更容易
的化合更容易④“84”消毒剂(有效成分为
 ),可用它浸泡、擦拭物品,喷洒空气,对地面进行消毒,以达到杀灭大多数病菌和部分病毒的目的。
),可用它浸泡、擦拭物品,喷洒空气,对地面进行消毒,以达到杀灭大多数病菌和部分病毒的目的。 的电子式为
的电子式为 杀菌消毒的离子方程式
杀菌消毒的离子方程式⑤常温下,
 的
的 溶液中,
溶液中,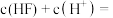

(2)工业上可用
 溶液吸收法处理
溶液吸收法处理 ,已知亚硫酸的电离常数
,已知亚硫酸的电离常数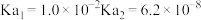
①说明
 溶液显酸性的原因:
溶液显酸性的原因:②
 时,用
时,用 的
的 溶液吸收
溶液吸收 ,当溶液
,当溶液 时,溶液中各离子浓度的大小关系为
时,溶液中各离子浓度的大小关系为 ,则溶液中
,则溶液中 将
将
您最近一年使用:0次
解题方法
4 . 氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程___________ 。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)___________ pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=___________ (保留三位有效数字)。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
反应II:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJ•mol-1。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________ 。
②图2中能正确反应平衡常数K随温度变化关系的曲线为___________ (填字母标号)。

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为___________ 。
(1)水能发生自偶电离2H2O
 H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)
 NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;反应II:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;反应III:H2O(l)═H2O(g) △H3=+44.0kJ•mol-1。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为
②图2中能正确反应平衡常数K随温度变化关系的曲线为

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为
您最近一年使用:0次
5 . 锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:

已知:①Ksp[Fe(OH)3]=4.0×10-38,Ksp(FePO4·xH2O)=1.0×10-15。
②葡萄糖分子式为C6H12O6
回答下列问题:
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是_________ 。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________ 等离子。
(3)取三组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
固体失重质量分数=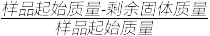 100%
100%
则x=________ (精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________ 。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________ 。
(6)H3PO4是三元酸,如图是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO 第一步水解的水解常数K1的数值最接近
第一步水解的水解常数K1的数值最接近________ (填字母)。

A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2

已知:①Ksp[Fe(OH)3]=4.0×10-38,Ksp(FePO4·xH2O)=1.0×10-15。
②葡萄糖分子式为C6H12O6
回答下列问题:
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的
(3)取三组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数/% | 19.9 | 20.1 | 20.0 |
固体失重质量分数=
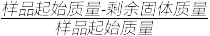 100%
100%则x=
(4)步骤Ⅲ中研磨的作用是
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为
(6)H3PO4是三元酸,如图是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO
 第一步水解的水解常数K1的数值最接近
第一步水解的水解常数K1的数值最接近
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
您最近一年使用:0次
2020-11-29更新
|
177次组卷
|
2卷引用:湖北省部分省重点中学2020-2021学年高二上学期期中联考化学试题
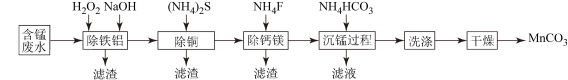
6 . 以工业生产中排放的含锰酸性废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+等离子)为原料,生产MnCO3的工艺流程如图:
已知:25℃时,几种金属离子沉淀时的pH如下:
25℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为___ ,调节溶液的pH范围是___ 。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中 =
=____ 。
(2)沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。

①沉锰过程发生反应的离子方程式为___ 。
②当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是___ 。
(3)沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是___ 。MnCO3和磷酸在一定条件下反应可生成马日夫盐[Mn(H2PO4)2·2H2O],其用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。马日夫盐溶液显___ 性(填“酸”或“碱”)(已知:H3PO4的电离常数Ka1=7.52×10-3,Ka2=6.23×10-8,Ka3=2.2×10-13)。

已知:25℃时,几种金属离子沉淀时的pH如下:
| Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | Ca2+ | Mg2+ | |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 | 11.8 | 9.8 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 | 13.8 | 11.8 |
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中
 =
=(2)沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。

①沉锰过程发生反应的离子方程式为
②当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是
(3)沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是
您最近一年使用:0次
名校
7 . 草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=__ 。
②已知H2C2O4是二元弱酸。室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,KHC2O4水解平衡常数的数值为_______ 。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ,准确称取1.770 0 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900 g。
步骤Ⅱ,准确称取1.770 0 g样品,用NH3·H2O-NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ,准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.050 00 mol·L-1的EDTA标准溶液滴定至终点(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。重复上述滴定操作两次,有关数据记录如下表:
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有________ (填字母)。
A. 锥形瓶水洗后未干燥
B. 滴定时锥形瓶中有液体溅出
C. 装EDTA标准溶液的滴定管水洗后未润洗
D. 开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式(写出计算过程)___________ 。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=
②已知H2C2O4是二元弱酸。室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,KHC2O4水解平衡常数的数值为
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ,准确称取1.770 0 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900 g。
步骤Ⅱ,准确称取1.770 0 g样品,用NH3·H2O-NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ,准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.050 00 mol·L-1的EDTA标准溶液滴定至终点(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。重复上述滴定操作两次,有关数据记录如下表:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 消耗EDTA标准溶液的体积/mL | 25.92 | 24.99 | 25.01 |
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有
A. 锥形瓶水洗后未干燥
B. 滴定时锥形瓶中有液体溅出
C. 装EDTA标准溶液的滴定管水洗后未润洗
D. 开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式(写出计算过程)
您最近一年使用:0次
8 . 实验室模拟用 溶液和
溶液和 溶液混合制备
溶液混合制备 ,再将所得
,再将所得 与
与 溶液混合,可制备草酸合铜酸钾晶体
溶液混合,可制备草酸合铜酸钾晶体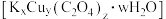 。通过下述实验确定该晶体的组成。
。通过下述实验确定该晶体的组成。
步骤Ⅰ 称取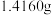 样品,放入锥形瓶,加入适量
样品,放入锥形瓶,加入适量 稀硫酸,微热使样品溶解,再加入
稀硫酸,微热使样品溶解,再加入 水加热,用
水加热,用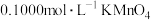 溶液滴定至终点,消耗
溶液滴定至终点,消耗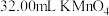 溶液。
溶液。
步骤Ⅱ 将步骤Ⅰ的溶液充分加热,使淡紫红色消失,溶液最终显示蓝色。冷却后,调节 并加入过量
并加入过量 固体,与
固体,与 反应生成
反应生成 沉淀和
沉淀和 ,以淀粉作指示剂,用
,以淀粉作指示剂,用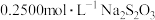 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗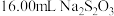 标准溶液。
标准溶液。
已知: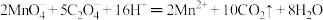 ;
;
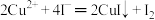 ;
;
回答下列问题:
(1)室温下,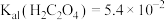 ,
,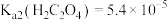 ,
,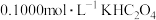 溶液
溶液
________ 7(填“>”或“<”或“=”)。
(2)步骤Ⅱ中滴定终点的现象为________ 。
(3)步骤Ⅱ中若消耗的 标准溶液的体积偏大,可能的原因有
标准溶液的体积偏大,可能的原因有________ (填字母)。
A.滴定前未将待测溶液充分加热
B.锥形瓶水洗后未干燥
C.装 标准溶液的滴定管水洗后未润洗
标准溶液的滴定管水洗后未润洗
D.滴定时锥形瓶中有液体溅出
(4)通过计算确定该晶体的化学式(写出计算过程)。
________________________
 溶液和
溶液和 溶液混合制备
溶液混合制备 ,再将所得
,再将所得 与
与 溶液混合,可制备草酸合铜酸钾晶体
溶液混合,可制备草酸合铜酸钾晶体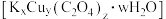 。通过下述实验确定该晶体的组成。
。通过下述实验确定该晶体的组成。步骤Ⅰ 称取
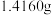 样品,放入锥形瓶,加入适量
样品,放入锥形瓶,加入适量 稀硫酸,微热使样品溶解,再加入
稀硫酸,微热使样品溶解,再加入 水加热,用
水加热,用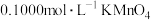 溶液滴定至终点,消耗
溶液滴定至终点,消耗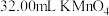 溶液。
溶液。步骤Ⅱ 将步骤Ⅰ的溶液充分加热,使淡紫红色消失,溶液最终显示蓝色。冷却后,调节
 并加入过量
并加入过量 固体,与
固体,与 反应生成
反应生成 沉淀和
沉淀和 ,以淀粉作指示剂,用
,以淀粉作指示剂,用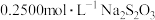 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗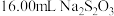 标准溶液。
标准溶液。已知:
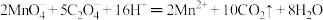 ;
;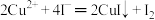 ;
;
回答下列问题:
(1)室温下,
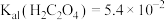 ,
,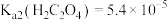 ,
,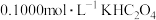 溶液
溶液
(2)步骤Ⅱ中滴定终点的现象为
(3)步骤Ⅱ中若消耗的
 标准溶液的体积偏大,可能的原因有
标准溶液的体积偏大,可能的原因有A.滴定前未将待测溶液充分加热
B.锥形瓶水洗后未干燥
C.装
 标准溶液的滴定管水洗后未润洗
标准溶液的滴定管水洗后未润洗D.滴定时锥形瓶中有液体溅出
(4)通过计算确定该晶体的化学式(写出计算过程)。
您最近一年使用:0次
2020-07-17更新
|
220次组卷
|
2卷引用:江苏省扬州市2019-2020学年高二下学期期末调研化学(A卷)试题
解题方法
9 . 某地有软锰矿(主要成分 MnO2,含少量 SiO2和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。

(1)以 FeS 为例,写出生成硫磺的反应方程式____ 。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________ ,残留的固体杂质可能是_________________ 。
(3)写出物质 A 和 B的化学式_____ 、_____ 。
(4)不在滤液Ⅱ中直接加入 Na2CO3的原因是_____ 。
(5)电解时的阴极材料为_____ ,阳极的电极反应式为_______________ 。
(6)已知 H2CO3的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3和 NaHCO3 的混合溶液的 pH 约为___________ (lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____ 向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________


(1)以 FeS 为例,写出生成硫磺的反应方程式
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是
(3)写出物质 A 和 B的化学式
(4)不在滤液Ⅱ中直接加入 Na2CO3的原因是
(5)电解时的阴极材料为
(6)已知 H2CO3的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3和 NaHCO3 的混合溶液的 pH 约为

您最近一年使用:0次
名校
10 . 三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
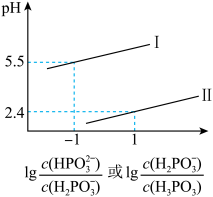
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg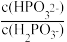 的是曲线
的是曲线_____ (填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____ ,反应HPO32-+H2O H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是_____ 。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg
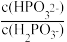 的是曲线
的是曲线 H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=

您最近一年使用:0次
2020-04-03更新
|
792次组卷
|
4卷引用:湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练



