名校
解题方法
1 . 硫酸亚铁铵 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
Ⅱ.抽滤,在得到的滤液中添加足量 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;
Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为___________ ,该步骤要在通风橱中进行,其目的是___________ ;若铁屑中混有少量FeS,需将生成的气体通入 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH___________ (填“升高”“降低”或“不变”)。
(2)“步骤Ⅱ”中用3 mol⋅L 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是___________ , 时该溶液中
时该溶液中
___________ (实验条件下, 的电离常数
的电离常数 、
、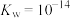 ,保留两位有效数字)。
,保留两位有效数字)。
(3)“步骤Ⅲ”中用酒精灯加热蒸发至___________ 时,停止加热;用无水乙醇洗涤晶体的目的是___________ 。
(4)该实验中硫酸亚铁铵的产率为___________ 。
 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L
 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;Ⅱ.抽滤,在得到的滤液中添加足量
 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为
 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH(2)“步骤Ⅱ”中用3 mol⋅L
 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是 时该溶液中
时该溶液中
 的电离常数
的电离常数 、
、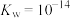 ,保留两位有效数字)。
,保留两位有效数字)。(3)“步骤Ⅲ”中用酒精灯加热蒸发至
(4)该实验中硫酸亚铁铵的产率为
您最近一年使用:0次
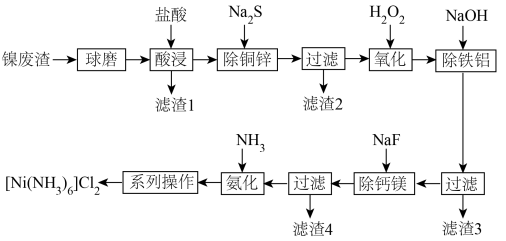
2 . [Ni(NH3)6]Cl2在有机合成中有广泛应用。以镍废渣(主要含Ni、CuO、FeO、ZnO、Al2O3、MgO、CaCO3和SiO2)为原料制备[Ni(NH3)6]Cl2的工艺流程如下。回答下列问题: 都不能氧化
都不能氧化 。
。
②25℃时,几种氢氧化物和氟化物的 如表所示:
如表所示:
③25℃时,几种金属硫化物的 如表所示:
如表所示:
(1)“酸浸”之前“球磨”,目的是___________ ,“酸浸”时适当加热可以提高反应速率,但是温度过高,速率反而减小,其原因是___________ 。
(2)“除铜锌”时,测得溶液中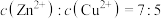 ,最先沉淀的离子是
,最先沉淀的离子是___________ (填离子符号,下同),若溶液中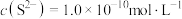 ,此时溶液中被除干净的离子是
,此时溶液中被除干净的离子是___________ (当溶液中某离子的浓度小于或等于 时,认为该离子已被除干净)。
时,认为该离子已被除干净)。
(3)Na2S溶液呈碱性的原因是___________ (用离子方程式表示)。
(4)“除铁铝”中, 时,
时,
___________  。
。
(5)已知常温下, ,则NaF的水解常数
,则NaF的水解常数
___________ ;“除钙镁”时,不能选用玻璃仪器,其原因是___________ 。
 都不能氧化
都不能氧化 。
。②25℃时,几种氢氧化物和氟化物的
 如表所示:
如表所示:| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | CaF2 | MgF2 |
 | 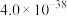 | 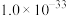 | 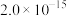 |  |  |
 如表所示:
如表所示:| 金属硫化物 | FeS | NiS | CuS | ZnS |
 | 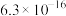 |  | 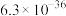 | 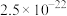 |
(1)“酸浸”之前“球磨”,目的是
(2)“除铜锌”时,测得溶液中
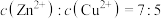 ,最先沉淀的离子是
,最先沉淀的离子是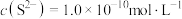 ,此时溶液中被除干净的离子是
,此时溶液中被除干净的离子是 时,认为该离子已被除干净)。
时,认为该离子已被除干净)。(3)Na2S溶液呈碱性的原因是
(4)“除铁铝”中,
 时,
时,
 。
。(5)已知常温下,
 ,则NaF的水解常数
,则NaF的水解常数
您最近一年使用:0次
2024-01-19更新
|
123次组卷
|
2卷引用:江西省部分学校2023-2024学年高三上学期12月月考化学试题
3 . 草酸亚铁 作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
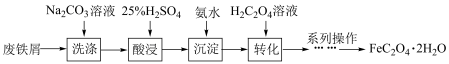
Ⅰ、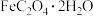 为淡黄色固体,难溶于水。
为淡黄色固体,难溶于水。
Ⅱ、25℃时,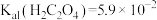 、
、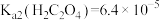 。
。
Ⅲ、25℃时,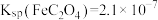 、
、 。
。
(1)用热的饱和碳酸钠溶液洗涤废铁屑的原因是_____ 。
(2)由题中信息判断,25℃时,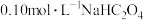 溶液中存在:
溶液中存在: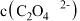
_____  (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(3)“转化”步骤在如图所示的装置中进行。

仪器X的名称是_____ ,导管A的作用是_____ 。
(4)“转化”步骤的离子方程式为_____。
(5)说明“转化”步骤中不能用 溶液代替
溶液代替 溶液的原因
溶液的原因_____ 。
(6)流程图中“系列操作”指的是_____ 。
A.过滤、洗涤、干燥
B.蒸发结晶、趁热过滤、洗涤、干燥
C.蒸发浓缩、冷却结晶、过滤、洗涤、干燥
上述制备的草酸亚铁晶体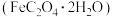 含有
含有 杂质,测定其纯度步骤如下:
杂质,测定其纯度步骤如下:
①准确称取 草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
②取20.00mL①中所得的溶液,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。
③向滴定后的溶液中加入适量锌粉充分反应后,过滤,洗涤,洗涤液并入滤液中。
④继续用 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 。
。
已知:
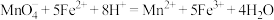
(7)配制上述100mL溶液,用到的玻璃仪器除了玻璃棒、烧杯外,还有_____ 。
(8)步骤②滴定终点的现象为_____ ;步骤③中加入锌粉的目的是_____ 。
(9)草酸亚铁晶体样品的纯度为_____ 。(用 、
、 、
、 、
、 表示)
表示)
 作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。以废铁屑为原料生产草酸亚铁的流程如下:
Ⅰ、
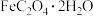 为淡黄色固体,难溶于水。
为淡黄色固体,难溶于水。Ⅱ、25℃时,
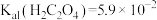 、
、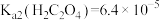 。
。Ⅲ、25℃时,
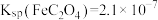 、
、 。
。(1)用热的饱和碳酸钠溶液洗涤废铁屑的原因是
(2)由题中信息判断,25℃时,
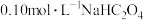 溶液中存在:
溶液中存在: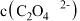
 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(3)“转化”步骤在如图所示的装置中进行。

仪器X的名称是
(4)“转化”步骤的离子方程式为_____。
A.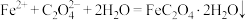 |
B.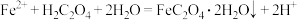 |
C.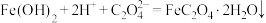 |
D.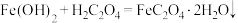 |
(5)说明“转化”步骤中不能用
 溶液代替
溶液代替 溶液的原因
溶液的原因(6)流程图中“系列操作”指的是
A.过滤、洗涤、干燥
B.蒸发结晶、趁热过滤、洗涤、干燥
C.蒸发浓缩、冷却结晶、过滤、洗涤、干燥
上述制备的草酸亚铁晶体
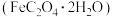 含有
含有 杂质,测定其纯度步骤如下:
杂质,测定其纯度步骤如下:①准确称取
 草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。②取20.00mL①中所得的溶液,用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。③向滴定后的溶液中加入适量锌粉充分反应后,过滤,洗涤,洗涤液并入滤液中。
④继续用
 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 。
。已知:

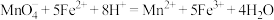
(7)配制上述100mL溶液,用到的玻璃仪器除了玻璃棒、烧杯外,还有
(8)步骤②滴定终点的现象为
(9)草酸亚铁晶体样品的纯度为
 、
、 、
、 、
、 表示)
表示)
您最近一年使用:0次
名校
解题方法
4 . 醋酸钠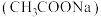 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。
(1)配制 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,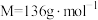 )的质量为
)的质量为_______ 。实验需要的仪器有天平、药匙、玻璃棒、量筒、_______ (从下列图中选择,写出名称)。 水解程度的影响。
水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为 ):
):
i.实验_______ 和_______ (填序号),探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3,探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4,探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_______ 。
②实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据_______ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测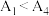 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是_______ 。
(3)小组通过测定不同温度下 的水解常数
的水解常数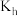 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。
查阅资料: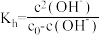 ,
,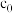 为
为 溶液起始浓度。
溶液起始浓度。
试剂: 溶液、
溶液、 盐酸、
盐酸、 计。
计。
实验:测定40℃下 水解常数
水解常数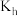 ,完成下表中序号7的实验。
,完成下表中序号7的实验。
在50℃和60℃下重复上述实验。
数据处理:40℃,
_______ (用含 、
、 、
、 的计算式表示)
的计算式表示)
实验结论: ,温度升高,促进
,温度升高,促进 水解。
水解。
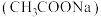 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。(1)配制
 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,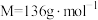 )的质量为
)的质量为
 水解程度的影响。
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
 ):
):i.实验
 水解程度的影响;
水解程度的影响;ii.实验1和3,探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4,探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 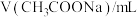 |  | 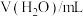 |  |
| 1 | 25℃ | 40.0 | 0 | 0 |  |
| 2 | 25℃ | 4.0 | 0 | 36.0 |  |
| 3 | 25℃ | 20.0 | 10.0 |  | 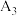 |
| 4 | 40℃ | 40.0 | 0 | 0 | 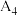 |

②实验测得
 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测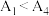 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是(3)小组通过测定不同温度下
 的水解常数
的水解常数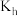 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。查阅资料:
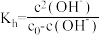 ,
,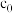 为
为 溶液起始浓度。
溶液起始浓度。试剂:
 溶液、
溶液、 盐酸、
盐酸、 计。
计。实验:测定40℃下
 水解常数
水解常数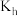 ,完成下表中序号7的实验。
,完成下表中序号7的实验。| 序号 | 实验 | 记录的数据 |
| 5 | 取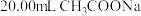 溶液,用 溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为 |
| 6 | 测40℃纯水的 |  |
| 7 |  |
数据处理:40℃,

 、
、 、
、 的计算式表示)
的计算式表示)实验结论:
 ,温度升高,促进
,温度升高,促进 水解。
水解。
您最近一年使用:0次
2023-03-16更新
|
2404次组卷
|
5卷引用:广东省广州市2023届高三一模考试化学试题
广东省广州市2023届高三一模考试化学试题(已下线)专题19 实验综合题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(实验综合题)广东省广州市2022-2023学年高三普通高中毕业班综合测试(一)化学试题 广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题
解题方法
5 . 研究化学平衡对学习化学具有重要意义。
Ⅰ.在恒容密闭容器中发生如下反应:2NO2(g) N2O4(g) ΔH<0
N2O4(g) ΔH<0
(1)升高温度,该反应的平衡常数_______ (填“增大”“减小”或“不变”)。
(2)判断该反应是否达到平衡,下列可以作为判断依据的是_______。
Ⅱ.一定温度下,向2L的恒容密闭容器中充入一定量的N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

(3)0~10min内NO的反应速率为_______ 。
(4)图中A点υ(正)_______ υ(逆)(填“>”“<”或“=”)。
(5)第10min时,外界改变的条件可能是_______。
Ⅲ.含氯化合物广泛用于水处理剂及漂白剂。已知:工业上将Cl2通入7mol/L的NaOH溶液中制备NaClO;25℃时NaClO溶液中HClO、ClO-的物质的量分数随pH变化的分布如下图所示。

(6)写出上述制备NaClO的离子方程式_______ ;
(7)当NaClO溶液pH=9时,该溶液中主要存在的含氯阴离子有_______ (填离子符号);
(8)25℃时,反应ClO-+H2O HClO+OH-的平衡常数K=
HClO+OH-的平衡常数K=_______ (填数值)。
Ⅰ.在恒容密闭容器中发生如下反应:2NO2(g)
 N2O4(g) ΔH<0
N2O4(g) ΔH<0(1)升高温度,该反应的平衡常数
(2)判断该反应是否达到平衡,下列可以作为判断依据的是_______。
| A.容器内气体密度不再变化 | B.容器内各气体浓度不再变化 |
| C.体系中颜色不再变化 | D.υ正(NO2)=2υ正(N2O4) |
Ⅱ.一定温度下,向2L的恒容密闭容器中充入一定量的N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
(3)0~10min内NO的反应速率为
(4)图中A点υ(正)
(5)第10min时,外界改变的条件可能是_______。
| A.加催化剂 | B.增大C(s)的量 |
| C.升温 | D.减小CO2的量 |
Ⅲ.含氯化合物广泛用于水处理剂及漂白剂。已知:工业上将Cl2通入7mol/L的NaOH溶液中制备NaClO;25℃时NaClO溶液中HClO、ClO-的物质的量分数随pH变化的分布如下图所示。

(6)写出上述制备NaClO的离子方程式
(7)当NaClO溶液pH=9时,该溶液中主要存在的含氯阴离子有
(8)25℃时,反应ClO-+H2O
 HClO+OH-的平衡常数K=
HClO+OH-的平衡常数K=
您最近一年使用:0次
解题方法
6 . 200℃时,气态肼(N2H4)在Cu-Ni双金属表面分解的过程如下:
过程Ⅰ:3N2H4(g)=N2(g)+4NH3(g) △H1=akJ•mol-1
过程Ⅱ:2NH3(g)=N2(g)+3H2(g) △H2=+92kJ•mol-1
已知相关化学键的数据如表所示:
(1)过程Ⅰ中a=_____ ,写出气态肼(N2H4)在Cu-Ni双金属表面分解成氮气和氢气的热化学方程式_____ 。
(2)300℃时,向2L刚性容器中充入1molN2H4发生分解成N2和H2的反应,不同时刻测得容器内压强的变化如表所示:
反应前5小时内的平均反应速率v(N2)为_____ mol•L-1•h-1,平衡时H2的分压p(H2)=_____ MPa。
(3)在温度为573K、压强为100kPa的反应条件下,对于n(N2H4):n(Ne)分别为3:1、1:1、1:3、1:6的N2H4-Ne混合气在热分解反应过程中N2H4的转化率随时间的变化如图所示:

①n(N2H4):n(Ne)的比值越小,N2H4的平衡转化率越_____ (填“大”或“小”),理由是_____ 。
②n(N2H4):n(Ne)=1:3所对应的曲线是_____ (填字母代号)。
(4)肼(N2H4)又称联氨,溶于水可以发生与氨水类似的电离,是一种二元弱碱。肼溶于水的电离方程式为:
N2H4+H2O N2H
N2H +OH- Kb1=2×10-8
+OH- Kb1=2×10-8
N2H +H2O
+H2O N2H
N2H +OH- Kb2=6×10-10
+OH- Kb2=6×10-10
现将等浓度等体积的肼的水溶液与硫酸溶液混合,混合后生成的盐的化学式为_____ ,混合后溶液中 =
=_____ 。
过程Ⅰ:3N2H4(g)=N2(g)+4NH3(g) △H1=akJ•mol-1
过程Ⅱ:2NH3(g)=N2(g)+3H2(g) △H2=+92kJ•mol-1
已知相关化学键的数据如表所示:
| 化学键 | H-H | N-N | N≡N | H-N |
| E/(kJ•mol-1) | x | 265 | 946 | y |
(2)300℃时,向2L刚性容器中充入1molN2H4发生分解成N2和H2的反应,不同时刻测得容器内压强的变化如表所示:
| 时间/h | 0 | 1 | 2 | 3 | 5 | 6 | 7 |
| p/MPa | 50 | 60 | 80 | 120 | 140 | 140 | 140 |
(3)在温度为573K、压强为100kPa的反应条件下,对于n(N2H4):n(Ne)分别为3:1、1:1、1:3、1:6的N2H4-Ne混合气在热分解反应过程中N2H4的转化率随时间的变化如图所示:

①n(N2H4):n(Ne)的比值越小,N2H4的平衡转化率越
②n(N2H4):n(Ne)=1:3所对应的曲线是
(4)肼(N2H4)又称联氨,溶于水可以发生与氨水类似的电离,是一种二元弱碱。肼溶于水的电离方程式为:
N2H4+H2O
 N2H
N2H +OH- Kb1=2×10-8
+OH- Kb1=2×10-8N2H
 +H2O
+H2O N2H
N2H +OH- Kb2=6×10-10
+OH- Kb2=6×10-10现将等浓度等体积的肼的水溶液与硫酸溶液混合,混合后生成的盐的化学式为
 =
=
您最近一年使用:0次
名校
7 . I、常温下,有浓度均为 的下列4种溶液:
的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(1)这4种溶液pH由大到小的顺序是______ (填序号)
(2)若分别向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”“<”或“=”)。
(3)向NaCN溶液中通入少量 ,则发生反应的离子方程式为
,则发生反应的离子方程式为______ 。
(4)泡沫灭火器中通常装有 溶液和
溶液和 溶液,请写出这两种溶液混合时反应的离子方程式:
溶液,请写出这两种溶液混合时反应的离子方程式:______ 。
(5)已知25℃时, 第一步水解的平衡常数
第一步水解的平衡常数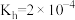 ,当溶液中
,当溶液中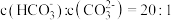 时,溶液的pH=
时,溶液的pH=________ 。
II、某同学用酸性 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:请回答下列问题:
含量:请回答下列问题:
反应原理为: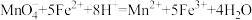 (
( 在溶液中为无色)
在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L 溶液滴定至终点
溶液滴定至终点
(6)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_________ mL。

(7)此滴定实验达到终点的颜色变化为______ 。
(8)重复滴定4次,每次消耗酸性 标准溶液的体积如表所示:
标准溶液的体积如表所示:
计算上述样品中 的质量分数为
的质量分数为______ 。( ,
,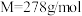 ,小数点后保留一位)
,小数点后保留一位)
(9)若滴定前平视读数,滴定终点时仰视读数,则所测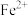 含量:
含量:______ 。(填“无影响”、“偏高”或“偏低”)。
 的下列4种溶液:
的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③
 溶液 ④
溶液 ④ 溶液
溶液| HCN |  |  |
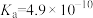 | 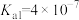 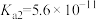 | 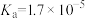 |
(2)若分别向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(3)向NaCN溶液中通入少量
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为(4)泡沫灭火器中通常装有
 溶液和
溶液和 溶液,请写出这两种溶液混合时反应的离子方程式:
溶液,请写出这两种溶液混合时反应的离子方程式:(5)已知25℃时,
 第一步水解的平衡常数
第一步水解的平衡常数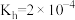 ,当溶液中
,当溶液中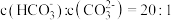 时,溶液的pH=
时,溶液的pH=II、某同学用酸性
 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:请回答下列问题:
含量:请回答下列问题:反应原理为:
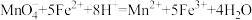 (
( 在溶液中为无色)
在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L
 溶液滴定至终点
溶液滴定至终点(6)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为

(7)此滴定实验达到终点的颜色变化为
(8)重复滴定4次,每次消耗酸性
 标准溶液的体积如表所示:
标准溶液的体积如表所示:| 第一次 | 第二次 | 第三次 | 第四次 | |
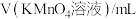 | 17.10 | 19.98 | 20.00 | 20.02 |
 的质量分数为
的质量分数为 ,
,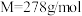 ,小数点后保留一位)
,小数点后保留一位)(9)若滴定前平视读数,滴定终点时仰视读数,则所测
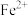 含量:
含量:
您最近一年使用:0次
8 . 合成氨是目前人工固氮最重要的途径,对人类生存具有重大意义,反应为:
(1)N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。
①该反应在___________ (填“高温”“低温”或“任意温度”)下可自发进行。
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=___________ 。
(2)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数 。
。
i.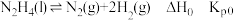
ii.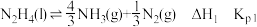
iii.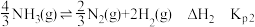
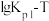 和
和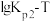 的线性关系图如下所示:
的线性关系图如下所示:

①由图可知ΔH1___________ 0(填“大于”或“小于”)。
②反应i的Kp0=______________ (用Kp1和Kp2表示)。
反应i的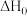
___________ 0(填“大于”或“小于”),写出推理过程_____________________ 。
(3)氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=____ mol/L,将CO2通入氨水中使溶液恰好呈中性,则此时 =
=______ (保留小数点后4位数字)
(1)N2(g)+3H2(g)
 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。①该反应在
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=
(2)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数
 。
。i.
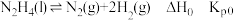
ii.
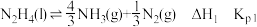
iii.
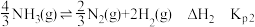
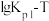 和
和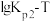 的线性关系图如下所示:
的线性关系图如下所示:
①由图可知ΔH1
②反应i的Kp0=
反应i的
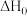
(3)氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=
您最近一年使用:0次
9 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中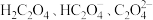 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
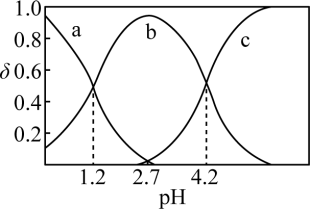
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中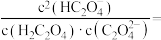
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③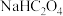 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中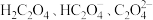 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中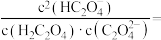
②pH从1.2增大至4.2的过程中,水的电离程度
③
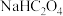 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:山西省吕梁市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
10 . 某化学兴趣小组探究FeCl3溶液和Na2SO3溶液的反应情况。
已知:K3[Fe(CN)6]可以和Fe2+生成蓝色沉淀,常用于Fe2+的检验。请回答相关问题。
[实验1]分别将100mL1.0mol·L-1的FeCl3溶液和Na2SO3溶液装入两个烧杯中,按图进行实验,观察到电流计指针发生偏转。
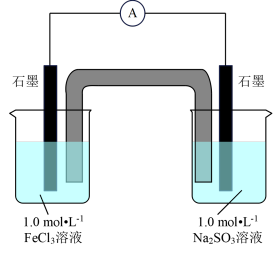
(1)请写出左侧烧杯中的电极反应式__ 。盐桥中的阳离子向__ (填“左侧”或“右侧”)烧杯中迁移。
[实验2]在试管1中加入2mL1.0mol·L-1Na2SO3溶液,然后再滴加两滴1.0mol·L-1FeCl3溶液,溶液中立刻变成红褐色。对试管1进行加热至沸腾,产生红褐色沉淀。取出几滴混合液,加K3[Fe(CN)6]溶液,无蓝色沉淀出现。整个过程中未观察到明显的气泡产生。
[实验3]在试管2中加入5mL1.0mol·L-1FeCl3溶液,然后再滴加1mL1.0mol·L-1Na2SO3溶液,溶液立刻变成红褐色。取出几滴混合液,加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)实验3中生成蓝色沉淀的离子方程式为__ 。请设计实验证明SO 被氧化
被氧化__ 。
[反思与研讨]
资料显示:H2SO3的Ka1=1.7×10-2Ka2=6.0×10-8;Fe(OH)3的Ksp=4×10-38;反应2Fe3++ SO +H2O
+H2O 2Fe2++SO
2Fe2++SO +2H+的平衡常数K=1020.6。
+2H+的平衡常数K=1020.6。
(3)反应2Fe3++3SO +6H2O
+6H2O 2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为
2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为__ 。由此可判断FeCl3溶液和Na2SO3溶液发生__ (填“双水解”或“氧化还原”)反应的趋势更大。
已知:K3[Fe(CN)6]可以和Fe2+生成蓝色沉淀,常用于Fe2+的检验。请回答相关问题。
[实验1]分别将100mL1.0mol·L-1的FeCl3溶液和Na2SO3溶液装入两个烧杯中,按图进行实验,观察到电流计指针发生偏转。

(1)请写出左侧烧杯中的电极反应式
[实验2]在试管1中加入2mL1.0mol·L-1Na2SO3溶液,然后再滴加两滴1.0mol·L-1FeCl3溶液,溶液中立刻变成红褐色。对试管1进行加热至沸腾,产生红褐色沉淀。取出几滴混合液,加K3[Fe(CN)6]溶液,无蓝色沉淀出现。整个过程中未观察到明显的气泡产生。
[实验3]在试管2中加入5mL1.0mol·L-1FeCl3溶液,然后再滴加1mL1.0mol·L-1Na2SO3溶液,溶液立刻变成红褐色。取出几滴混合液,加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)实验3中生成蓝色沉淀的离子方程式为
 被氧化
被氧化[反思与研讨]
资料显示:H2SO3的Ka1=1.7×10-2Ka2=6.0×10-8;Fe(OH)3的Ksp=4×10-38;反应2Fe3++ SO
 +H2O
+H2O 2Fe2++SO
2Fe2++SO +2H+的平衡常数K=1020.6。
+2H+的平衡常数K=1020.6。(3)反应2Fe3++3SO
 +6H2O
+6H2O 2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为
2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为
您最近一年使用:0次
2022-01-08更新
|
352次组卷
|
3卷引用:河南省郑州市2022届高三上学期第一次质量预测(1月)化学试题



