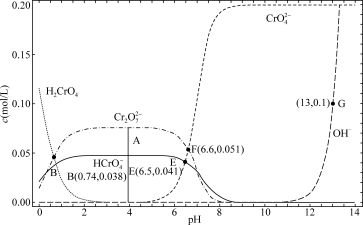
1 . 某温度下,改变
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列说法中正确的是
是二元酸),下列说法中正确的是

 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列说法中正确的是
是二元酸),下列说法中正确的是
A.溶液中存在平衡 ,该温度下此反应的平衡常数 ,该温度下此反应的平衡常数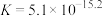 |
B.该温度下的中性溶液的 |
C.向10 mL   溶液中滴入几滴 溶液中滴入几滴  溶液,溶液橙色变浅 溶液,溶液橙色变浅 |
D.B点溶液中存在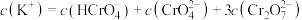 |
您最近一年使用:0次
名校
2 . 下列说法正确的是
A.反应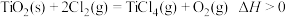 能自发进行,其原因是 能自发进行,其原因是 |
B.一定温度下,增大反应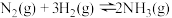 容器的体积,平衡正向移动 容器的体积,平衡正向移动 |
C.向0.1 CH3COONa溶液中加入少量水,溶液中 CH3COONa溶液中加入少量水,溶液中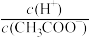 减小 减小 |
| D.电解精炼铜时,粗铜做阴极,精铜作阳极 |
您最近一年使用:0次
名校
解题方法
3 . 下列实验操作、现象、结论均正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 取室温下少量0.5mol/LCH3COONa溶液,加热至60℃,并测定溶液的pH | pH减小 | CH3COONa的水解是吸热反应 |
| B | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液颜色的变化 | 溶液颜色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 取2mL0.1 mol/LAgNO3溶液,先后滴加3滴0.1 mol/LNaCl溶液和5滴0.1 mol/LKI溶液,观察沉淀情况 | 先生成白色沉淀,后变为黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
| D | 已知H3BO3K=5.8×10-10、H2CO3K1=4.5×10-7 K2=4.7×10-11,向饱和硼酸溶液中滴加碳酸钠溶液 | 无明显现象 | H3BO3与碳酸钠不反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-13更新
|
753次组卷
|
4卷引用:浙江省杭州市源清中学2021-2022学年高二上学期期末考试化学试题
名校
4 . 用如图所示装置(夹持装置均已省略)进行实验能达到目的的是


| A.甲装置可检验溶液中是否有K+ | B.乙装置可验证浓硫酸的脱水性 |
C.丙装置可制备无水 | D.丁装置可制取并收集干燥、纯净的NO |
您最近一年使用:0次
2022-10-12更新
|
142次组卷
|
2卷引用:山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题
名校
解题方法
5 . 氨基羧酸盐在工农业、生活中有着广泛应用,其中氨基甲酸铵(NH2COONH4)可用作肥料、洗涤剂等。实验室用下图所示装置制备氨基甲酸铵,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则主要生成碳酸氢铵。
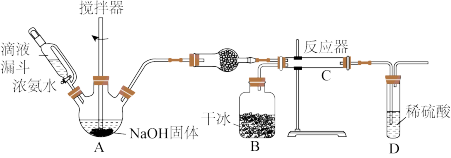
(1)盛放NaOH固体的仪器名称是_______ ,干燥管中的试剂为_______ 。
(2)无水条件下合成氨基甲酸铵的化学反应方程式为_______ ;若该反应能自发进行,则该反应的
_______ 0,(填“>”或“<”);对比碳酸钙和盐酸反应制取CO2,该实验利用干冰升华制取CO2,其优点有_______ 。
A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是_______ 。(写出其中任意1条)
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)______
(5)该小组在上述实验方案基础上又进行了探究,分别用两份不同初始浓度的氨基甲酸铵溶液在不同温度下测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。根据图中信息,能说明该水解反应速率随温度升高而加快的证据是_______ 。


(1)盛放NaOH固体的仪器名称是
(2)无水条件下合成氨基甲酸铵的化学反应方程式为

A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)
| 物理量 实验序号 | 温度T(℃) | 导电率变化量∆S | … | |||
| 1 | a | b | ||||
| 2 | a | b |

您最近一年使用:0次
2022-10-09更新
|
275次组卷
|
3卷引用:广东省六校2022-2023学年高三上学期第二次联考化学试题
6 . 化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-,向氨水中加入MgCl2固体时,平衡向
+OH-,向氨水中加入MgCl2固体时,平衡向_______ 移动,OH-的浓度_______ ,向浓氨水中加入少量NaOH固体,平衡向_______ 移动,此时发生的现象是_______ 。
(2)氯化铁水解的离子方程式为_______ ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为_______ ,同时有红褐色沉淀生成,其原因是_______ 。
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象_______ ,原因为_______
(1)已知在氨水中存在下列平衡:NH3+H2O
 NH3·H2O
NH3·H2O NH
NH +OH-,向氨水中加入MgCl2固体时,平衡向
+OH-,向氨水中加入MgCl2固体时,平衡向(2)氯化铁水解的离子方程式为
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象
您最近一年使用:0次
7 . 在Al3++3H2O A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施
A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施
 A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施
A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施| A.降低温度 | B.滴加少量盐酸 | C.加入适量氢氧化钠溶液 | D.加少量氯化钠固体 |
您最近一年使用:0次
2022-10-04更新
|
630次组卷
|
5卷引用:江苏省淮安市涟水县第一中学2021-2022学年高二下学期第二次阶段检测化学试题
8 .  俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分:
俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分: 、
、 、FeO、
、FeO、 )制备绿矾流程如下:
)制备绿矾流程如下:

已知:① 难溶于水,能还原
难溶于水,能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。
②金属离子生成氢氧化物沉淀的pH范围见下表:
(1)提高“酸浸”速率的措施有___________ (任写一点即可):写出滤渣Ⅰ与某种酸反应的化学方程式___________ ;滤渣Ⅱ经灼烧后可用于___________ (写出一种用途即可)。
(2)写出“还原”步骤中涉及反应的离子方程式___________ 。
(3)“除铝”需控制的pH范围是___________ 。
(4)“酸化”步骤中加入稀硫酸的目的是___________ 。操作Ⅲ为___________ ;“洗涤”时的试剂最好选用下列中的___________ (填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有 :
:___________ 。
 俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分:
俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分: 、
、 、FeO、
、FeO、 )制备绿矾流程如下:
)制备绿矾流程如下:
已知:①
 难溶于水,能还原
难溶于水,能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。②金属离子生成氢氧化物沉淀的pH范围见下表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 1.5 | 3.2 |
 | 3.0 | 5.0 |
 | 6.3 | 8.3 |
(1)提高“酸浸”速率的措施有
(2)写出“还原”步骤中涉及反应的离子方程式
(3)“除铝”需控制的pH范围是
(4)“酸化”步骤中加入稀硫酸的目的是
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有
 :
:
您最近一年使用:0次
名校
9 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 用pH试纸分别测量NaNO2和CH3COONa溶液的pH | NaNO2溶液的pH约为8,CH3COONa溶液的pH约为9 | Ka(HNO2)>Ka(CH3COOH) |
| B | 用pH试纸测量0.1mol·L-1NaHSO3溶液的pH | pH约为5 | 溶液中HSO 的电离>水解 的电离>水解 |
| C | 向滴有酚酞的氨水中加入CH3COONH4固体 | 溶液的红色变浅 | CH3COONH4溶液呈酸性 |
| D | 室温下,向密闭容器中充入NO2,达平衡后,再慢慢扩大容器体积 | 最终容器中气体颜色比初次平衡时浅 | 2NO2(g) N2O4(g)(无色)该平衡正向移动 N2O4(g)(无色)该平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-11更新
|
499次组卷
|
4卷引用:辽宁省昌图县第一高级中学2022-2023学年高二10月月考化学试题
10 . 请你设计实验探究促进或抑制 水解的条件,了解影响盐类水解程度的因素。
水解的条件,了解影响盐类水解程度的因素。
可供选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、 计、
计、 试纸;1 mol∙L−1盐酸、氯化氢气体、1 mol∙L−1氢氧化钠溶液、1 mol∙L−1氯化铁溶液、蒸馏水。
试纸;1 mol∙L−1盐酸、氯化氢气体、1 mol∙L−1氢氧化钠溶液、1 mol∙L−1氯化铁溶液、蒸馏水。
完成下列探究过程:
(1)写出 水解的离子方程式:
水解的离子方程式:_______ 。
(2)针对影响 水解的因素提出假设:
水解的因素提出假设:
假设1:溶液的酸碱性;
假设2:_______ ;
假设3:_______ 。
(3)基于以上3个假设,设计出实验方案,将实验操作、预期现象和结论填在下表中。
 水解的条件,了解影响盐类水解程度的因素。
水解的条件,了解影响盐类水解程度的因素。可供选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、
 计、
计、 试纸;1 mol∙L−1盐酸、氯化氢气体、1 mol∙L−1氢氧化钠溶液、1 mol∙L−1氯化铁溶液、蒸馏水。
试纸;1 mol∙L−1盐酸、氯化氢气体、1 mol∙L−1氢氧化钠溶液、1 mol∙L−1氯化铁溶液、蒸馏水。完成下列探究过程:
(1)写出
 水解的离子方程式:
水解的离子方程式:(2)针对影响
 水解的因素提出假设:
水解的因素提出假设:假设1:溶液的酸碱性;
假设2:
假设3:
(3)基于以上3个假设,设计出实验方案,将实验操作、预期现象和结论填在下表中。
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ |
您最近一年使用:0次



