名校
1 . 通过表中的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下:
(1)NH4F溶液显_______ 性。
(2)NH4HCO3 溶液与少量NaOH溶液反应时,_______ (填离子符号)先与 NaOH溶液中的OH-反应。
(3)①反应 CuS(s) + H2SO4(aq)⇌H2S(aq) + CuSO4(aq)的 K=_______ ;反应 FeS(s) + H2SO4(aq)⇌H2S(aq)+FeSO4 (aq)的 K= 3.9×103;
②反应 CuS(s)+Fe2+(aq)⇌FeS(s)+Cu2+(aq)的 K=_______ (以上计算结果均保留两位有效数字)。
③由计算结果可以知道实验室制备H2S气体应选用_______ ,检验H2S气体应选用_______ (均用上述反应中的盐类物质作答)
(4)除去废水中的Cu2+使用过量的FeS固体的优点有:
①可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;
②_______ 。
| NH3•H2O | Kb=1.8×10-5 |
| H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| HF | Ka=6.8×10-4 |
| H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| H2O | Kw=10-14 |
| Cu(OH)2 | Ksp=2.2×10-20 |
| Fe(OH)3 | Ksp=4.0×10-38 |
| CuS | Ksp=6.3×10-36 |
| FeS | Ksp=3.6×10-18 |
| 常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F溶液显
(2)NH4HCO3 溶液与少量NaOH溶液反应时,
(3)①反应 CuS(s) + H2SO4(aq)⇌H2S(aq) + CuSO4(aq)的 K=
②反应 CuS(s)+Fe2+(aq)⇌FeS(s)+Cu2+(aq)的 K=
③由计算结果可以知道实验室制备H2S气体应选用
(4)除去废水中的Cu2+使用过量的FeS固体的优点有:
①可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;
②
您最近一年使用:0次
名校
2 . t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,其中AgI的溶解度更小,相关离子浓度的关系如图所示。下列说法正确的是
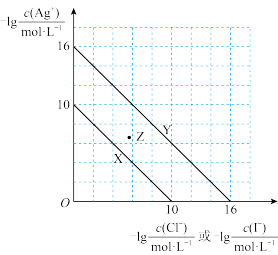

A.曲线Y表示-lg 与-lg 与-lg 的变化关系 的变化关系 |
| B.t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液 |
| C.t℃时,向浓度均为0.1mol/L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,此时c(I-)=1×10-11mol/L |
D.t℃时,AgCl(s)+I-(aq) AgI(s)+Cl-(aq)的平衡常数K=1×103 AgI(s)+Cl-(aq)的平衡常数K=1×103 |
您最近一年使用:0次
2021-04-20更新
|
234次组卷
|
2卷引用:江西省景德镇市浮梁一中2020-2021学年高二下学期4月月考化学试题
名校
3 . 关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
A.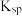 只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
B. 时 时 在水中的溶解度大于其在CuCl2溶液中的溶解度 在水中的溶解度大于其在CuCl2溶液中的溶解度 |
C.向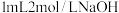 溶液中先滴加2滴 溶液中先滴加2滴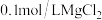 溶液,再滴加2滴 溶液,再滴加2滴 溶液,先生成白色沉淀,后生成红褐色沉淀,说明 溶液,先生成白色沉淀,后生成红褐色沉淀,说明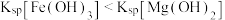 |
D.已知某温度下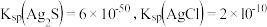 ,则 ,则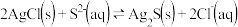 的平衡常数约为 的平衡常数约为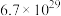 |
您最近一年使用:0次
2021-04-07更新
|
158次组卷
|
2卷引用:江西省宜春市奉新县第一中学2020-2021学年高二下学期第一次月考化学试题
名校
4 . 已知常温下,FeS的Ksp=6.25×10-18,ZnS的Ksp=1.2×10-23,H2S的饱和溶液中c(H+)与c(S2-)之间存在如下关系:c2(H+)·c(S2-)=1.0×10-22。试回答下列有关问题:
(1)向ZnS的饱和溶液中:
①加入少量固体Na2S,则溶液中c(S2-)_______ (填“变大”、“变小”或“不变”,下同);
②加入ZnS固体,则溶液中c(S2-)_______ ;
③加入FeS固体,则溶液中c(Zn2+)_______ 。
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.01 mol/L,应调节溶液的pH=_______ (已知:lg2=0.3)。
(1)向ZnS的饱和溶液中:
①加入少量固体Na2S,则溶液中c(S2-)
②加入ZnS固体,则溶液中c(S2-)
③加入FeS固体,则溶液中c(Zn2+)
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.01 mol/L,应调节溶液的pH=
您最近一年使用:0次
5 . 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子 浓度的变化如图所示。据图分析,下列判断错误的是
浓度的变化如图所示。据图分析,下列判断错误的是
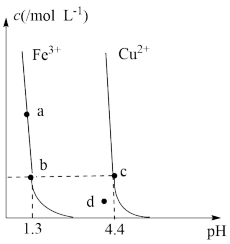
 浓度的变化如图所示。据图分析,下列判断错误的是
浓度的变化如图所示。据图分析,下列判断错误的是
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.Fe(OH)3,Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
| C.加适量NH4Cl固体可使溶液由a点变到b点 |
| D.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
您最近一年使用:0次
名校
解题方法
6 . MSO4和MCO3是两种难溶性盐。常温时两种物质的溶解度曲线如图所示,下列叙述错误的是
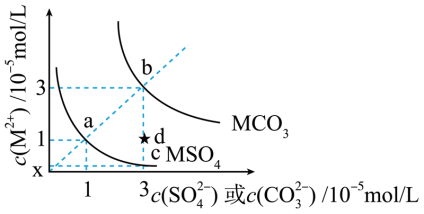

| A.Ksp(MCO3)=9.0×10−10 |
| B.c点的纵坐标0.33 |
| C.在饱和的MCO3澄清溶液里加入适量的Na2SO4固体,可使b点变为d点 |
| D.使1L含1molMSO4的悬浊液中的分散质完全转化为MCO3,需要加1molNa2CO3固体 |
您最近一年使用:0次
2021-03-03更新
|
902次组卷
|
7卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题
名校
7 . Ⅰ、已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-)_______ (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+)_______ ;
③若改加更多的KBr固体,则c(Ag+)_______ ;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中错误的是_______ ;
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度,Ksp一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
Ⅱ、最近有人制造了一种燃料电池使甲烷氧化直接产生电流,其中一个电极通入空气,另一个电极通入甲烷,电池的电解质是NaOH溶液。这个电池负极的电极反应式为_______ 。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-)
②若改加更多的AgCl固体,则c(Ag+)
③若改加更多的KBr固体,则c(Ag+)
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中错误的是
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度,Ksp一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
Ⅱ、最近有人制造了一种燃料电池使甲烷氧化直接产生电流,其中一个电极通入空气,另一个电极通入甲烷,电池的电解质是NaOH溶液。这个电池负极的电极反应式为
您最近一年使用:0次
解题方法
8 . 下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c( )+c(OH﹣) )+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO﹣)+c(CH3COOH)+2c(Cl﹣) |
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合:c( )+c( )+c( )=c(Cl-) )=c(Cl-) |
您最近一年使用:0次
名校
解题方法
9 . 某温度时,AgCl(s)⇌Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
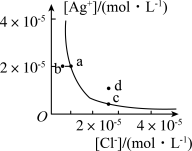

| A.加入AgNO3,可以使溶液由c点变到d点 |
| B.加入少量水,平衡右移,Cl-浓度减小 |
| C.d点没有AgCl沉淀生成 |
| D.c点对应的Ksp等于a点对应的Ksp |
您最近一年使用:0次
2021-01-29更新
|
242次组卷
|
6卷引用:江西省宜春市昌黎实验学校2021-2022学年高二上学期12月月考化学试题
10 . 下列说法中,正确的是
| A.难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 |
| B.难溶电解质都是弱电解质 |
C.在白色ZnS沉淀上滴加 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 |
| D.AgCl在水中的溶解度与在饱和NaCl溶液中的溶解度相同 |
您最近一年使用:0次
2021-01-28更新
|
753次组卷
|
7卷引用:江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题
江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)课前-3.4.2 沉淀溶解平衡的应用-课前、课中、课后(人教版2019选择性必修1)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)新疆昌吉州行知学校2021-2022学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题



