解题方法
1 . 已知25℃时,AgCl的溶度积Ksp=1.8×10-10mol2·L-2,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出 |
| D.在AgCl的悬浊液中加入Na2S溶液,AgCl转化为Ag2S,因为AgCl溶解度大于Ag2S |
您最近一年使用:0次
解题方法
2 . 在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与CrO 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
(1)溶液中c(Ag+)=_______ 。
(2)溶液中c(CrO )=
)=_______ (写出具体计算过程)。
 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:(1)溶液中c(Ag+)=
(2)溶液中c(CrO
 )=
)=
您最近一年使用:0次
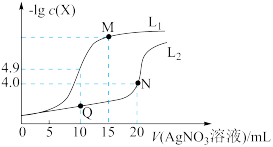
3 . t℃时,将0.1 mol·L-1AgNO3溶液分别滴加到10. 00 mL0.1 mol·L-1KCl、10.00 ml0.1 mol· L-1K2CrO4溶液中,AgNO3溶液体积(V)与-lg c(X)(X为Cl-或 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
| A.曲线L2表示-lg c(Cl-)与V(AgNO3溶液)的变化关系 |
| B.t℃时,铬酸银的溶度积常数为4.0 ×10-12 |
| C.若仅将c(K2CrO4)改为0.05 mol·L-1,则曲线L2中N点移到Q点 |
D.M点溶液中:c( )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) |
您最近一年使用:0次
2022-08-10更新
|
147次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高二上学期期中理科综合化学试题
名校
4 . 室温下,将0.3molBaSO4加入5L1mol/LNa2CO3溶液中,不考虑体积变化,达到平衡时,c(SO )=0.02mol/L,下列说法错误的是
)=0.02mol/L,下列说法错误的是
 )=0.02mol/L,下列说法错误的是
)=0.02mol/L,下列说法错误的是| A.有BaCO3沉淀生成 |
| B.依据题干信息可推出:Ksp[BaSO4]<Ksp[BaCO3] |
| C.向溶液中继续加入少量Na2CO3固体,BaCO3沉淀增多 |
| D.向溶液中继续加入少量蒸馏水,BaCO3沉淀减少 |
您最近一年使用:0次
5 . 化学与生产、生活密切相关,下列说法正确的是
| A.牙膏中添加氟化物可预防龋齿 |
| B.沼气的主要成分为甲烷,沼气属于不可再生资源 |
| C.葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用 |
| D.氢氧化镁和碳酸钠可用作胃酸的中和剂 |
您最近一年使用:0次
2021-12-25更新
|
209次组卷
|
3卷引用:山西省2021-2022学年高二上学期12月联合考试化学试题
名校
6 . 用0.100mol/LAgNO3溶液滴定50.0mL0.0500mol/LNaCl溶液的滴定曲线如图所示。下列有关描述错误的是
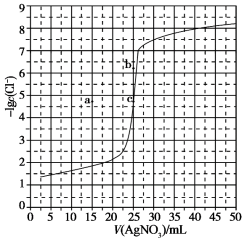

| A.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) |
| B.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 |
| C.相同实验条件下,若改为0.0500mol/LNaBr溶液,反应终点c向b方向移动 |
| D.相同实验条件下,若改为0.0400mol/LNaCl溶液,反应终点c移到a |
您最近一年使用:0次
7 . 25℃时,在含有大量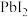 的饱和溶液中存在着平衡:
的饱和溶液中存在着平衡: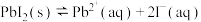 ,加入少量
,加入少量 固体,下列说法不正确的是
固体,下列说法不正确的是
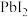 的饱和溶液中存在着平衡:
的饱和溶液中存在着平衡: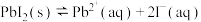 ,加入少量
,加入少量 固体,下列说法不正确的是
固体,下列说法不正确的是A.溶液中 浓度减小、 浓度减小、 浓度增大 浓度增大 | B.溶度积常数 不变 不变 |
C.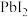 的溶解度不变 的溶解度不变 | D.沉淀溶解平衡向左移动 |
您最近一年使用:0次
2021-01-26更新
|
134次组卷
|
2卷引用:山西省怀仁市2020-2021学年高二上学期期末考试化学试题
8 . 下列方程式书写不正确的是
A. 水溶液呈碱性: 水溶液呈碱性: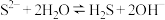 |
B.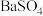 的沉淀溶解平衡: 的沉淀溶解平衡: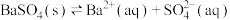 |
C.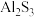 在水溶液中不存在: 在水溶液中不存在: |
D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为: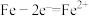 |
您最近一年使用:0次
名校
9 . 某温度下,难溶物FeR的水溶液中存在平衡FeR(s)⇌Fe2+(aq)+R2-(aq),其沉淀溶解平衡曲线如图所示。下列说法不正确的是
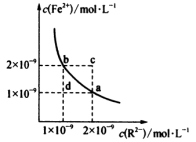

| A.该温度下,Ksp(FeR)=2×10-18 | B.c点可能有沉淀生成 |
| C.b点对应的K sp大于a点对应的K sp | D.加入FeSO4可实现由a点变到b点 |
您最近一年使用:0次
2021-01-24更新
|
500次组卷
|
5卷引用:山西省运城市康杰中学2021-2022学年高二上学期期中化学试题
山西省运城市康杰中学2021-2022学年高二上学期期中化学试题(已下线)专题11 水溶液中的离子平衡-备战2021届高考化学二轮复习题型专练(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练河南省顶尖名校联盟2020-2021学年高二12月联考化学试题天津市滨海新区田家炳中学2023-2024学年高二上学期第二次月考化学试题
10 . 室温下,向20mL含有0.10mol/LCr2+和0.10mol/LFe2+的混合溶液中滴加0.10mol/LNaOH溶液,金属阳离子的浓度与滴入NaOH溶液体积的关系如图所示。若溶液中金属阳离子浓度小于10-5mol/L可视为完全沉淀,则下列说法错误的是( )

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3
| A.曲线A表示c(Fe2+)与NaOH溶液体积的关系 |
| B.当V(NaOH溶液)=30mL时,Cr2+开始沉淀 |
| C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 |
| D.当V(NaOH溶液)>30mL时,溶液中c(Fe2+):c(Cr2+)=4 |
您最近一年使用:0次
2020-11-21更新
|
330次组卷
|
3卷引用:山西省长治市上党区一中2021-2022学年高二上学期10月月考化学试题



