名校
1 . 在25℃时,碳酸钙在水中的溶解平衡曲线如图所示,已知25℃硫酸钙的Ksp=9.1×10-6。下列说法错误的是
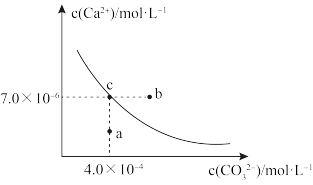

| A.通过蒸发,可使溶液由a点变化到c点 |
| B.图中b点碳酸钙的结晶速率大于其溶解速率 |
| C.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除 |
D.在25℃时,反应CaSO4(s)+CO (aq)=CaCO3(s)+SO (aq)=CaCO3(s)+SO (aq)的平衡常数K=3250 (aq)的平衡常数K=3250 |
您最近一年使用:0次
2 . 铬酸银(Ag2CrO4)微溶于水。常用作分析试剂,有机合成催化剂,电镀, 卤化物滴定确定终点的指示剂等。在 t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp = 1.8×10−10。下列说法不正确的是
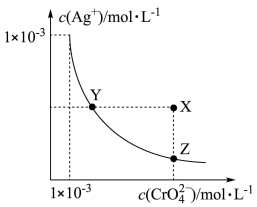

| A.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t ℃时,Ag2CrO4的Ksp为 1×10−9 |
D.t ℃时,将 0.01 mol·L−1AgNO3溶液滴入20 mL0.01mol·L−1KCl和 0.01 mol·L−1K2CrO4的混合溶液中,CrO 先沉淀 先沉淀 |
您最近一年使用:0次
解题方法
3 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液颜色的变化 | 证明Na2CO3溶液中存在水解平衡 |
| C | 在含等物质的量浓度Na2CO3、Na2SO4的混合溶液中,滴加少量BaCl2溶液 | 探究Ksp(BaCO3)和Ksp(BaSO4)的相对大小 |
| D | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 铬酸银(Ag2CrO4)微溶于水,常用作分析试剂、有机合成催化剂、电镀、卤化物滴定终点指示剂等。在T℃时,Ag2CrO4在水溶液中的沉淀溶解平衡曲线如图所示。已知:T℃时,AgCl的Ksp=1.8×10-10。下列说法错误的是
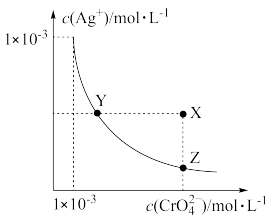

| A.T℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.向T℃饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.T℃时,Ag2CrO4的Ksp为1×10-6 |
| D.T℃时,将0.01molAgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 |
您最近一年使用:0次
2022-02-19更新
|
111次组卷
|
4卷引用:河北省邯郸市永年区第二中学2021-2022学年高二12月月考化学试题
名校
5 . 常温下,在含有大量Cu(OH)2(s)的浊液中,改变条件发生相应变化的趋向错误 的是
A.通入少量HCl | B.加少量蒸馏水 |
C.加少量NaOH(s) 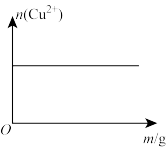 | D.适当升高温度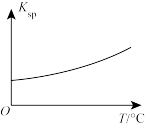 |
您最近一年使用:0次
2022-02-16更新
|
127次组卷
|
4卷引用:河南省范县第一中学2021-2022学年高二上学期第三次月考检测化学试题
河南省范县第一中学2021-2022学年高二上学期第三次月考检测化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题内蒙古乌兰浩特市第四中学2022-2023学年高二上学期第三次月考化学试题(已下线)卷07 化学反应速率与化学平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)
11-12高二上·辽宁锦州·期末
6 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图。
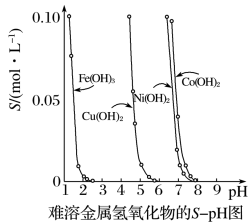
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为___________ 。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式___________ 。
(5)已知一些难溶物的溶度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___________ 除去它们。(选填序号)
A.NaOH B.FeS C.Na2S

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式
(5)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
您最近一年使用:0次
2022-01-17更新
|
346次组卷
|
13卷引用:福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题
福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题选择性必修1 专题3 第四单元综合训练(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)四川省绵阳市盐亭中学2021-2022学年高二下学期第三次月考化学试题(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)同步君 选修4 第3章第4节 难溶电解质的溶解平衡高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题(已下线)2019年11月24日《每日一题》高二化学人教版(选修4)—— 每周一测鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮
7 . 常温下,AgCl和AgI在水中的溶解平衡曲线如图所示,下列说法错误的是
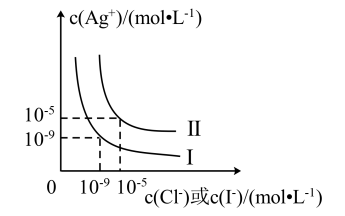

| A.曲线Ⅰ表示AgI的溶解平衡 |
| B.常温下,Ksp(AgCl)=1×10-10 |
C.常温下,饱和AgCl溶液与饱和AgI溶液两种溶液中 |
| D.常温下,向饱和AgCl溶液中加入更多的AgCl固体,则c(Ag+)不变 |
您最近一年使用:0次
8 . 下列操作、现象和结论都正确的是
| 操作 | 现象 | 结论 | |
| A | 在AgCl浊液中滴加少量KI稀溶液 | 产生黄色沉淀 | Ksp(AgC1)>Ksp(AgI) |
| B | 在酸性KMnO4溶液中滴加HOCH2CH=CH2(丙烯醇) | 溶液褪色 | 证明丙烯醇中含有碳碳双键 |
| C | 在NaAlO2溶液中滴加NaHCO3溶液 | 产生白色沉淀,同时有气泡产生 | 生成的气体为氢气 |
| D | 在淀粉的水解液中滴加KI溶液 | 溶液不变色 | 淀粉溶液已完全水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-08更新
|
225次组卷
|
2卷引用:河北省名校联盟2021-2022学年高三上学期一轮复习考试化学试题
名校
9 . 已知p(A)=-lgc平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
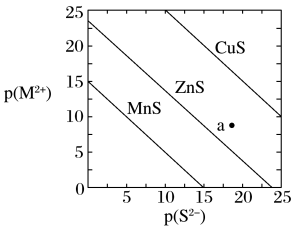

| A.a点有ZnS沉淀生成 |
| B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c平(S2-)不变 |
D.CuS和MnS共存的悬浊液中,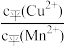 =10-20 =10-20 |
您最近一年使用:0次
2022-01-05更新
|
75次组卷
|
2卷引用:河北省张家口市第一中学2021-2022学年高二上学期12月月考化学试题
解题方法
10 . 某化学实验小组探究氢氧化镁在氯化铵溶液中的溶解实验。已知:常温时,Ksp[Mg(OH)2]=4×10-12,Kb(NH3·H2O)=1.75×10-5,Ka(CH3COOH)=1.75×10-5。
I.氢氧化镁粉末的溶解
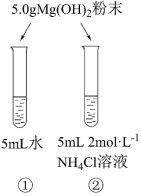
(1)常温下,实验①中有少量的氢氧化镁粉末溶解,向溶液①中滴加酚酞,溶液变为粉红色,则pH=_______ (已知:1g2=0.3)。
(2)实验②中氢氧化镁粉末大量溶解,实验②中反应的离子方程式为_______ ,此反应的平衡常数K=_______ (结果保留两位有效数字)。微热实验②中试管,有刺激性气味气体产生,检验此气体的方法为_______ 。
II.探究氢氧化镁粉末在氯化铵溶液中的溶解原因。
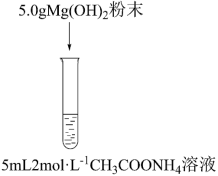
(3)猜想1:NH4Cl溶液中的NH 结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。
结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。
猜想2:_______ 。
将猜想2补充完整,为证明上述猜想,甲同学设计实验③,发现氢氧化镁粉末大量溶解。通过实验③可证明_______ (填“猜想1”或“猜想2”)成立。
(4)乙同学认为实验③中的CH3COO-也可能参与反应,故设计实验④证明上述结论。实验④为_______ (填实验方案)。
I.氢氧化镁粉末的溶解
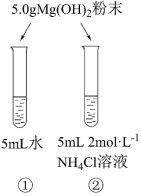
(1)常温下,实验①中有少量的氢氧化镁粉末溶解,向溶液①中滴加酚酞,溶液变为粉红色,则pH=
(2)实验②中氢氧化镁粉末大量溶解,实验②中反应的离子方程式为
II.探究氢氧化镁粉末在氯化铵溶液中的溶解原因。

(3)猜想1:NH4Cl溶液中的NH
 结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。
结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。猜想2:
将猜想2补充完整,为证明上述猜想,甲同学设计实验③,发现氢氧化镁粉末大量溶解。通过实验③可证明
(4)乙同学认为实验③中的CH3COO-也可能参与反应,故设计实验④证明上述结论。实验④为
您最近一年使用:0次



