名校
1 . 下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)。
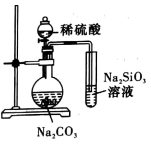 | 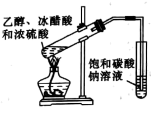 | 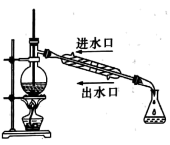 | 先加几滴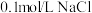 溶液,再加几滴 溶液,再加几滴 溶液 溶液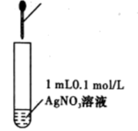 |
A.推断S、C、 的非金属性强弱 的非金属性强弱 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.证明氯化银溶解度大于硫化银 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-08更新
|
199次组卷
|
3卷引用:湖南省名校联考联合体2020-2021学年高二下学期期末考试化学试题
湖南省名校联考联合体2020-2021学年高二下学期期末考试化学试题重庆市第七中学校2022届高三上学期第一次月考化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)
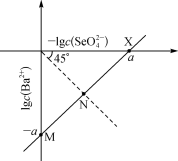
2 . 硒酸钡( )为特种玻璃的添加剂,制取原理为
)为特种玻璃的添加剂,制取原理为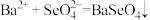 ,在
,在 饱和溶液中
饱和溶液中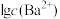 与
与 关系如图所示(
关系如图所示( 溶于水时吸收热量)。下列叙述错误的是
溶于水时吸收热量)。下列叙述错误的是
 )为特种玻璃的添加剂,制取原理为
)为特种玻璃的添加剂,制取原理为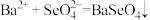 ,在
,在 饱和溶液中
饱和溶液中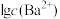 与
与 关系如图所示(
关系如图所示( 溶于水时吸收热量)。下列叙述错误的是
溶于水时吸收热量)。下列叙述错误的是
| A.升温:M点上移 | B.X点: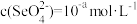 |
C.M点: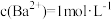 | D. : :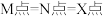 |
您最近一年使用:0次
2021-07-08更新
|
426次组卷
|
4卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题
3 . 草酸( )是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:
)是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:
(1) 中C元素的化合价为
中C元素的化合价为_______ 。
(2)某同学用酸性 溶液滴定含杂质的
溶液滴定含杂质的 测定样品的纯度(已知杂质不参与反应),实验步骤如下:
测定样品的纯度(已知杂质不参与反应),实验步骤如下:
准确称取1g 固体样品,配成
固体样品,配成 溶液,取出
溶液,取出 于锥形瓶中,再向锥形瓶中加入足量稀
于锥形瓶中,再向锥形瓶中加入足量稀 溶液,用
溶液,用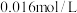 高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液
高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液 。
。
①高锰酸钾溶液应装在_______ 滴定管中,滴定至终点时的实验现象是________ 。
②下列操作可能使测量结果偏低的是_________ 。
a.盛装的 的滴定管没润洗
的滴定管没润洗
b.称取的 样品部分含有结晶水
样品部分含有结晶水
c.读数时滴定前俯视,滴定后仰视
d.滴定结束后滴定管尖端悬有一滴溶液
③计算样品中 的纯度
的纯度_______ 。
(3) 是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因
是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因_______ 。
 )是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:
)是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:(1)
 中C元素的化合价为
中C元素的化合价为(2)某同学用酸性
 溶液滴定含杂质的
溶液滴定含杂质的 测定样品的纯度(已知杂质不参与反应),实验步骤如下:
测定样品的纯度(已知杂质不参与反应),实验步骤如下:准确称取1g
 固体样品,配成
固体样品,配成 溶液,取出
溶液,取出 于锥形瓶中,再向锥形瓶中加入足量稀
于锥形瓶中,再向锥形瓶中加入足量稀 溶液,用
溶液,用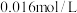 高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液
高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液 。
。①高锰酸钾溶液应装在
②下列操作可能使测量结果偏低的是
a.盛装的
 的滴定管没润洗
的滴定管没润洗b.称取的
 样品部分含有结晶水
样品部分含有结晶水c.读数时滴定前俯视,滴定后仰视
d.滴定结束后滴定管尖端悬有一滴溶液
③计算样品中
 的纯度
的纯度(3)
 是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因
是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因
您最近一年使用:0次
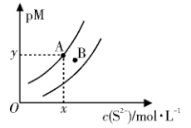
4 . 常温下, 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示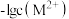 。下列说法正确的是
。下列说法正确的是
 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示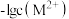 。下列说法正确的是
。下列说法正确的是
A.常温下,B点为 的不饱和溶液 的不饱和溶液 |
B.若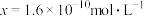 ,则 ,则 |
| C.若对A点浊液加热,A点沿曲线向上移动 |
D.在 和 和 同时沉淀的浊液中, 同时沉淀的浊液中, |
您最近一年使用:0次
2021-07-06更新
|
762次组卷
|
10卷引用:四川省乐山市2020-2021学年高二下学期期末考试化学试题
四川省乐山市2020-2021学年高二下学期期末考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)江西省抚州市2021-2022学年高二上学期期末学生学业质量监测化学试题四川省成都外国语学校2021-2022学年高二下学期入学考试化学试题四川省遂宁中学校2021-2022学年高二下学期期中考试化学试题四川省南充市南部县第二中学2021-2022学年高二下学期5月月考化学试题山东师范大学附属中学2022-2023学年高二上学期期中水平测试化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题广东省东莞市东莞中学松山湖学校2023-2024学年高二上学期期中考试化学试题 江西省南昌市第十中学2023-2024学年高二上学期第二次月考化学试题
解题方法
5 . 下列说法正确的是
| A.25℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合溶液显酸性 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中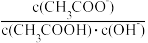 增大 增大 |
| C.相同温度下,相同浓度的NH4Cl溶液与(NH4)2SO4溶液pH前者小于后者 |
| D.相同温度下,足量的氯化银固体分别溶于相同浓度的盐酸和氯化镁溶液中,Ag+的浓度:前者大于后者 |
您最近一年使用:0次
名校
解题方法
6 . 室温下BaSO4沉淀溶解平衡曲线如图,下列结论正确的是
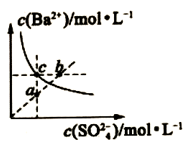
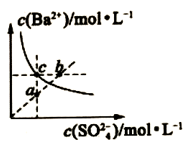
| A.b点无BaSO4沉淀生成 | B.蒸发可使溶液由a点到c点 |
| C.曲线上任意点的Ksp相同 | D.向a点加入BaCl2固体,溶液可达b点 |
您最近一年使用:0次
2021-06-29更新
|
396次组卷
|
5卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
江苏省宿迁市2020-2021学年高二下学期期末考试化学试题江苏省宿迁市沭阳县2020-2021学年高二下学期期末调研测试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)安徽省亳州市第一中学2021-2022学年高二上学期第二次月考化学试题
解题方法
7 . 实验室由铁泥(主要成分为铁的氧化物,还含有少量 和CaO等)制备软磁性材料
和CaO等)制备软磁性材料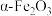 。其主要实验流程如下:
。其主要实验流程如下:

(1)酸浸:用一定浓度的 溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有
溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有_______ (写出一种方法),酸浸后的滤渣的主要成分是_______ 、_______ 。
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使 完全转化为
完全转化为 。“还原”过程中发生的主要反应的离子方程式为
。“还原”过程中发生的主要反应的离子方程式为_______ ﹔检验 完全被还原的实验方案为
完全被还原的实验方案为_______ 。
(3)除杂:向“还原”后的滤液中加入 溶液,使
溶液,使 转化为
转化为 沉淀除去。若溶液的酸性较强,将会导致
沉淀除去。若溶液的酸性较强,将会导致 沉淀不完全,其原因是
沉淀不完全,其原因是_______ (从平衡移动的角度分析,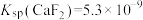 ,
,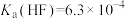 )。
)。
(4)沉铁:将提纯后的 溶液与氨水—
溶液与氨水— 混合溶液反应,生成
混合溶液反应,生成 沉淀。生成
沉淀。生成 沉淀的离子方程式为
沉淀的离子方程式为_______ 。
 和CaO等)制备软磁性材料
和CaO等)制备软磁性材料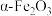 。其主要实验流程如下:
。其主要实验流程如下:
(1)酸浸:用一定浓度的
 溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有
溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有(2)还原:向“酸浸”后的滤液中加入过量铁粉,使
 完全转化为
完全转化为 。“还原”过程中发生的主要反应的离子方程式为
。“还原”过程中发生的主要反应的离子方程式为 完全被还原的实验方案为
完全被还原的实验方案为(3)除杂:向“还原”后的滤液中加入
 溶液,使
溶液,使 转化为
转化为 沉淀除去。若溶液的酸性较强,将会导致
沉淀除去。若溶液的酸性较强,将会导致 沉淀不完全,其原因是
沉淀不完全,其原因是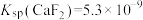 ,
,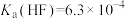 )。
)。(4)沉铁:将提纯后的
 溶液与氨水—
溶液与氨水— 混合溶液反应,生成
混合溶液反应,生成 沉淀。生成
沉淀。生成 沉淀的离子方程式为
沉淀的离子方程式为
您最近一年使用:0次
8 . 已知相同温度下, 。某温度下,饱和溶液中
。某温度下,饱和溶液中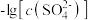 、
、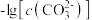 、与
、与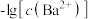 的关系如图所示。
的关系如图所示。
 。某温度下,饱和溶液中
。某温度下,饱和溶液中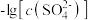 、
、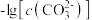 、与
、与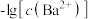 的关系如图所示。
的关系如图所示。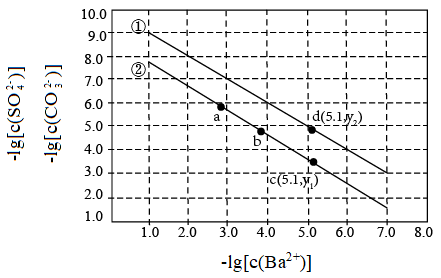
A.曲线①代表 的沉淀溶解曲线 的沉淀溶解曲线 |
B.该温度下 的 的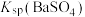 值为 值为 |
C.加适量 固体可使溶液由a点变到b点 固体可使溶液由a点变到b点 |
D. 时两溶液中 时两溶液中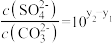 |
您最近一年使用:0次
2021-06-11更新
|
25698次组卷
|
71卷引用:重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题
重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题2021年高考全国甲卷化学真题(已下线)第八章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题河北省石家庄市第一中学2021-2022学年高二上学期10月月考化学试卷(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题河北省石家庄市第二中学2022届高三上学期11月第三次考试化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题云南省玉溪市通海县第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春市第二实验中学2022-2023学年高二上学期期末考试化学试题云南省大理白族自治州实验中学2021-2022学年高二上学期10月月考化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习山东省泰安市2021-2022学年高三下学期3月一模考试化学试题吉林省长春市2022届高三质量监测线上考试(三)理综化学试题(已下线)卷11 溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)【奋进985】08-备战2022年高考化学名校进阶模拟卷(通用版)云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)河南省商丘市五校2021-2022学年高二下学期5月联考化学试题(已下线)专题6 Ksp专练(已下线)专题10水溶液中的离子平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)第三章 综合拔高练(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题42 四大平衡常数的计算与应用-备战2023年高考化学一轮复习考点微专题江苏省海安市立发中学2022-2023学年高三上学期学情检测卷(二)化学试题辽宁省沈阳市五校协作体2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)广东省华南师范大学附属中学2022-2023学年高二上学期阶段检测化学B卷试题湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题湖南省株洲九方中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第八中学2022-2023学年高二上学期期中考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)题型142 有关沉淀溶解平衡图像湖南省岳阳市华容县普通高中2023届高三新高考适应性考试化学试题江西省赣州市重点中学九校联盟2022-2023学年高二下学期第一次月考化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)黑龙江省齐齐哈尔市讷河市第二中学等3校2022-2023学年高二下学期开学考试化学试题微专题(12) 电解质溶液中的两类特殊图像微专题(九)——沉淀溶解平衡曲线(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省广州市真光中学2023-2024学年高二上学期12月月考化学试题山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题
9 . 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgBr的Ksp=5×10-11,下列说法不正确的是
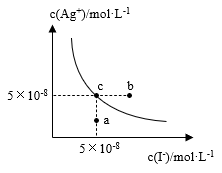

| A.在t℃时,AgI的Ksp=2.5×10-15 |
| B.图中b点有碘化银晶体析出 |
| C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 |
D.在t℃时,反应AgBr(s)+I-(aq) AgI(s)+ Br-(aq)的平衡常数K= 20000 AgI(s)+ Br-(aq)的平衡常数K= 20000 |
您最近一年使用:0次
2021-05-27更新
|
190次组卷
|
4卷引用:河北省正中实验中学2020-2021学年高二第一学期期末考试化学试题.
解题方法
10 . 室温下向100mL蒸馏水中加入1gCaCO3,一段时间后再向其中加入10mL蒸馏水,一段时间后继续加入10mL蒸馏水。该过程中电导率的变化如下图:
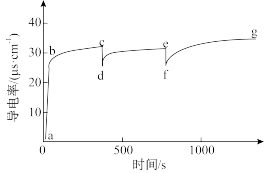
已知:室温下,CaCO3的溶解度为0.0013g。
下列说法不正确 的是

已知:室温下,CaCO3的溶解度为0.0013g。
下列说法
| A.a→b电导率上升是由于CaCO3固体部分溶解于水中 |
| B.c和e对应的时刻分别加入了10mL蒸馏水 |
| C.c→d、e→f,电导率下降,说明CaCO3的溶解平衡逆向移动 |
| D.g后的电导率几乎不再改变,说明CaCO3的溶解达到平衡状态 |
您最近一年使用:0次
2021-05-10更新
|
1116次组卷
|
8卷引用:广东省华附、省实、广雅、深中四校2020-2021学年高二下学期期末联考化学试题
广东省华附、省实、广雅、深中四校2020-2021学年高二下学期期末联考化学试题北京市西城区2021届高三化学第二次模拟考试(已下线)2021年高考化学押题预测卷(北京卷)(02)(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52讲 难溶电解质的溶解平衡



