名校
解题方法
1 . 硫化汞常用于彩色封蜡、塑料、橡胶和医药及防腐剂等方面。不同温度下HgS在水中的沉淀溶解平衡曲线如图所示。已知:HgS溶解的过程中吸收热量。下列说法正确的是
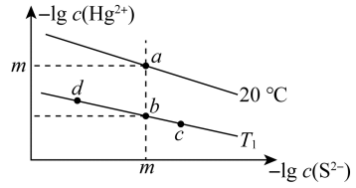

| A.图中T1<20℃ |
| B.升高温度可实现b点向a点的转化 |
| C.向b点对应的溶液中加入少量Na2S固体,b点向c点方向移动 |
| D.20℃时,HgS的饱和溶液的物质的量浓度为10-m mol·L-1 |
您最近一年使用:0次
2021-02-11更新
|
355次组卷
|
4卷引用:福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)四川省凉山州会理市民族实验中学2021-2022学年高三上学期第一次月考化学试题 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题
2 . 请根据所学知识回答:
(1)CH3COONa溶液中各种离子的浓度由大到小顺序为_______ 。
(2)请分析氯化铵溶液显酸性的原因_______ 。
(3)实验室中配制FeCl3溶液时常加入_______ 溶液以抑制其水解。
(4)氯化银在水中存在沉淀溶解平衡:AgCl(s) Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是
Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是_______ (填写序号)。
(1)CH3COONa溶液中各种离子的浓度由大到小顺序为
(2)请分析氯化铵溶液显酸性的原因
(3)实验室中配制FeCl3溶液时常加入
(4)氯化银在水中存在沉淀溶解平衡:AgCl(s)
 Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是
Ag++Cl‒。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1 mol·L‒1盐酸溶液中,充分搅拌后,相同温度下银离子浓度的大小关系是
您最近一年使用:0次
解题方法
3 . 下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c( )+c(OH﹣) )+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO﹣)+c(CH3COOH)+2c(Cl﹣) |
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合:c( )+c( )+c( )=c(Cl-) )=c(Cl-) |
您最近一年使用:0次
4 . 一定温度下,三种卤化银AgX(X=C1、Br、I)D的沉淀溶解平衡曲线如图所示。下列说法正确的是
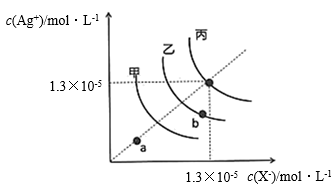

| A.甲是AgCl的沉淀溶解平衡曲线 |
| B.稀释b点溶液,AgX的Ksp会减小 |
| C.对三种卤化银而言,a点均为不饱和溶液 |
| D.向4 mL 5.0×10-5 mol·L-1的NaCl溶液中加入1 mL 0.1 mol·L-1的AgNO3溶液,不会析出沉淀 |
您最近一年使用:0次
解题方法
5 . 下列实验、现象与结论正确且相符的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向盛有 溶液的试管中加入几滴酸化的硫酸亚铁溶液 溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后,溶液中出现气泡,随后有红褐色沉淀生成 |  催化 催化 分解产生 分解产生 ; ; 分解反应放热,促进 分解反应放热,促进 的水解平衡正向移动 的水解平衡正向移动 |
| B | 将充满 的密闭玻璃球浸泡在热水中 的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应:  |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴 溶液 溶液 | 无明显现象 | 该过程未发生氧化还原反应 |
| D | 向2支盛有 相同浓度硝酸银溶液的试管中,分别加入2滴相同浓度的 相同浓度硝酸银溶液的试管中,分别加入2滴相同浓度的 和 和 溶液 溶液 | 一支无明显现象,另一支产生黄色沉淀 | 相同条件下, 比 比 的溶解度大 的溶解度大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 铬及其化合物有许多独特的性质和用途,如炼钢时加入一定量的铬可得到不锈钢。
(1)K2Cr2O7是实验中常用的强氧化剂之一,其中铬元素的化合价为_ 。向一支盛有5mL0.1mol/LK2Cr2O7溶液中滴加10~20滴6mol/LNaOH溶液,可观察到的现象是__ ,原因是(结合方程式解释)___ 。
(2)某化工厂从湿法炼锌的铜铬渣【主要含有锌、铜、铁、铬、钴(Co)等单质】中回收铬的流程如图:
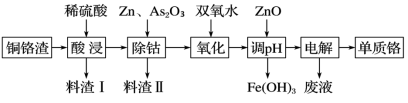
几种金属离子生成氢氧化物沉淀的pH如表所示:
①酸浸时形成的金属离子的价态均相同。料渣Ⅰ中只含有一种金属单质,该单质是___ 。
②料渣Ⅱ中含有大量的CoAs合金(提示:合金中金属元素化合价皆为0),请写出除钴时反应的离子方程式为___ 。
③加入双氧水时铁、铬形成的离子均被氧化,写出H2O2氧化铬形成Cr3+的离子方程式为___ 。
④加入ZnO调节pH的范围为___ 。
⑤单质铬在___ 极生成,另一电极的电极反应式为___ 。
(1)K2Cr2O7是实验中常用的强氧化剂之一,其中铬元素的化合价为
(2)某化工厂从湿法炼锌的铜铬渣【主要含有锌、铜、铁、铬、钴(Co)等单质】中回收铬的流程如图:

几种金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Zn(OH)2 | Cr(OH)3 |
| 开始沉淀的pH | 2.2 | 6.5 | 4.6 |
| 沉淀完全的pH | 3.5 | 8.5 | 5.9 |
②料渣Ⅱ中含有大量的CoAs合金(提示:合金中金属元素化合价皆为0),请写出除钴时反应的离子方程式为
③加入双氧水时铁、铬形成的离子均被氧化,写出H2O2氧化铬形成Cr3+的离子方程式为
④加入ZnO调节pH的范围为
⑤单质铬在
您最近一年使用:0次
7 . 25℃时,下列有关电解质溶液的说法正确的是
| A.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
B.向饱和AgCl溶液中加入少量AgNO3固体,AgCl(s) Ag+(aq)+Cl-(aq)平衡向左移动,AgCl的Ksp减小但AgCl的溶解度不变 Ag+(aq)+Cl-(aq)平衡向左移动,AgCl的Ksp减小但AgCl的溶解度不变 |
C.向CH3COONa稀溶液中加入少量CH3COONa固体,溶液中 增大 增大 |
| D.向盐酸中滴加氨水,由水电离出的c(H+)=10-7mol·L-1时,溶液一定显中性 |
您最近一年使用:0次
8 . 化学在生产生活中有着广泛的应用,请回答下列问题:
(1)开启啤酒瓶后瓶中立刻泛起大量泡沫,该变化______ (填“能”或“不能”)用勒夏特列原理解释。
(2)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:______ 。
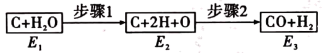
(3)某中学开展劳动实习,学生用废电池的锌皮制备ZnSO4∙7H2O,该过程中需除去锌皮中的少量杂质铁,方法是先加稀H2SO4和H2O2溶解,铁变为______ (填离子符号),再加碱调节至pH为______ 时,铁刚好沉淀完全(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱至pH为6时,锌开始沉淀。若上述过程不加H2O2后果是______ 。(已知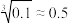 ,lg2
,lg2 0.3)
0.3)
(1)开启啤酒瓶后瓶中立刻泛起大量泡沫,该变化
(2)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:
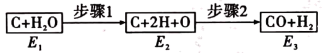
(3)某中学开展劳动实习,学生用废电池的锌皮制备ZnSO4∙7H2O,该过程中需除去锌皮中的少量杂质铁,方法是先加稀H2SO4和H2O2溶解,铁变为
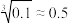 ,lg2
,lg2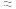 0.3)
0.3)| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp的近似值 | 10-17 | 10-17 | 10-39 |
您最近一年使用:0次
解题方法
9 . 请完成下列填空:
(1)还原剂肼( )与氧化剂
)与氧化剂 混合极易发生反应,生成气态水和氮气。已知:①使
混合极易发生反应,生成气态水和氮气。已知:①使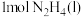 和
和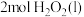 转化为
转化为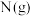 、
、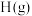 、
、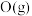 需要吸收
需要吸收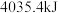 热量,破坏
热量,破坏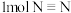 键需吸收
键需吸收 热量;②
热量;②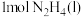 与
与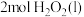 完全反应生成气态水和氮气的能量变化如图所示:
完全反应生成气态水和氮气的能量变化如图所示:

①该反应的热化学方程式为___________ 。
②断开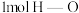 键吸收的热量为
键吸收的热量为___________  。
。
(2)25℃时,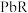 (
( 为
为 或
或 )的沉淀溶解平衡关系如图所示。
)的沉淀溶解平衡关系如图所示。
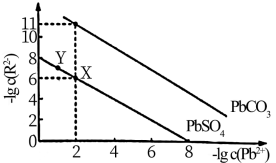
①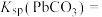
___________ 。
②向X点对应的饱和溶液中加入少量 固体,
固体,___________ (填“能”或“不能”)转化为Y点对应的溶液。
③当 和
和 沉淀共存时,溶液中
沉淀共存时,溶液中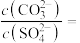
___________ 。
(1)还原剂肼(
 )与氧化剂
)与氧化剂 混合极易发生反应,生成气态水和氮气。已知:①使
混合极易发生反应,生成气态水和氮气。已知:①使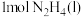 和
和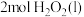 转化为
转化为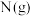 、
、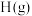 、
、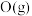 需要吸收
需要吸收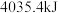 热量,破坏
热量,破坏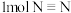 键需吸收
键需吸收 热量;②
热量;②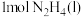 与
与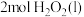 完全反应生成气态水和氮气的能量变化如图所示:
完全反应生成气态水和氮气的能量变化如图所示:
①该反应的热化学方程式为
②断开
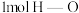 键吸收的热量为
键吸收的热量为 。
。(2)25℃时,
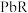 (
( 为
为 或
或 )的沉淀溶解平衡关系如图所示。
)的沉淀溶解平衡关系如图所示。
①
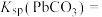
②向X点对应的饱和溶液中加入少量
 固体,
固体,③当
 和
和 沉淀共存时,溶液中
沉淀共存时,溶液中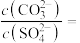
您最近一年使用:0次
10 .  时,难溶盐
时,难溶盐 、
、 、
、 溶液中阳离子浓度的负对数
溶液中阳离子浓度的负对数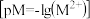 和阴离子浓度的负对数
和阴离子浓度的负对数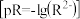 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
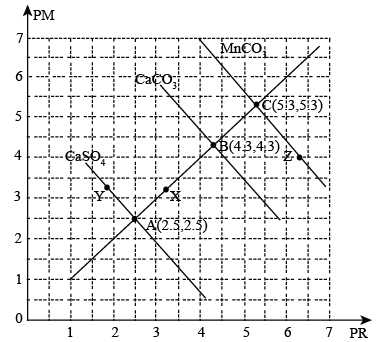
 时,难溶盐
时,难溶盐 、
、 、
、 溶液中阳离子浓度的负对数
溶液中阳离子浓度的负对数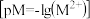 和阴离子浓度的负对数
和阴离子浓度的负对数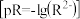 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
A.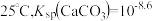 |
B.向A点对应的溶液中加入固体 ,可得到Y点对应的溶液 ,可得到Y点对应的溶液 |
C. ,三种物质的溶解度: ,三种物质的溶解度: |
D. ,向 ,向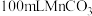 饱和溶液中加入 饱和溶液中加入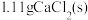 ,有 ,有 沉淀生成 沉淀生成 |
您最近一年使用:0次
2021-02-01更新
|
565次组卷
|
4卷引用:山东省菏泽市2021届高三上学期期末考试化学试题
山东省菏泽市2021届高三上学期期末考试化学试题(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)2022年山东省高考真题变式题(不定项选择题)山东省济南市历城第二中学2023届高三上学期一轮复习验收考试化学试题



