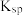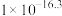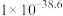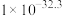1 . Ⅰ.甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生H2,再将CO2与H2转化为甲醇,以实现碳中和。
(1)下列关于甲醇(CH3OH)的说法中,正确的是___________
Ⅱ.已知,CO2生产甲醇过程主要发生以下反应:
反应Ⅰ.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
反应Ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
反应Ⅲ.CO(g) + 2H2(g) CH3OH(g) ∆H3
CH3OH(g) ∆H3
(2)反应Ⅲ中,①活化能E(正)___________ E (逆) (填“>”、“<”或“=”);
②该反应在___________ 条件下能自发进行;
A.在高温条件下自发进行 B.在低温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
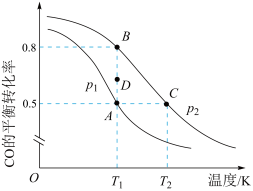
(3)反应III中,CO的平衡转化率与温度的关系如图所示:___________ 。T1时,由D点到B点过程中,正、逆反应速率之间的关系:v正 ___________ v逆。(填“>”、“<”或“=”)
②向某恒温恒压密闭 容器中充入1mol CO(g)和2mol H2(g),下列能说明反应III达到平衡的是___________ ;
A.容器内混合气体的密度不再改变
B.容器内混合气体的平均相对分子质量不再改变
C.两种反应物转化率的比值不再改变
D.v正(CO)=2 v逆(H2)
③在2L恒容密闭 容器中充入2mol CO和4mol H2,在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=___________ mol·L−1·min−1。
(4)在CO2加氢合成甲醇的体系中,①下列说法不正确的是___________ ;
A.若在绝热恒容 容器,反应I的平衡常数K保持不变,说明反应I、II都已达平衡
B.若气体的平均相对分子质量不变,说明反应I、II都已达平衡
C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应II平衡不移动
D.选用合适的催化剂可以提高甲醇在单位时间内的产量
②已知:CH3OH的选择性=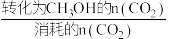 ×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是
×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________ ,并说明其原因
A.高温高压 B.高温低压 C.低温低压 D.低温高压
原因:___________
(5)我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式___________ 。
(1)下列关于甲醇(CH3OH)的说法中,正确的是___________
| A.甲醇在一定条件下可被氧化生成CO2 | B.甲醇储氢符合“相似相溶”原理 |
C.甲醇官能团的电子式: | D.甲醇分子是含有极性键的非极性分子 |
Ⅱ.已知,CO2生产甲醇过程主要发生以下反应:
反应Ⅰ.CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1 反应Ⅱ.CO2(g) + H2(g)
 CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1反应Ⅲ.CO(g) + 2H2(g)
 CH3OH(g) ∆H3
CH3OH(g) ∆H3(2)反应Ⅲ中,①活化能E(正)
②该反应在
A.在高温条件下自发进行 B.在低温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(3)反应III中,CO的平衡转化率与温度的关系如图所示:
②向某
A.容器内混合气体的密度不再改变
B.容器内混合气体的平均相对分子质量不再改变
C.两种反应物转化率的比值不再改变
D.v正(CO)=2 v逆(H2)
③在2L
(4)在CO2加氢合成甲醇的体系中,①下列说法不正确的是
A.若在
B.若气体的平均相对分子质量不变,说明反应I、II都已达平衡
C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应II平衡不移动
D.选用合适的催化剂可以提高甲醇在单位时间内的产量
②已知:CH3OH的选择性=
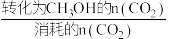 ×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是
×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是A.高温高压 B.高温低压 C.低温低压 D.低温高压
原因:
(5)我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式
您最近一年使用:0次
名校
2 . 肼( )有较强的还原性,与
)有较强的还原性,与 等可组成火箭推进剂。
等可组成火箭推进剂。
(1)已知:Ⅰ.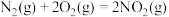

Ⅱ.
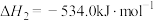
Ⅲ.

火箭发射时 与
与 反应生成
反应生成 和
和 。该反应的热化学方程式是
。该反应的热化学方程式是___________ 。
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.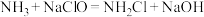 (快)
(快)
ii.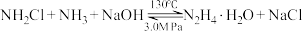 (慢)
(慢)
已知电负性N>Cl。下列说法正确的是___________ (填序号)。
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内 的产量
的产量
c.采用3.0MPa压强可以增大 的溶解度,提高反应ii中
的溶解度,提高反应ii中 的利用率
的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。
①水合肼( ,常温为液态)中
,常温为液态)中 与
与 间存在氢键,用“X-H…Y”表示
间存在氢键,用“X-H…Y”表示 与
与 间存在的氢键:
间存在的氢键:___________ 。
②蒸馏过程中首先馏出的物质是___________ (填序号)。
a. b.
b. c.NaCl
c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用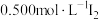 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00mL。已知:
溶液20.00mL。已知: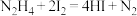
①样品中肼(以 计)的质量分数为
计)的质量分数为___________ 。
②若滴定过程中操作过于缓慢,则测定结果___________ (填“偏大”“偏小”或“不受影响”)。
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如右图所示。___________ 。
②电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因___________ 。
 )有较强的还原性,与
)有较强的还原性,与 等可组成火箭推进剂。
等可组成火箭推进剂。(1)已知:Ⅰ.
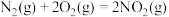

Ⅱ.

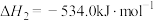
Ⅲ.


火箭发射时
 与
与 反应生成
反应生成 和
和 。该反应的热化学方程式是
。该反应的热化学方程式是(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.
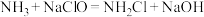 (快)
(快)ii.
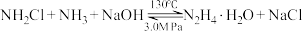 (慢)
(慢)已知电负性N>Cl。下列说法正确的是
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内
 的产量
的产量c.采用3.0MPa压强可以增大
 的溶解度,提高反应ii中
的溶解度,提高反应ii中 的利用率
的利用率(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。
①水合肼(
 ,常温为液态)中
,常温为液态)中 与
与 间存在氢键,用“X-H…Y”表示
间存在氢键,用“X-H…Y”表示 与
与 间存在的氢键:
间存在的氢键:②蒸馏过程中首先馏出的物质是
a.
 b.
b. c.NaCl
c.NaCl(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用
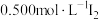 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00mL。已知:
溶液20.00mL。已知: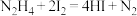
①样品中肼(以
 计)的质量分数为
计)的质量分数为②若滴定过程中操作过于缓慢,则测定结果
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如右图所示。
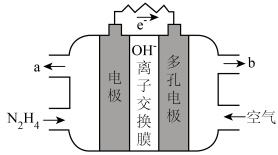
②电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因
您最近一年使用:0次
名校
3 . 我国提出努力争取实现在2060年前实现碳中和,充分体现了为解决环境问题的大国担当,为此科研工作者进行了不懈的努力,研究了多种转化 的技术,请回答下列问题:
的技术,请回答下列问题:
(1) 转化为
转化为 :反应原理为
:反应原理为
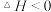 。若该反应自发进行,反应适宜条件是
。若该反应自发进行,反应适宜条件是______ (填“低温”或“高温”)。
(2)二氧化碳到淀粉的人工合成第一步为用无机催化剂将二氧化碳还原为甲醇,反应方程式为 。一定温度下,恒容密闭容器中投入3mol
。一定温度下,恒容密闭容器中投入3mol 和1mol
和1mol ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为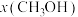 ,在
,在 下的
下的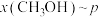 、在
、在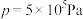 下的
下的 如图所示。请回答:
如图所示。请回答:______ (填“a”或“b”)代表 下的
下的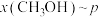 ;该反应为
;该反应为______ 反应(填“放热”或“吸热”)
②下列不能说明该反应达平衡的是:______ 。
a.单位时间内断裂 个碳氧双键同时断裂
个碳氧双键同时断裂 个氢氧键
个氢氧键
b.密度不再改变
c.平均相对分子质量不变
d. 不变
不变
③下列措施既能加快反应速率,又能提高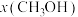 的是
的是______ 。
a.升高温度 b.分离出水蒸气
c.温度不变缩小容器体积 d.增大 的浓度
的浓度
④计算在250℃,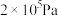 下达平衡后,
下达平衡后, 的转化率
的转化率
______ 。(保留三位有效数字)
(3)据文献报道, 可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______ 。
(4) 超干重整
超干重整 得到的CO经偶联反应可制得草酸
得到的CO经偶联反应可制得草酸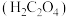 。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中
。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中 ,则此时溶液的
,则此时溶液的
______ 。(已知常温下 的
的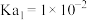 ,
, )
)
 的技术,请回答下列问题:
的技术,请回答下列问题:(1)
 转化为
转化为 :反应原理为
:反应原理为
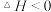 。若该反应自发进行,反应适宜条件是
。若该反应自发进行,反应适宜条件是(2)二氧化碳到淀粉的人工合成第一步为用无机催化剂将二氧化碳还原为甲醇,反应方程式为
 。一定温度下,恒容密闭容器中投入3mol
。一定温度下,恒容密闭容器中投入3mol 和1mol
和1mol ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为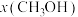 ,在
,在 下的
下的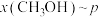 、在
、在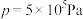 下的
下的 如图所示。请回答:
如图所示。请回答: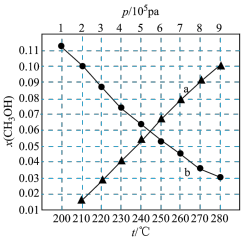
 下的
下的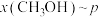 ;该反应为
;该反应为②下列不能说明该反应达平衡的是:
a.单位时间内断裂
 个碳氧双键同时断裂
个碳氧双键同时断裂 个氢氧键
个氢氧键b.密度不再改变
c.平均相对分子质量不变
d.
 不变
不变③下列措施既能加快反应速率,又能提高
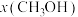 的是
的是a.升高温度 b.分离出水蒸气
c.温度不变缩小容器体积 d.增大
 的浓度
的浓度④计算在250℃,
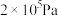 下达平衡后,
下达平衡后, 的转化率
的转化率
(3)据文献报道,
 可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是(4)
 超干重整
超干重整 得到的CO经偶联反应可制得草酸
得到的CO经偶联反应可制得草酸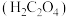 。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中
。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中 ,则此时溶液的
,则此时溶液的
 的
的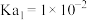 ,
, )
)
您最近一年使用:0次
解题方法
4 . 为探究+1价Ag的氧化性,开展如下活动。
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为_______ 、操作②为_______ 。_______ g固体。
③实验室AgNO3溶液通常盛放在_______ 试剂瓶中。
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:_______ 。
②I、II中的现象说明:_______ 。
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因_______ 。
(3)利用如下图所示装置,探究Ag+氧化I–的反应。_______ 。
A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作_______ 。
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是 氧化了I–,将装置中的
氧化了I–,将装置中的_______ 溶液换成_______ ,闭合K,指针未发生偏转,确认Ag+氧化了I–。
取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。_______ 。
(5)为得到光亮的银镜,实验时应做到:_______ (任写2点)。若黑色沉淀全部转化为银镜,理论上需要乙醛_______ mol。
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为

③实验室AgNO3溶液通常盛放在
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
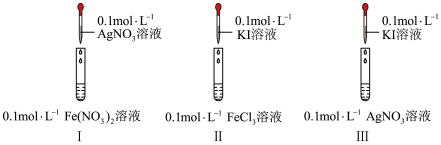
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:
②I、II中的现象说明:
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因
(3)利用如下图所示装置,探究Ag+氧化I–的反应。

A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是
 氧化了I–,将装置中的
氧化了I–,将装置中的取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。
(5)为得到光亮的银镜,实验时应做到:
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
您最近一年使用:0次
解题方法
5 . 四氧化三锰( )广泛应用于软磁材料、电池材料等制备领域。一种以低品位锰矿(含
)广泛应用于软磁材料、电池材料等制备领域。一种以低品位锰矿(含 、
、 、MnOOH及少量
、MnOOH及少量 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
①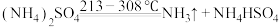
②已知:25℃时相关物质的 见表
见表
③当 时,
时, 开始溶解
开始溶解
回答下列问题:
(1)Mn元素在周期表中的______ 区,从核外电子排布的角度,稳定性Mn(Ⅱ)______ Mn(Ⅲ)(填“>”或“<”)。
(2)“溶浸”过程中,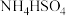 可用
可用______ (填标号)代替,理由是______ 。
A.盐酸 B.硫酸 C.硝酸
(3)加入 调节
调节 时,杂质离子是否能完全沉淀
时,杂质离子是否能完全沉淀______ (填“是”或“否”),此时“滤渣2”的主要成分是______ 。(溶液中离子浓度 视为完全沉淀)
视为完全沉淀)
(4)“沉锰”步骤中,杂质含量直接影响 的品位,实验测得温度对
的品位,实验测得温度对 中硫酸根含量的影响如图所示,实际生产中综合考虑选择50℃为宜,不选择更高温度的原因是
中硫酸根含量的影响如图所示,实际生产中综合考虑选择50℃为宜,不选择更高温度的原因是______ 。“母液”中,能转换成可循环利用的物质是______ 。 是制备电池正极材料
是制备电池正极材料 的优质原料,该电极在电池放电过程中转化为
的优质原料,该电极在电池放电过程中转化为 ,写出正极放电时的电极反应式
,写出正极放电时的电极反应式______ 。
 )广泛应用于软磁材料、电池材料等制备领域。一种以低品位锰矿(含
)广泛应用于软磁材料、电池材料等制备领域。一种以低品位锰矿(含 、
、 、MnOOH及少量
、MnOOH及少量 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下: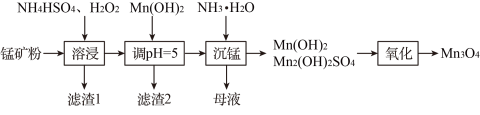
①
②已知:25℃时相关物质的
 见表
见表③当
 时,
时, 开始溶解
开始溶解物质 |
|
|
|
|
|
|
|
|
|
(1)Mn元素在周期表中的
(2)“溶浸”过程中,
 可用
可用A.盐酸 B.硫酸 C.硝酸
(3)加入
 调节
调节 时,杂质离子是否能完全沉淀
时,杂质离子是否能完全沉淀 视为完全沉淀)
视为完全沉淀)(4)“沉锰”步骤中,杂质含量直接影响
 的品位,实验测得温度对
的品位,实验测得温度对 中硫酸根含量的影响如图所示,实际生产中综合考虑选择50℃为宜,不选择更高温度的原因是
中硫酸根含量的影响如图所示,实际生产中综合考虑选择50℃为宜,不选择更高温度的原因是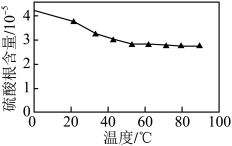
 是制备电池正极材料
是制备电池正极材料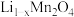 的优质原料,该电极在电池放电过程中转化为
的优质原料,该电极在电池放电过程中转化为 ,写出正极放电时的电极反应式
,写出正极放电时的电极反应式
您最近一年使用:0次
6 . 据报道某新型镁-锂双离子二次电池如下图所示。下列说法正确的是
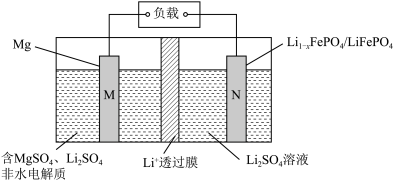
A.放电时, 移动方向从右往左 移动方向从右往左 |
| B.充电时,M与外电源正极相连 |
C.放电时,N极反应为: |
D.充电时,若外电路有 电子转移,阴极室的溶液的质量减少1.0g 电子转移,阴极室的溶液的质量减少1.0g |
您最近一年使用:0次
名校
7 . 一种热再生氨基液流电池的工作原理如图所示,下列有关说法错误 的是
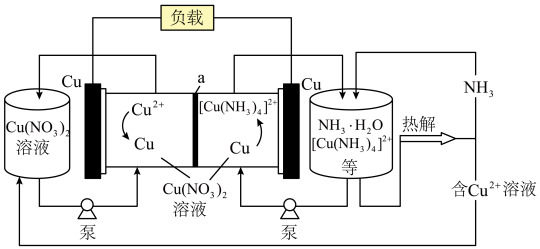
| A.a为阴离子交换膜 |
B.放电时负极反应为 |
C.为保证电池的循环使用需不断更换新的负极金属 板 板 |
D.热解的离子方程式为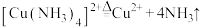 |
您最近一年使用:0次
解题方法
8 . 利用微生物处理有机废水可获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含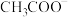 的溶液为例)。下列说法错误的是
的溶液为例)。下列说法错误的是
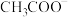 的溶液为例)。下列说法错误的是
的溶液为例)。下列说法错误的是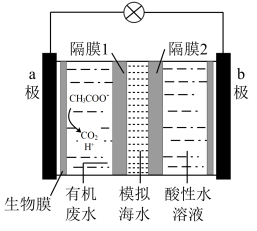
A.正极反应为 |
| B.该电池不能在高温环境下工作 |
C.电池工作时, 向a极移动, 向a极移动, 向b极移动 向b极移动 |
| D.当a电极产生44 g气体时,理论上转移2 mol电子 |
您最近一年使用:0次
2024-04-16更新
|
587次组卷
|
3卷引用:通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题
解题方法
9 . 我市某校学习小组研究利用电化学的原理处理酸性污水的一种方法,装置如下图,若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基);若上端开口关闭,可得到强还原性的H·氢原子)。下列说法正确的是

A.无论是否鼓入空气,正极的电极反应式均为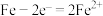 |
B.上端开口打开,鼓入空气时,每生成1mol·OH转移电子数目为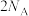 |
| C.处理含有草酸(H2C2O4)的污水时,应打开上端开口 |
| D.该原理是基于电解原理、氧化还原、物理吸附等共同对污水进行处理 |
您最近一年使用:0次
解题方法
10 . 为深入贯彻落实党中央、国务院关于碳达峰、碳中和的重大战略部署,某研究团队设计了以下装置,用 和
和 反应提供电能,电解
反应提供电能,电解 制取
制取 ,实现
,实现 资源化利用。下列说法正确的是
资源化利用。下列说法正确的是
 和
和 反应提供电能,电解
反应提供电能,电解 制取
制取 ,实现
,实现 资源化利用。下列说法正确的是
资源化利用。下列说法正确的是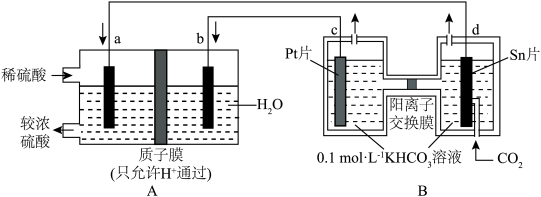
A. 电极应通入 电极应通入 电极应通入 电极应通入 |
B.外电路电子的流向为: |
C. 参与的电极反应式: 参与的电极反应式: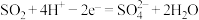 |
D.电解一段时间后,B装置左池中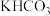 溶液浓度降低 溶液浓度降低 |
您最近一年使用:0次