1 . 苹果和葡萄都是生活中常见的水果,营养价值都比较高,适量食用会提高机体免疫力。某课外小组利用苹果和葡萄设计了一组实验,请你协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入___________ ,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制氢氧化铜悬浊液,并加热,产生红色的沉淀,则苹果中含有(写分子式)___________ 。
(3)苹果中含有苹果酸,测得其相对分子质量为134。取1mol苹果酸,使其完全燃烧,生成4mol 和3mol
和3mol 。则苹果酸的分子式是
。则苹果酸的分子式是___________ 。
(4)写出葡萄在酿酒过程中,葡萄糖转化为酒精化学反应方程式___________ 。
(5)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验小组用如图装置制备乙酸乙酯。
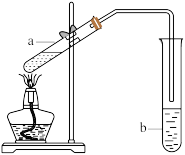
①试管a中生成乙酸乙酯的化学方程式是___________ 。
②实验开始时,试管b中的导管不伸入液面下的原因是___________ 。
③实验中若起始时在容器中加入0.3mol乙醇、0.1mol乙酸和一定量的浓硫酸,充分反应后容器中残留的乙醇可能为___________ 。
A.0.2mol B.0.26mol C.0.28mol D.0.3mol
④如果用4.6g的乙醇和9.0g的乙酸反应制得乙酸乙酯6.6g,则本实验的产率是___________ ;(得数保留小数点后一位;产率指的是某种生成物的实际产量与理论产量的比值)
(1)用小试管取少量的苹果汁,加入
(2)用小试管取少量的苹果汁,加入新制氢氧化铜悬浊液,并加热,产生红色的沉淀,则苹果中含有(写分子式)
(3)苹果中含有苹果酸,测得其相对分子质量为134。取1mol苹果酸,使其完全燃烧,生成4mol
 和3mol
和3mol 。则苹果酸的分子式是
。则苹果酸的分子式是(4)写出葡萄在酿酒过程中,葡萄糖转化为酒精化学反应方程式
(5)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验小组用如图装置制备乙酸乙酯。

①试管a中生成乙酸乙酯的化学方程式是
②实验开始时,试管b中的导管不伸入液面下的原因是
③实验中若起始时在容器中加入0.3mol乙醇、0.1mol乙酸和一定量的浓硫酸,充分反应后容器中残留的乙醇可能为
A.0.2mol B.0.26mol C.0.28mol D.0.3mol
④如果用4.6g的乙醇和9.0g的乙酸反应制得乙酸乙酯6.6g,则本实验的产率是
您最近半年使用:0次
解题方法
2 . 在用淀粉制取葡萄糖的实验中,请设计实验方案证明:
(1)淀粉已发生水解________ ;
(2)淀粉已完全水解______ 。
(1)淀粉已发生水解
(2)淀粉已完全水解
您最近半年使用:0次
名校
解题方法
3 . 草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐均易溶于水,而其钙盐难溶于水。草酸晶体( )无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。某兴趣小组用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。某兴趣小组用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
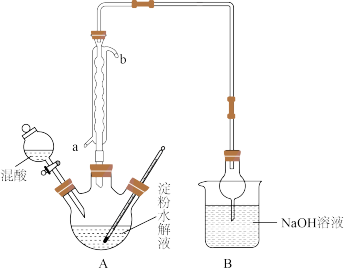
实验步骤如下:
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为 的
的 与
与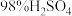 的混合物),在
的混合物),在 ℃下发生反应;
℃下发生反应;
③反应后溶液经冷却、减压过滤,即得草酸晶体( )粗产品。
)粗产品。
(1)装混酸的仪器名称为_______ ,冷凝管进水的接口为_______ (填“a”或“b”)。
(2)步骤①中判断淀粉水解是否完全的操作为_______ 。
(3)步骤②中,配制混酸的方法是_______ ;氧化时可通过_______ (填操作)控制反应温度不超过60℃,控温的作用是_______ 。
(4)反应结束后测得B的烧杯中 与
与 的物质的量之比为
的物质的量之比为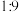 ,则葡萄糖(
,则葡萄糖( )被氧化为草酸(不考虑其他的副反应)的化学方程式为
)被氧化为草酸(不考虑其他的副反应)的化学方程式为_______ 。
(5)称取8.0g草酸晶体粗产品,配成100mL溶液。取25.00mL于锥形瓶中,加入适量硫酸,用0.200mol/L的 标准液滴定,杂质不参与反应,数据记录如表所示,则滴定时发生反应的离子方程式为
标准液滴定,杂质不参与反应,数据记录如表所示,则滴定时发生反应的离子方程式为_______ ;该草酸晶体( )的纯度为
)的纯度为_______ %。
 )无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。某兴趣小组用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。某兴趣小组用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
实验步骤如下:
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为
 的
的 与
与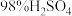 的混合物),在
的混合物),在 ℃下发生反应;
℃下发生反应;③反应后溶液经冷却、减压过滤,即得草酸晶体(
 )粗产品。
)粗产品。(1)装混酸的仪器名称为
(2)步骤①中判断淀粉水解是否完全的操作为
(3)步骤②中,配制混酸的方法是
(4)反应结束后测得B的烧杯中
 与
与 的物质的量之比为
的物质的量之比为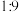 ,则葡萄糖(
,则葡萄糖( )被氧化为草酸(不考虑其他的副反应)的化学方程式为
)被氧化为草酸(不考虑其他的副反应)的化学方程式为(5)称取8.0g草酸晶体粗产品,配成100mL溶液。取25.00mL于锥形瓶中,加入适量硫酸,用0.200mol/L的
 标准液滴定,杂质不参与反应,数据记录如表所示,则滴定时发生反应的离子方程式为
标准液滴定,杂质不参与反应,数据记录如表所示,则滴定时发生反应的离子方程式为 )的纯度为
)的纯度为| 起始滴定管的读数/mL | 实验结束滴定管的读数/mL | |
| 第一次 | 0.10 | 22.35 |
| 第二次 | 1.50 | 22.10 |
| 第三次 | 0.80 | 22.95 |
您最近半年使用:0次
2022-08-27更新
|
251次组卷
|
3卷引用:河南省平顶山市、安阳市部分学校2022-2023学年高三上学期开学考试化学试题
解题方法
4 . 以淀粉为主要原料合成一种有机酸B的路线如下图所示。
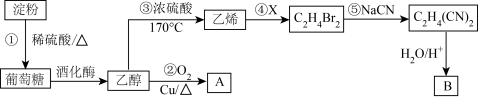
回答下列问题:
(1)检验反应①中淀粉是否完全水解,可使用的试剂是_______(填字母)。
(2)葡萄糖的分子式为_______ ,反应⑤的反应类型为_______ 。
(3)反应②和③的化学方程式依次为_______ 、_______ 。
(4)若X为 的
的 溶液,则反应④的现象为
溶液,则反应④的现象为_______ 。
(5)已知B的分子式为 ,其核磁共振氢谱中峰面积之比为2:1,则B的结构简式为
,其核磁共振氢谱中峰面积之比为2:1,则B的结构简式为_______ 。

回答下列问题:
(1)检验反应①中淀粉是否完全水解,可使用的试剂是_______(填字母)。
A. 溶液 溶液 | B.碘水 | C.新制的 | D.NaOH溶液 |
(3)反应②和③的化学方程式依次为
(4)若X为
 的
的 溶液,则反应④的现象为
溶液,则反应④的现象为(5)已知B的分子式为
 ,其核磁共振氢谱中峰面积之比为2:1,则B的结构简式为
,其核磁共振氢谱中峰面积之比为2:1,则B的结构简式为
您最近半年使用:0次
2022-08-20更新
|
319次组卷
|
2卷引用:第一节糖类-第2课时二糖多糖
5 . 有机物是产生生命的物质基础,所有的生命体都含有机化合物。生物体内的新陈代谢和生物的遗传都涉及有机化合物的转变。结合如图所示转化关系,回答下列问题。

(1)A是一种遇到碘水能变蓝的多糖,A的名称是_______ 。
(2)B能够在加热条件下与新制的氢氧化铜悬浊液反应产生砖红色沉淀,但不能发生水解反应,则B中官能团的名称为_______ 。
(3)C、D是生活中两种常见的有机物,二者在一定条件下反应生成有香味的F,写出这一反应的化学方程式:_______ ;写出C转化为E的化学方程式:_______ 。
(4)只用一种试剂(可加热)就能鉴别B、C、D三种物质,这种试剂是_______ 。

(1)A是一种遇到碘水能变蓝的多糖,A的名称是
(2)B能够在加热条件下与新制的氢氧化铜悬浊液反应产生砖红色沉淀,但不能发生水解反应,则B中官能团的名称为
(3)C、D是生活中两种常见的有机物,二者在一定条件下反应生成有香味的F,写出这一反应的化学方程式:
(4)只用一种试剂(可加热)就能鉴别B、C、D三种物质,这种试剂是
您最近半年使用:0次
解题方法
6 . 已知烃A是一种重要的化工原料,其在标准状况下的密度为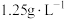 。
。
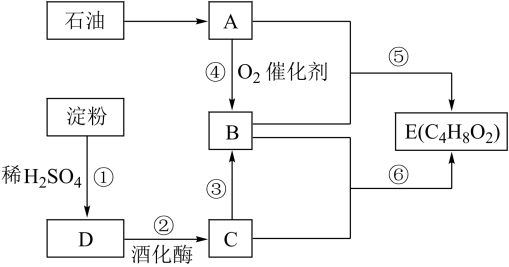
(1)物质B的官能团名称为_______ ;③的反应类型为_______ 。
(2)写出反应⑥的化学方程式_______ 。
(3)下列说法正确的是_______。
 。
。
(1)物质B的官能团名称为
(2)写出反应⑥的化学方程式
(3)下列说法正确的是_______。
| A.向反应①所得溶液中直接加入碘水,若不变蓝,则证明淀粉已经完全水解 |
| B.B、C、E可以用饱和碳酸钠溶液鉴别 |
| C.一定条件下A发生加聚反应所得产物可以使溴的四氯化碳溶液褪色 |
| D.⑤和⑥的反应类型相同 |
您最近半年使用:0次
名校
7 . 将浓度均为0.01mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是____ 。对于总反应,I-的作用相当于____ 。
(2)为证明反应A、B的存在,进行实验I。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是____ 。
(3)为探究溶液变蓝快慢的影响因素,进行实验II、实验III。(溶液浓度均为0.01mol/L)
溶液从混合时的无色变为蓝色的时间:实验II是30min、实验III是40min。
①实验III中,z的数值是____ 。
②对比实验II、实验III,可得出的实验结论是____ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。
(溶液浓度均为0.01mol/L)
实验过程中,溶液始终 无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:____ 。
(资料)
该“碘钟实验”的总反应:H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O
+2H2O反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是
(2)为证明反应A、B的存在,进行实验I。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是
(3)为探究溶液变蓝快慢的影响因素,进行实验II、实验III。(溶液浓度均为0.01mol/L)
| 试剂 序号 用量(mL) | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验II | 5 | 4 | 8 | 3 | 0 |
| 实验III | 5 | 2 | x | y | z |
①实验III中,z的数值是
②对比实验II、实验III,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。
(溶液浓度均为0.01mol/L)
| 试剂 序号 用量(mL) | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验IV | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:
您最近半年使用:0次
解题方法
8 . 草酸(HOOC-COOH,弱酸)及其化合物在工业中有重要作用。某实验小组同学在实验室利用两种方法制备草酸。回答下列问题:
(1)利用CO与亚硝酸甲酯(CH3ONO)先合成草酸二甲酯(CH3OOCCOOCH3),然后草酸二甲酯水解生成草酸。草酸二甲酯水解的化学方程式为_______ ;其中制备亚硝酸甲酯的反应为 ,实验室制备NO常用的试剂为
,实验室制备NO常用的试剂为_______ 。
(2)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置(夹持仪器已省略)如图所示。
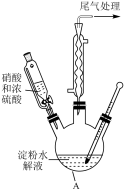
①仪器A的名称为_______ 。
②葡萄糖溶液可由反应 (淀粉)
(淀粉) (葡萄糖)得到。该实验中证明淀粉已经完全水解的实验操作及现象是
(葡萄糖)得到。该实验中证明淀粉已经完全水解的实验操作及现象是_______ 。
③反应在55℃~60℃进行,仪器A中除生成 外,同时也生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗
外,同时也生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗 的硝酸溶液的体积为
的硝酸溶液的体积为_______ mL。
④该实验中催化剂浓硫酸用量不宜过多,否则会导致草酸产率减少,其原因是_______ 。
(3)草酸具有较强的还原性,与氧化剂作用易被氧化成二氧化碳和水,故实验室可利用草酸测定次氯酸钠溶液的浓度。实验步骤如下:取 草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为25.00mL。
草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为25.00mL。
①次氯酸钠与草酸反应的离子方程式为_______ 。
②次氯酸钠溶液物质的量浓度为_______  。
。
(1)利用CO与亚硝酸甲酯(CH3ONO)先合成草酸二甲酯(CH3OOCCOOCH3),然后草酸二甲酯水解生成草酸。草酸二甲酯水解的化学方程式为
 ,实验室制备NO常用的试剂为
,实验室制备NO常用的试剂为(2)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置(夹持仪器已省略)如图所示。

①仪器A的名称为
②葡萄糖溶液可由反应
 (淀粉)
(淀粉) (葡萄糖)得到。该实验中证明淀粉已经完全水解的实验操作及现象是
(葡萄糖)得到。该实验中证明淀粉已经完全水解的实验操作及现象是③反应在55℃~60℃进行,仪器A中除生成
 外,同时也生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗
外,同时也生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗 的硝酸溶液的体积为
的硝酸溶液的体积为④该实验中催化剂浓硫酸用量不宜过多,否则会导致草酸产率减少,其原因是
(3)草酸具有较强的还原性,与氧化剂作用易被氧化成二氧化碳和水,故实验室可利用草酸测定次氯酸钠溶液的浓度。实验步骤如下:取
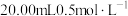 草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为25.00mL。
草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为25.00mL。①次氯酸钠与草酸反应的离子方程式为
②次氯酸钠溶液物质的量浓度为
 。
。
您最近半年使用:0次
名校
解题方法
9 . ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
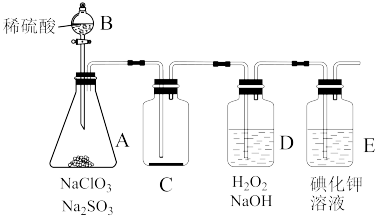
(1)仪器的B名称是___________ 。
(2)打开B的活塞,A中有ClO2生成,若制备1molClO2,理论上消耗的硫酸的物质的量为___________ ;D中吸收ClO2后生成NaClO2,写出D中所发生反应的离子方程式:___________ 。
(3)E中溶液出现黄色___________ (填“能”或“否”)说明ClO2未被 和NaOH的混合溶液充分吸收,说明理由:
和NaOH的混合溶液充分吸收,说明理由:___________ 。
(4)已知:当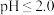 时,ClO
时,ClO 能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO
能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO 。请补充完整检验E装置溶液中存在少量ClO
。请补充完整检验E装置溶液中存在少量ClO 的实验方案:取一定体积E装置中的溶液于分液漏斗中,
的实验方案:取一定体积E装置中的溶液于分液漏斗中,___________ ,则溶液中存在ClO 。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)

(1)仪器的B名称是
(2)打开B的活塞,A中有ClO2生成,若制备1molClO2,理论上消耗的硫酸的物质的量为
(3)E中溶液出现黄色
 和NaOH的混合溶液充分吸收,说明理由:
和NaOH的混合溶液充分吸收,说明理由:(4)已知:当
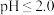 时,ClO
时,ClO 能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO
能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO 。请补充完整检验E装置溶液中存在少量ClO
。请补充完整检验E装置溶液中存在少量ClO 的实验方案:取一定体积E装置中的溶液于分液漏斗中,
的实验方案:取一定体积E装置中的溶液于分液漏斗中, 。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
您最近半年使用:0次
10 . NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
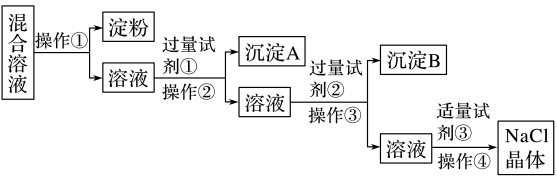
(1)写出上述实验过程中所用试剂(写化学式):试剂①_______ ;试剂③_______ 。
(2)判断试剂①已过量的方法是_______ 。
(3)用离子方程式表示加入试剂②的作用:_______ 。
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉_______ (填“能”或“不能”)透过半透膜;SO
_______ (填“能”或“不能”)透过半透膜。请用实验证明上述结果,完成下表(可不填满,也可增加)。限选试剂:1 mol·L-1 AgNO3溶液、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸

(1)写出上述实验过程中所用试剂(写化学式):试剂①
(2)判断试剂①已过量的方法是
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉

| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
您最近半年使用:0次
2021-10-18更新
|
380次组卷
|
6卷引用:2015-2016学年安徽师大附属中学高一上期中测试化学试卷
2015-2016学年安徽师大附属中学高一上期中测试化学试卷2016-2017学年广西陆川中学高一上期中化学卷【全国百强校】广东省佛山市第一中学2018-2019学年高一上学期第一次段考化学试题人教版(2019)高一必修第一册 第一章 物质及其变化 第二节 离子反应(已下线)3.3.1 粗盐提纯 从海水中提取溴(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省齐齐哈尔市龙江县第一中学2021-2022学年高一9月月考化学试题



