12-13高三上·山西·阶段练习
名校
解题方法
1 . 下列各组原子中,彼此化学性质一定相似的是
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C.2p能级上只有两个电子的X原子与3p能级上只有两个电子的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
您最近一年使用:0次
2022-08-28更新
|
759次组卷
|
67卷引用:云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题
云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题(已下线)2013届山西省山西大学附属中学高三10月月考化学试卷(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2013-2014江苏省扬州中学高二下学期阶段测试5月 化学试卷2014-2015河北省邢台市第一中学高二12月月考化学试卷2014-2015四川省达州市大竹县文星中学高二3月月考化学试卷2014-2015学年辽宁省沈阳市沈阳二中高二下期中化学试卷2014-2015学年浙江省台州中学高二下第一次统练化学试卷2014-2015学年浙江省绍兴市一中高二下学期期末化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2015-2016学年辽宁省沈阳二中高二下期中化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题河南省驻马店市2016-2017学年高二下学期期末考试化学试题宁夏石嘴山市第三中学2016-2017学年高二下学期期末(2018届高三入学)考试化学试题辽宁省实验中学分校2016-2017学年高二下学期期末考试化学试题广西钦州市钦州港经济技术开发区中学2018届高三上学期开学考试化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1宁夏六盘山高级中学2017-2018学年高二下学期第一次月考考试化学试题吉林省延边市第二中学2017-2018学年高二下学期第一次月考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题云南省玉溪市华宁二中2018-2019学年9月份考试高二化学试题云南省香格里拉县一中2018-2019学年高二上学期期中考试化学试题四川省遂宁二中2018-2019学年高二上学期半期考试化学试题【全国百强校】山东省潍坊第一中学2018-2019学年高二下学期开学(2月)考试化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题福建省罗源市第一中学2018-2019学年高二下学期3月月考化学试题湖北省宜昌市葛洲坝中学2018-2019学年高二下学期期中考试化学试题【全国百强校】贵州省思南中学2018-2019学年高二下学期期中考试化学试题【全国百强校】河南省林州市第一中学2018-2019学年高二下学期5月月考化学试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题(已下线)上海建平高级中学 2012-2013学年高三下学期模拟化学试题江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题湖北省襄阳市第一中学2019-2020学年高二5月月考化学试题辽宁省营口市部分重点高中2017-2018学年高二下学期期末考试化学试题陕西省咸阳市实验中学2019-2020学年高二上学期第一次月考化学试题河北省新乐市第一中学2018--2019学年高二下学期第二次月考化学试题河北省唐山市开滦第二中学2019-2020学年高二6月月考化学试题安徽省六安市舒城中学2019-2020学年高二下学期第一次月考化学试题河北省沧州市盐山县盐山中学2019-2020学年高二下学期期末考试化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练吉林省吉化第一高级中学校2020-2021学年高二下学期3月月考化学试题黑龙江省实验中学2020-2021学年度下学期高二学年第一次月考化学试题吉林省松原市乾安县第七中学2020-2021学年高二下学期第五次质量检测化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)甘肃省兰州市第二十七中学2020-2021学年高二下学期期末考试化学试题云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题福建省龙岩第一中学2021-2022学年高二(实验班)下学期第一次月考化学试题专题2 原子结构与元素性质 第一单元 原子核外电子的运动 第2课时 原子核外电子的排布新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题第一节 原子结构 第2课时 构造原理与电子排布式,电子云与原子轨道2019鲁科版高中化学选择性必修2第1章第2节 原子结构与元素周期表课后习题吉林省吉林第一中学2022-2023学年高二上学期11月月考化学试题湖北省十堰市普通高中协作体2022-2023学年高二下学期3月月考化学试题福建省永安市第三中学高中校2022-2023学年高三下学期第一次月考(3月)化学试题陕西省宝鸡市金台区2022-2023学年高二下学期期中质量检测化学试题2.1.2原子核外电子的排布 课中湖北省襄阳市第五中学2022-2023学年高二下学期开学考试化学试题辽宁省沈阳市第二中学2023-2024学年高二上学期第二次月考化学试题湖北省恩施高中2023-2024学年高一下学期入学考试化学试题
2 . 钛(Ti)及其化合物的应用研究是目前前沿科学之一,请回答下列问题:
(1)基态钛原子的电子排布式为_______ 。
(2) 作光催化剂可将甲醛、苯等有害气体转化为
作光催化剂可将甲醛、苯等有害气体转化为 和
和 。上述含碳原子的分子中,碳原子的杂化方式为
。上述含碳原子的分子中,碳原子的杂化方式为 的是
的是_______ (填名称)。
(3)作为过渡元素的Fe、Cu容易形成配位化合物,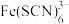 中C、N两种元素的电负性大小关系为
中C、N两种元素的电负性大小关系为_______ 。硫酸铜稀溶液中微粒间不存在的作用力有_______ (填序号)。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(4)已知Ba、Mo的氯化物沸点信息如下表所示。二者沸点差异的原因是_______ 。
(5) 分子中H-N-H的键角为107°,在
分子中H-N-H的键角为107°,在 中,H-N-H键角近似109.5°,键角变大的原因是
中,H-N-H键角近似109.5°,键角变大的原因是_______ 。
(6)贵金属磷化物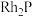 (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为
(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______  。(列出计算式即可)。
。(列出计算式即可)。

(1)基态钛原子的电子排布式为
(2)
 作光催化剂可将甲醛、苯等有害气体转化为
作光催化剂可将甲醛、苯等有害气体转化为 和
和 。上述含碳原子的分子中,碳原子的杂化方式为
。上述含碳原子的分子中,碳原子的杂化方式为 的是
的是(3)作为过渡元素的Fe、Cu容易形成配位化合物,
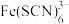 中C、N两种元素的电负性大小关系为
中C、N两种元素的电负性大小关系为A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(4)已知Ba、Mo的氯化物沸点信息如下表所示。二者沸点差异的原因是
| 氯化物 | 沸点 |
 | 1560℃ |
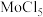 | 268℃ |
(5)
 分子中H-N-H的键角为107°,在
分子中H-N-H的键角为107°,在 中,H-N-H键角近似109.5°,键角变大的原因是
中,H-N-H键角近似109.5°,键角变大的原因是(6)贵金属磷化物
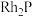 (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为
(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为 。(列出计算式即可)。
。(列出计算式即可)。
您最近一年使用:0次
11-12高二上·四川雅安·阶段练习
名校
解题方法
3 . 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
| A.X与Y形成化合物时,X显负价,Y显正价 |
| B.第一电离能Y一定小于X |
| C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| D.气态氢化物的稳定性:HnY小于HmX |
您最近一年使用:0次
2022-05-19更新
|
323次组卷
|
19卷引用:云南省富宁县三中2019-2020学年高二上学期期末考试化学试题
云南省富宁县三中2019-2020学年高二上学期期末考试化学试题(已下线)2011-2012学年四川省雅安中学高二12月月考化学试卷(已下线)2011-2012学年山西省临汾一中高二下学期期中考试化学试卷(已下线)2011-2012学年山西省忻州一中高二下学期期中考试理科化学试卷(已下线)2011-2012学年黑龙江省牡丹江一中高二下学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高二下学期期中考试化学试卷2015-2016学年安徽省六安一中高二上学期期末化学试卷云南省玉溪市华宁二中2018-2019学年9月份考试高二化学试题云南省昭通市威信县第一中学2018-2019学年高二上学期12月份考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题宁夏银川一中2020-2021学年高二下学期期末考试化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)四川省成都外国语学校2021-2022学年高二下学期3月月考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高二下学期期中考试化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)宁夏吴忠市吴忠中学2022-2023学年高二下学期期中考试化学试题
4 . 当镁原子由1s22s22p63s2跃迁到1s22s22p63p2时,以下认识正确的是
| A.镁原子由基态转化成激发态,这一过程中吸收热量 |
| B.镁原子由基态转化成激发态,这一过程中释放热量 |
| C.转化后位于p能级上的两个电子的能量没有发生任何变化 |
| D.转化后镁原子与硅原子电子层结构相同,化学性质相似 |
您最近一年使用:0次
2022-04-12更新
|
29次组卷
|
2卷引用:云南省马关县第一中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
5 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y位于元素周期表第_______ 周期第_______ 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_______ (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在_______ 个σ键。在H—Y,H—Z两种共价键中,键的极性较强的是_______ ,键长较长的是_______ 。
(3)W的基态原子核外电子排布式是_______ 。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在
(3)W的基态原子核外电子排布式是
您最近一年使用:0次
2022-04-06更新
|
84次组卷
|
2卷引用:云南省马关县第一中学2021-2022学年高二下学期2月份考试化学试题
名校
6 . 下列性质的比较,不正确的是
A.酸性: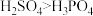 | B.电负性: |
C.热稳定性: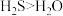 | D.第一电离能: |
您最近一年使用:0次
2022-04-01更新
|
497次组卷
|
7卷引用:云南省文山州广南县第十中学校2023-2024学年高二下学期3月考试化学试题
名校
解题方法
7 . 现有A、B、C、D四种元素,A是第五周期第ⅠA族元素,B是第三周期元素。B、C、D的最外层电子分别为2、2和7个。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子均为18个。
(1)写出A、B、C、D的元素符号A:_______ B:_______ C:_______ D:_______ 。
(2)写出B原子的电子排布式:_______ ;A、C、D的价电子排布式A:_______ C:_______ D:_______ 。
(3)写出碱性最强的最高价氧化物的水化物的化学式:_______ 。
(4)写出酸性最强的最高价氧化物的水化物的化学式:_______ 。
(1)写出A、B、C、D的元素符号A:
(2)写出B原子的电子排布式:
(3)写出碱性最强的最高价氧化物的水化物的化学式:
(4)写出酸性最强的最高价氧化物的水化物的化学式:
您最近一年使用:0次
2022-03-31更新
|
96次组卷
|
4卷引用:云南省马关县第一中学2021-2022学年高二下学期开学考试化学试题
名校
8 . 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
则A的化合价___________ B的化合价(填“>”、“<”或“=”)。
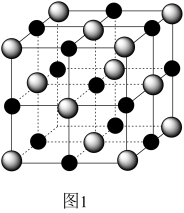
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:___________ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________ 。
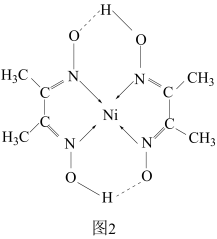
(4)某配合物的分子结构如图2所示,则N原子的杂化方式为___________ ;基态Ni原子的电子排布式___________ 。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/ kJ/mol | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(4)某配合物的分子结构如图2所示,则N原子的杂化方式为

您最近一年使用:0次
名校
解题方法
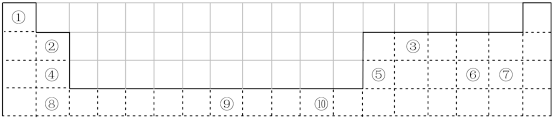
9 . 下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是___________ (填编号)。
(2)写出元素⑨的基态原子的电子排布式:___________ 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为___________ 对。
(4)写出p区中最高价氧化物对应的水化物酸性最强元素原子的价电子排布图为___________ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)写出元素⑨的基态原子的电子排布式:
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为
(4)写出p区中最高价氧化物对应的水化物酸性最强元素原子的价电子排布图为
您最近一年使用:0次
11-12高二上·四川雅安·期中
名校
解题方法
10 . 对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是
| A.原子核外电子排布式:M为1s22s2,N为1s2 |
B.结构示意图:M为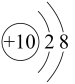 ,N为 ,N为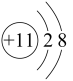 |
| C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子 |
| D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子 |
您最近一年使用:0次
2022-03-30更新
|
1419次组卷
|
42卷引用:云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题
云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题(已下线)2011-2012学年四川省雅安中学高二上学期期中考试化学试卷(已下线)2014届新疆乌鲁木齐市兵团二中高二(上)期末化学试卷2014-2015福建省宁德市五校教学联合体高二下学期期中化学试卷2015-2016学年四川省成都市新都一中高二下4月月考化学试卷2015-2016学年陕西省宝鸡市岐山县高二下期末文科化学试卷2015-2016学年福建省宁德市高二下期末化学试卷2015-2016学年陕西省宝鸡市岐山县高二下期末(结构)化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷河南省信阳市2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第1课时河北省唐山一中2017-2018学年高二下学期期中考试化学试题人教版2017-2018学年高一化学必修2:第一章 第二节 难度偏大尖子生题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题广西蒙山县第一中学2017-2018学年高二下学期期末考试化学试题2019年秋高三化学复习强化练习——化学用语河南省驻马店市正阳县第二高级中学2019-2020学年高二上学期12月月考化学试题河北省正定中学2019-2020学年高二3月线上月考化学试题天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题湖北省武汉市武昌区水果湖高中 2019-2020 学年高二下学期期中考试化学试题新疆吐蕃市高昌区第二中学2019-2020学年高二下学期期末考试化学试题河北省邢台市2019-2020学年高二下学期期末考试化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)河南省汤阴县五一中学2019-2020学年高二下学期期中考试化学试题四川省成都市新津中学高2020-2021学年高二下学期4月月考试题福建省宁德市高中同心顺联盟校2020-2021学年高二下学期期中考试化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)1.2.1 原子结构与元素周期表(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)河北省武安市第三中学2021-2022学年高二上学期第二次月考化学试题陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题第一章原子结构与性质(提升卷)河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题广东省湛江市第二中学2021-2022学年高二下学期第11周(4.30)周练化学试题四川省宜宾市兴文第二中学校2023-2024学年高二下学期开学化学试题



