名校
1 . 下列关于原子核外电子排布与元素在周期表中位置关系的表述正确的是
| A.原子的价电子排布式为ns2np1~6的元素一定是主族元素 |
| B.基态原子的p能级上有5个电子的元素一定是第ⅦA族元素 |
| C.原子的价电子排布式为(n-1)d6~8ns2的元素一定位于第ⅢB~第ⅧB族 |
| D.基态原子的N层上只有1个电子的元素一定是主族元素 |
您最近一年使用:0次
2022-03-03更新
|
1668次组卷
|
27卷引用:云南省马关县第一中学2021-2022学年高二下学期开学考试化学试题
云南省马关县第一中学2021-2022学年高二下学期开学考试化学试题2015-2016学年贵州省思南中学高二下第一次月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷贵州省思南中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题人教化学选修3第一章第二节课时4第1章 原子结构——B拓展区综合拓展(鲁科版选修3)山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时1 原子结构与元素周期表(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)河北省唐山市曹妃甸区第一中学2020-2021学年高二下学期6月月考化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)河北省邢台市第一中学2021-2022学年高二上学期第四次月考化学试题云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题福建省厦门市第一中学2021-2022学年高二下学期3月适应性练习化学试题黑龙江省哈尔滨市第三中学校2021-2022学年高二下学期第一次验收考试化学试题四川省泸州市泸县第一中学2021-2022学年高二下学期期中考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)(已下线)【知识图鉴】单元讲练测选择性必修2第1章01讲核心福建省厦门第二中学2022-2023学年高二下学期4月月考化学试题四川省射洪中学校2022-2023学年高二上学期11月期中考试化学试题河北省石家庄二中润德2023-2024学年高二上学期12月月考化学试题(已下线)热点02 原子结构与元素的性质安徽省黄山市屯溪第一中学2023-2024学年高二下学期期中测试化学试卷
2016高二·全国·课时练习
名校
2 . 下列关于杂化轨道的叙述正确的是
| A.杂化轨道可用于形成σ键,也可用于形成π键 |
| B.杂化轨道可用来容纳未参与成键的孤电子对 |
| C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的1个s轨道杂化而成的 |
| D.在乙烯分子中1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—Hσ键 |
您最近一年使用:0次
2021-12-25更新
|
638次组卷
|
13卷引用:云南省丘北二中2018-2019学年高二下学期期末考试化学试题
云南省丘北二中2018-2019学年高二下学期期末考试化学试题(已下线)同步君 选修3 第二章 第二节 杂化轨道理论高中化学人教版 选修三 第2章 分子结构与性质 杂化轨道理论四川省宜宾市叙州区第一中学校2019-2020学年高二下学期期中考试化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期中考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题山西省忻州市岢岚县中学2020-2021学年高二下学期4月月考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题(已下线)2.2 分子空间结构-同步学习必备知识2.2.1分子空间结构的理论分析(课前)-鲁科版选择性必修2
3 . 下列表示方法错误的是
A.硫离子的电子式为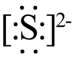 |
| B.Br原子的简化电子排布式为[Ar]3d104s14p6 |
C.N原子的电子排布图为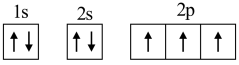 |
D.Cu的原子结构示意图为 |
您最近一年使用:0次
2021-12-10更新
|
444次组卷
|
5卷引用:云南省文山州第一中学2021-2022学年高二下学期3月份考试化学试题
名校
解题方法
4 . 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
(1)写出B原子的电子排布式___________ 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点___________ (填“高”或“低”),其原因是___________ 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点___________ (填“高”或“低”),其原因___________ 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为___________ ,简要描述该配合物中化学键的成键情况___________ 。
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
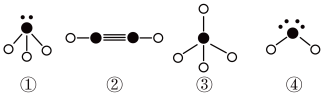
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________ (填写序号);在②的分子中有___________ 个σ键和___________ 个π键。
| 元素 | A | B | C | D |
| 性质结构信息 | 原子核外两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为
(5)下列分子结构图中的“
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是
您最近一年使用:0次
名校
5 . X、Y、Z、Q四种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最多的元素,Q的核电荷数是X与Z的核电荷数之和。请回答下列问题。
(1)X、Y的元素符号依次为___________ 、___________ 。
(2)XZ2与YZ2分别属于___________ (填“极性分子”或“非极性分子”,下同)和___________ 。
(3)Q的元素符号是___________ ,它位于第___________ 周期,它的基态原子的核外电子排布式为___________ ,在形成化合物时它的最高化合价为___________ 。
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分别属于
(3)Q的元素符号是
您最近一年使用:0次
2021-07-09更新
|
87次组卷
|
3卷引用:云南省文山州第一中学2021-2022学年高二下学期3月份考试化学试题
6 . 根据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料等,合成维生素E及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为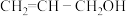 。请回答下列问题:
。请回答下列问题:
(1) 与
与 处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式:
处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式:_______ ;金属镍能与 形成配合物
形成配合物 ,写出与
,写出与 互为等电子体的一种分子或一种离子的化学式:
互为等电子体的一种分子或一种离子的化学式:_______ 。
(2)
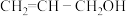 中
中 键和
键和 键的个数比为
键的个数比为_______ ,丙烯醇分子中碳原子的杂化类型为_______ 。
(3)丙醛(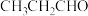 )的沸点为49℃,丙烯醇(
)的沸点为49℃,丙烯醇( )的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是
)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______ 。
(4)羧基镍[ ]用于制备高纯度镍粉,它的熔点为
]用于制备高纯度镍粉,它的熔点为 ℃,沸点为43℃。羧基镍的晶体类型是
℃,沸点为43℃。羧基镍的晶体类型是_______ 。
(5) 与
与 处于同一周期,且核外最外层电子构型相同,但金属
处于同一周期,且核外最外层电子构型相同,但金属 的熔点和沸点都比金属
的熔点和沸点都比金属 高,原因为
高,原因为_______ 。区分晶体 和非晶体
和非晶体 的最可靠的科学方法为
的最可靠的科学方法为_______ 。
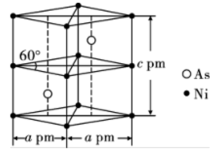
(6)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为 ,该晶体的密度
,该晶体的密度
_______  。
。
 。请回答下列问题:
。请回答下列问题:(1)
 与
与 处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式:
处于同一周期,且核外最外层电子构型相同,请写出基态钙原子的电子排布式: 形成配合物
形成配合物 ,写出与
,写出与 互为等电子体的一种分子或一种离子的化学式:
互为等电子体的一种分子或一种离子的化学式:(2)

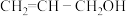 中
中 键和
键和 键的个数比为
键的个数比为(3)丙醛(
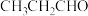 )的沸点为49℃,丙烯醇(
)的沸点为49℃,丙烯醇( )的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是
)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是(4)羧基镍[
 ]用于制备高纯度镍粉,它的熔点为
]用于制备高纯度镍粉,它的熔点为 ℃,沸点为43℃。羧基镍的晶体类型是
℃,沸点为43℃。羧基镍的晶体类型是(5)
 与
与 处于同一周期,且核外最外层电子构型相同,但金属
处于同一周期,且核外最外层电子构型相同,但金属 的熔点和沸点都比金属
的熔点和沸点都比金属 高,原因为
高,原因为 和非晶体
和非晶体 的最可靠的科学方法为
的最可靠的科学方法为(6)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为
 ,该晶体的密度
,该晶体的密度
 。
。
您最近一年使用:0次
7 . 已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是
A.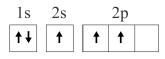 | B.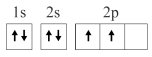 |
C.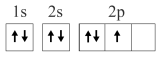 | D. |
您最近一年使用:0次
2021-05-28更新
|
1609次组卷
|
30卷引用:云南省广南县第三中学校2019-2020学年高二上学期期末考试化学试题
云南省广南县第三中学校2019-2020学年高二上学期期末考试化学试题(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷2015-2016学年湖北省黄冈市高二下期末化学试卷2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题2020届高三化学二轮物质结构题型专攻—— 基态原子核外电子排布【选择基础专练】人教化学选修3第一章第一节课时3河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题吉林省长春市第一中学2019-2020学年高二下学期阶段测试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第一次月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题吉林省通化县综合高级中学2019-2020学年高二下学期期末考试化学试题河北省石家庄市第十五中学2020-2021学年高二第二学期4月月考化学试题(已下线)作业01 原子结构-2021年高二化学暑假作业(人教版2019)(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)河南省新乡市河南师范大学附属中学2021-2022学年高二下学期3月月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期期中考试化学试题内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题甘肃省高台县第一中学2021-2022学年高二下学期6月月考化学试题专题2 原子结构与元素性质 本专题复习提升四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题1.1.3 泡利原理、洪特规则、能量最低原理-随堂练习
名校
解题方法
8 . 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核只有一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是_______ (填元素符号),第一电离能最小的是_______ (填元素符号)。
(2)C所在的主族元素气态氢化物中,沸点最低的是_______ (填化学式)。
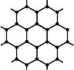
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为_______ 。
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_______ (填选项序号)。
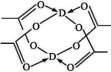
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下:
D单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀
已知D的硫化物为黑色难溶性物质,请书写第⑤反应的离子方程式:_______ 。
(1)这四种元素中电负性最大的是
(2)C所在的主族元素气态氢化物中,沸点最低的是
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为

(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下:
D单质
 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀已知D的硫化物为黑色难溶性物质,请书写第⑤反应的离子方程式:
您最近一年使用:0次
2021-03-09更新
|
295次组卷
|
5卷引用:云南省文山州广南县第二中学2020届高三上学期9月份考试化学试题
云南省文山州广南县第二中学2020届高三上学期9月份考试化学试题云南省玉溪市通海三中2019届高三一轮复习摸底考试化学试题山东省济南市高新区新2019-2020学年高三化学一轮复习《物质结构与性质》专题测试(已下线)模块同步卷08 分子晶体与原子晶体-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)云南省玉溪第三中学2021-2022学年高三上学期期末考试化学试题
9 . 下列各组指定的元素,不能形成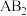 型化合物的是
型化合物的是
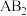 型化合物的是
型化合物的是A.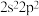 和 和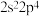 | B.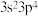 和 和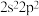 |
C. 和 和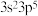 | D.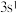 和 和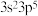 |
您最近一年使用:0次
2021-02-15更新
|
228次组卷
|
22卷引用:云南省广南二中2018-2019学年高二6月考试化学试题
云南省广南二中2018-2019学年高二6月考试化学试题(已下线)2012-2013学年吉林省汪清六中高二下学期第一次月考化学试卷(已下线)2013-2014广西桂林十八中高二下学期开学考试化学试卷2015-2016学年四川省雅安市天全中学高二9月月考化学试卷安徽省安庆市五校联盟2017-2018学年高二上学期期中联考化学试题内蒙古包头市第四中学2017-2018学年高二上学期期末考试化学试题贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题天津市西青区2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题宁夏回族自治区银川市宁夏大学附属中学2020-2021学年高二上学期第一次月考化学试题新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第1课时 基态原子的核外电子排布云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题陕西省西安市阎良区关山中学2021-2022学年高二下学期期末质量检测化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题1.2.1基态原子的核外电子排布(课后)-鲁科版选择性必修2
10 . 硒(34Se)是人体必需的微量元素,能有效提高人体免疫机能,预防癌症和心脑血管等疾病。下列有关硒元素的说法中不正确的是
| A.Se元素处于元素周期表中的第15列 |
| B.Se原子的价电子排布为4s24p4 |
| C.Se元素处于元素周期表中的p区 |
| D.基态Se原子的核外电子排布中共有8个能级 |
您最近一年使用:0次
2021-01-29更新
|
325次组卷
|
6卷引用:云南省文山州广南县第十中学校2023-2024学年高二下学期3月考试化学试题



