1 . 下列说法中正确的是
| A.[Ne]3s2表示的是Mg原子 |
| B.3p2表示第三电子层有2个电子 |
| C.同一原子中,1s、2s、3s电子的能量逐渐减小 |
| D.2p、3p、4p轨道容纳的最多电子数依次增多 |
您最近一年使用:0次
2020-11-18更新
|
482次组卷
|
13卷引用:云南省河口县一中2018-2019学年高二上学期期中考试化学试题
云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省新平县一中2020-2021学年高二下学期期中考试化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题江苏省盐城市响水中学2020-2021学年高二上学期期中考试化学(选修)试题安徽省白泽湖中学2020-2021学年高二下学期期中考试化学试题江苏省徐州市第一中学2019-2020学年高二下学期第一次月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考(实验班)化学试题(已下线)练习11 原子结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷(已下线)1.1 原子结构(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)福建省福州市福清西山学校2020-2021学年高二下学期3月月考化学试题(已下线)1.1.2 构造原理与电子排布式(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)四川省成都外国语学校2022-2023学年高二下学期3月月考化学试题
9-10高二下·江苏泰州·期末
名校
解题方法
2 . 对Na、Mg、Al的有关性质的叙述正确的是:
| A.碱性:NaOH< Mg(OH)2< Al(OH)3 | B.第一电离能:Na< Mg <Al |
| C.还原性:Na> Mg >Al | D.电负性:Na> Mg >Al |
您最近一年使用:0次
2020-11-12更新
|
574次组卷
|
63卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题河南省宏力学校2018-2019学年高二下学期期中考试化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016学年吉林梅河口五中高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题福建省福州三中2017-2018学年高二上学期期末考试化学试题山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题
3 . 关于电子云的叙述不正确的是( )
| A.电子云是用小点的疏密程度来表示电子在空间出现概率大小的图形 |
| B.电子云实际是电子运动形成的类似云一样的图形 |
| C.小点密集的地方电子在那里出现的概率大 |
| D.轨道不同,电子云的形态或伸展方向也不一样 |
您最近一年使用:0次
2020-10-23更新
|
309次组卷
|
4卷引用:云南省泸水五中2018-2019学年高二上学期期中考试化学试题
名校
4 . 下列有关物质结构和性质变化规律正确的是( )
| A.酸性:HF>HCl>HBr |
| B.碱性:KOH>Ca(OH)2>Mg(OH)2 |
| C.沸点:H2O>H2S>H2Se |
| D.第一电离能:Al>Mg>Na |
您最近一年使用:0次
2020-09-06更新
|
205次组卷
|
2卷引用:云南省泸西县第一中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
5 . 下列关于原子核外电子排布与元素在周期表中位置关系的叙述正确的是( )
| A.基态原子核外N电子层上只有一个电子的元素一定是第ⅠA族元素 |
| B.原子核外价电子排布式为(n-1)d6~8ns2的元素一定是副族元素 |
| C.基态原子的p能级上半充满的元素一定位于p区 |
| D.基态原子核外价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y |
您最近一年使用:0次
2020-05-20更新
|
496次组卷
|
25卷引用:云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题
云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题辽宁省协作校2019-2020学年高二下学期期中考试模拟卷化学试题福建省三明第一中学2019-2020学年高二下学期期中考试化学试题福建省永泰县第一中学2020-2021学年高二下学期期中考试化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题2015-2016学年四川省南充市高二上学期期末考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年河北省正定中学高二下第一次月考化学试卷2016-2017学年福建省三明市第一中学高二下学期第一次月考化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第1课时贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题四川省南充市白塔中学2019-2020学年高二12月月考化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题人教化学选修3第一章第二节课时1河南省林州市第一中学2019-2020学年高二3月线上调研考试(实验班)化学试题山东省泰安市肥城市泰西中学2019-2020学年高二下学期5月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第2课时 核外电子排布与元素周期表河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题河南省南阳市六校2021-2022学年高二下学期第一次联考化学试题(B)四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第三次月考化学试题1.2.2核外电子排布与元素周期表(课后)-鲁科版选择性必修2黑龙江省绥化市绥棱县第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
6 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
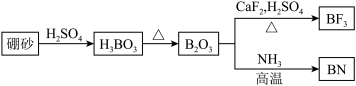
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________ 、________________________ ;
(2)基态B原子的电子排布式为________ ;B和N相比,电负性较大的是________ ,BN中B元素的化合价为________ ;
(3)在BF3分子中,F—B—F的键角是________ ,B原子的杂化轨道类型为________ ,BF3和过量NaF作用可生成NaBF4, 的立体构型为________ ;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为__________ ,层间作用力为________________________ ;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________ 个氮原子、________ 个硼原子,立方氮化硼的密度是________ g·cm-3 (只要求列算式,不必计算出数值,阿伏加 德罗常数为NA)。

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F—B—F的键角是
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有
您最近一年使用:0次
2020-04-16更新
|
68次组卷
|
2卷引用:云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题
7 . 以下有关元素性质的说法不正确的是
| A.具有下列电子排布式的原子中:①1s22s22p63s23p2、②1s22s22p3、③1s22s22p2、④1s22s22p63s23p4, 原子半径最大的是① |
| B.具有下列价电子排布式的原子:①3s23p1、②3s23p2、③3s23p3、④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb、②O、S、Se、③Na、P、Cl 中,元素的电负性随原子序数增大而递增的是③ |
| D.某元素气态基态原子的逐级电离能(单位:kJ·mol-1)分别为 738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是 X3+ |
您最近一年使用:0次
2020-04-12更新
|
261次组卷
|
5卷引用:云南省下关第一中学2022-2023学年高二下学期5月期中考试化学试题
云南省下关第一中学2022-2023学年高二下学期5月期中考试化学试题辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题山西省潞城第一中学2020-2021学年高二下学期3月月考化学试卷题河南省安阳市汤阴县第一中学2019-2020学年高二下学期4月月考化学试卷(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
8 . 下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
| 元素 | A | B | C | D | E |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| A.C、D、E的简单氢化物的稳定性:C>D>E |
| B.元素A的原子最外层中无自旋状态相同的电子 |
| C.元素B、C之间不可能形成化合物 |
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与 发生置换反应 发生置换反应 |
您最近一年使用:0次
2020-04-09更新
|
782次组卷
|
25卷引用:云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
云南省大理州实验中学2021-2022学年高二下学期化学期中考试题云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题2016-2017学年安徽省六安市第一中学高二下学期第一次阶段检测化学试卷宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期期末考试化学试题人教化学选修3第一章第二节课时4人教化学选修3第一章第二节课时5天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题第1章 原子结构——B拓展区综合拓展(鲁科版选修3)山东省济南市章丘区第四中学2019-2020学年高二下学期第六次教学质量检测化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)鲁科版2019选择性必修2第1章 原子结构与元素性质 微项目 甲醛的危害与去除——利用电负性分析与预测物质性质(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题河北省衡水市武强中学2020-2021学年高二下学期第一次月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题辽宁省沈阳市重点高中联合体2021-2022学年高二12月考试化学试题(已下线)1.2.3 元素的电负性及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.2.2 原子结构与元素周期律(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)重庆市育才中学2021-2022学年上学期高二上学期第六次定时练习化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题
11-12高二上·四川·期中
名校
9 . 下列各组元素属于P区的是( )
| A.原子序数为1、2、7的元素 | B. 、 、 、Cl 、Cl |
| C.O、S、P | D.Na、Li、Mg |
您最近一年使用:0次
2020-04-08更新
|
409次组卷
|
32卷引用:云南省新平县三中2019-2020学年高二上学期期中考试化学试题
云南省新平县三中2019-2020学年高二上学期期中考试化学试题(已下线)2011-2012学年四川省树德协进中学高二上学期期中考试化学试卷云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题云南省昭通市巧家县第四中学2019-2020学年高二上学期期末考试化学试题山东省济宁市嘉祥一中2019-2020学年高二下学期期中模块测试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题(已下线)2011-2012学年四川省雅安中学高二12月月考化学试卷(已下线)2011-2012学年四川省成都市铁路中学高二10月检测化学试卷(已下线)2012年苏教版高中化学选修3 2.2元素性质的递变规律练习卷(已下线)2012-2013福建省仙游二中高二下学期第一次月考化学试卷(已下线)2013-2014河北正定中学第二学期第一次月考高二化学试卷2015-2016学年吉林省汪清六中高二3月月考化学试卷高中化学人教版 选修三 第1章 原子结构与性质 原子结构与元素周期表河北省唐山市开滦第二中学2017-2018学年高二4月月考化学试题广西蒙山县第一中学2017-2018学年高二下学期期末考试化学试题河北省秦皇岛市卢龙中学2018-2019学年高二下学期期末考试化学试题内蒙古包头市第四中学2018-2019学年高二下学期第一次月考(3月)化学试题人教化学选修3第一章第二节课时1河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题河北省宣化区第一中学2019-2020学年高二4月月考化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷宁夏育才中学2019-2020学年高二下学期开学检测化学试题吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题河南省驻马店市正阳县高级中学2019-2020高二下学期第一次素质检测化学试题海南省三亚华侨学校2019-2020学年高二上学期期末考试化学试题广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第2课时 核外电子排布与元素周期表(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)新疆乌苏市第一中学2021-2022学年高二下学期3月月考化学试题(平行班)福建省仙游第一中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
10 . 第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如下图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):
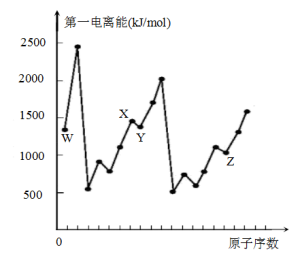
(1)基态Y原子核外共有___ 种运动状态不相同的电子。若用n表示能层,则与Y元素同族的元素的基态原子的价电子排布式为_________________ 。
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________ 。该化合物常温下呈液态,其沸点高于Y2沸点的原因为___________ 。
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________ 。
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在_____________ (填序号)。
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
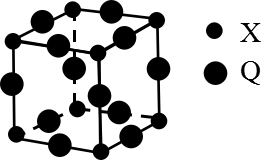
①Q原子周围距其距离最近的Q原子的数目为_______ 。
②该二元化合物的化学式为___________________ 。
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________ (用含π的式子表示)。

(1)基态Y原子核外共有
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:

①Q原子周围距其距离最近的Q原子的数目为
②该二元化合物的化学式为
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为
您最近一年使用:0次
2020-03-30更新
|
441次组卷
|
4卷引用:云南省玉溪第一中学2021届高三上学期期中考试化学试题



