名校
解题方法
1 . 完成下列问题
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第_______ 周期第_______ 族。
②基态C原子核外电子排布式为_______ ;基态N原子核外有_______ 种运动状态的电子。
③基态Si原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
④Mg、Al 两种元素中第一电离能较大的是_______ (填元素符号),原因为_______ 。
(2)几种元素的电负性数据如下表:
①AlF3的熔点_______ AlBr3的熔点(填“大于”、“小于”或“等于”),原因是_______ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_______ 。
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为_______ 。
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第
②基态C原子核外电子排布式为
③基态Si原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al 两种元素中第一电离能较大的是
(2)几种元素的电负性数据如下表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为
您最近一年使用:0次
解题方法
2 . 核酸检测样品盛放在含有胍盐的标本保存液中,胍盐可以灭活病毒,有效保存多种病毒核酸。胍的结构简式如图,分子构型为平面型,有关说法正确的是
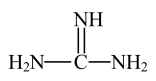
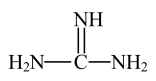
A.胍是含氮有机物,所含元素的电负性大小顺序为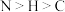 |
| B.胍分子中C原子和3个N原子的杂化方式相同 |
C.晶体易吸收空气中 生成碳酸盐 生成碳酸盐 |
| D.胍分子中两个单键N原子与C原子形成的N−C−N键角大于120° |
您最近一年使用:0次
3 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为_______ 。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为_______ 。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是_______ 。
②比较Mg、Ca第一电离能的大小:_______ 。
③图表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
结合数据说明Mg的常见化合价为+2价的原因:_______ 。
(3)我国科研人员研制出了“Fe-LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为_______ 。
②比较Li+与H-的半径大小关系:r(Li+)_______ r(H-)(填“>”或“<”)。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较Mg、Ca第一电离能的大小:
③图表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
| 元素 | Na | Mg | Al |
| 电离能(kJ/mol) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
(3)我国科研人员研制出了“Fe-LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为
②比较Li+与H-的半径大小关系:r(Li+)
您最近一年使用:0次
2022-10-04更新
|
180次组卷
|
2卷引用:河北省沧州市东光县等3地河北省盐山中学等2校2022-2023学年高二下学期3月月考化学试题
4 . 化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、X、W、Z、Y为原子序数依次递增的短周期主族元素,Q、X、Z分别位于三个不同周期。下列说法错误的是
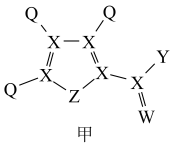

| A.简单离子半径:W<Y<Z | B.元素电负性:Q<Z<W |
| C.元素最高价氧化物对应水化物的酸性:Y>Z | D.化合物甲中所有原子均满足8电子稳定结构 |
您最近一年使用:0次
名校
解题方法
5 . 核酸检测样品盛放在含有胍盐的标本保存液中,胍盐可以灭活病毒,有效保存多种病毒核酸。 胍的结构简式如图所示,下列有关说法正确的是

A.胍是有机物,所含元素的电负性大小顺序为 |
| B.胍分子中C原子和3个N原子的杂化方式相同 |
C.胍晶体易吸收空气中的水分子和 ,均和氢键有关 ,均和氢键有关 |
D.胍分子中两个单键N原子与C原子形成的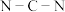 键角小于 键角小于 |
您最近一年使用:0次
2023-05-05更新
|
142次组卷
|
4卷引用:河北省2023届高三年级大数据应用调研联合测评(Ⅲ)化学试题
名校
解题方法
6 . 某有机物在合成中具有重要作用,其分子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、X原子序数之和等于Y的原子序数,Z、Q原子价电子数相同。下列说法错误 的是
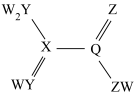

| A.X、Y、Z元素的氢化物沸点最高的是Z |
| B.Y、Z、Q元素电负性最大的是Z |
| C.Q的最高价氧化物是酸性氧化物 |
| D.该有机物既有酸性又有碱性 |
您最近一年使用:0次
名校
解题方法
7 . 前20号不同主族元素 的原子序数依次增大,它们的原子序数之和等于35,分析试剂
的原子序数依次增大,它们的原子序数之和等于35,分析试剂 常用于稀土金属分离的载体、陶瓷上釉等。加热
常用于稀土金属分离的载体、陶瓷上釉等。加热 固体
固体 ,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是
,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是

 的原子序数依次增大,它们的原子序数之和等于35,分析试剂
的原子序数依次增大,它们的原子序数之和等于35,分析试剂 常用于稀土金属分离的载体、陶瓷上釉等。加热
常用于稀土金属分离的载体、陶瓷上釉等。加热 固体
固体 ,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是
,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是
A.电负性: | B.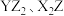 都是直线形分子 都是直线形分子 |
C. 段失去 段失去 分子 分子 | D. 生成的固体化合物为 生成的固体化合物为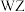 |
您最近一年使用:0次
2024-02-13更新
|
118次组卷
|
3卷引用:河北省沧州市泊头市部分学校2023-2024学年高三上学期12月月考化学试题
解题方法
8 . W、X、Y、Z为原子序数依次增大的四种元素, 和
和 具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号),其中Y原子的核外电子排布式为___________ 。
(2)单质 和
和 互为同素异形体,其中沸点较高的是
互为同素异形体,其中沸点较高的是___________ (填分子式),原因是___________ 。W和X的氢化物所属的晶体类型分别为___________ 和___________ 。
(3)W和Z形成的一种化合物的晶体结构如图,该化合物中Z元素的化合价为___________ 。
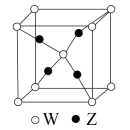
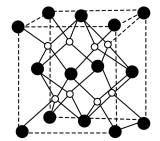
(4)W和X能够形成化合物F,其晶胞结构如图所示,晶胞参数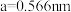 ,F的化学式为
,F的化学式为___________ ;晶胞中W离子的配位数为___________ ;晶体F的密度为___________  (
( 表示阿伏加德罗常数的值,列出表达式)。
表示阿伏加德罗常数的值,列出表达式)。
 和
和 具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:
具有相同的电子层结构;Y的原子核外电子总数是最外层电子数的3倍;Z元素的原子M层电子全排满,3d轨道电子数比s轨道电子总数多3。回答下列问题:(1)四种元素中电负性最大的是
(2)单质
 和
和 互为同素异形体,其中沸点较高的是
互为同素异形体,其中沸点较高的是(3)W和Z形成的一种化合物的晶体结构如图,该化合物中Z元素的化合价为

(4)W和X能够形成化合物F,其晶胞结构如图所示,晶胞参数
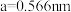 ,F的化学式为
,F的化学式为 (
( 表示阿伏加德罗常数的值,列出表达式)。
表示阿伏加德罗常数的值,列出表达式)。
您最近一年使用:0次
2022-06-30更新
|
119次组卷
|
3卷引用:河北省沧州市2021-2022学年高二下学期期末考试化学试题
解题方法
9 . 下列各组性质的比较中,正确的是
| A.沸点:Li<Na<<K | B.熔点:金刚石>晶体硅>碳化硅 |
| C.第一电离能:S<P<Cl | D.元素的电负性:N>O>F |
您最近一年使用:0次
名校
10 . H5O2Ge(BH4)3是钙钛矿型(ABX3型)化合物,量子化学计算结果显示,其具有良好的光电化学性能。设NA为阿伏加德罗常数的值,下列说法错误的是
A.BH 的空间结构是正四面体 的空间结构是正四面体 |
| B.基态O原子的电子排布式为[Ne]2s22p4 |
| C.组成该化合物的元素的电负性:Ge<B<H<O |
| D.基态Ge原子有32种不同运动状态的电子 |
您最近一年使用:0次
2022-05-26更新
|
107次组卷
|
2卷引用:河北省沧州市任丘第一中学2021-2022学年高二下学期阶段考试(二)化学试题



