解题方法
1 . 聚乙二醇(PEG)有良好的生物相容性,在水中可与 形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是
形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是

 形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是
形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是
A.PEG中 和 和 的杂化方式相同 的杂化方式相同 | B. 的VSEPR模型为四面体形 的VSEPR模型为四面体形 |
C.键角: | D.电负性: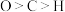 |
您最近一年使用:0次
名校
解题方法
2 . 离子液体M的结构如图所示,下列说法错误的是
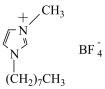

| A.电负性由大到小的顺序是F>N>B |
| B.阴离子的空间结构为正四面体形 |
| C.M因含有机基团而使其熔点较低 |
| D.M分子中C-C键的键能大于C-N键的键能 |
您最近一年使用:0次
解题方法
3 . 铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____ 区,其基态原子的价电子排布图为_________ 。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________ 。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为______ ,提供孤电子对的成键原子是_________ 。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________ 。
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为_________ 。但NF3不易与Cu2+形成化学键,其原因是_______________ 。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
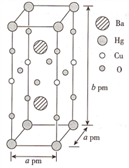
①该物质的化学式为__________ 。
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为_____ 个,二者的最短距离为_______ pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为______ g·cm-3。
(1)铜元素位于元素周期表中的
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
2017-12-27更新
|
353次组卷
|
4卷引用:河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题
河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题2020高考化学二轮总复习高分必备 题型专题2 非选择题专练(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)2021年高考化学押题预测卷(湖南卷)(01)(含考试版、答题卡、参考答案、全解全析)
名校
解题方法
4 . 镓与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____ ,基态As原子核外有_________ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓____ (填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_________ 。
GaF3的熔点超过1000℃,可能的原因是______ 。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为___ ,草酸根中碳原子的杂化方式为____ 。
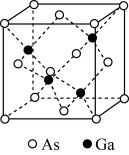

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_____ ,晶体的密度为____ (设NA为阿伏加 德罗常数的数值,列出算式即可)g·cm−3。
(1)基态Ga原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为


(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为
您最近一年使用:0次
2020-08-15更新
|
87次组卷
|
10卷引用:河北省沧州市泊头市第一中学2020届高三上学期第四次月考化学试题
河北省沧州市泊头市第一中学2020届高三上学期第四次月考化学试题河北省邢台市2018届高三上学期期末考试理综化学试题湖南省邵阳市2018届高三上学期期末考试理综化学试题山东省济南市章丘区2018届高三3月模拟联考理综化学试题山西省六校(长治二中,晋城一中、康杰中学、临汾一中等)2018届高三第四次名校联合考试(百日冲刺)理综化学试题四川省泸县第四中学2019届高三二诊模拟理综-化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二下学期第一次月考化学试题河北省藁城市第一中学2019届高三下学期4月月考化学试题湖南省湘潭一中、双峰一中,邵东一中2019-2020学年高二下学期联考化学试题高二选择性必修2(人教版2019)全书综合训练
名校
解题方法
5 . 脱羧反应是有机化学中的正要反应,如图为制备氰化物的脱羧反应。下列说法正确的是
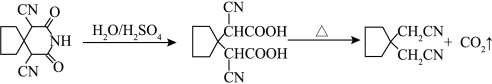
| A.电负性:S>O>N>C>H |
B. 分子的空间填充模型为 分子的空间填充模型为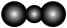 |
C.化合物 分子中碳原子有2种杂化方式 分子中碳原子有2种杂化方式 |
D.化合物 分子中有2个手性碳原子 分子中有2个手性碳原子 |
您最近一年使用:0次
名校
解题方法
6 . 科学家研发出一种新型储氢材料,晶胞结构如下图所示,晶胞参数为apm,下列说法正确的是
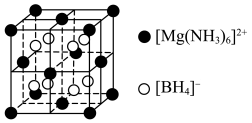
| A.所含非金属元素的电负性N>B>H |
B.该晶体的化学式为 |
C.阴、阳离子的最小距离为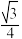 apm apm |
| D.若晶胞以[BH4]-为顶点,所得晶胞结构与NaCl晶胞相同 |
您最近一年使用:0次
名校
解题方法
7 . 锂电池中某阻燃剂的结构式如图所示,其中Y、Z、Q、W是原子序数依次增大的短周期主族元素,基态W原子核外能量不同的电子有3种,下列说法正确的是
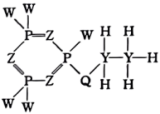
A.电负性: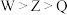 | B.基态原子未成对电子数: |
C.原子半径: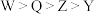 | D.该化合物中各原子的最外层均满足8电子稳定结构 |
您最近一年使用:0次
名校
解题方法
8 . 黑火药的主要成分为木炭(C)、硫黄(S)和火硝 。请回答下列问题。
。请回答下列问题。
(1)基态碳原子的电子排布式为_______ 。
(2)下列轨道表示式能表示基态氮原子的核外电子排布的是_______(填标号)。
(3)C、N、O三种元素的第一电离能由大到小的顺序为_______ 。
(4)Se元素位于第4周期,与O、S同主族。
①基态Se原子中具有_______ 种运动状态不同的电子。其中能量最高的电子占据轨道的形状为_______ 。
②O、S、Se三种元素的电负性依次_______ (填“增大”或“减小”)。
(5)用铂丝蘸取 溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,从微观角度解释产生该现象的原因是
溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,从微观角度解释产生该现象的原因是_______ 。第4周期元素的基态原子中,与基态K原子具有相同最外层电子数的是_______ (填元素符号)。
 。请回答下列问题。
。请回答下列问题。(1)基态碳原子的电子排布式为
(2)下列轨道表示式能表示基态氮原子的核外电子排布的是_______(填标号)。
A.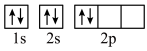 | B.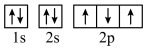 |
C.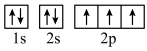 | D.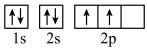 |
(3)C、N、O三种元素的第一电离能由大到小的顺序为
(4)Se元素位于第4周期,与O、S同主族。
①基态Se原子中具有
②O、S、Se三种元素的电负性依次
(5)用铂丝蘸取
 溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,从微观角度解释产生该现象的原因是
溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,从微观角度解释产生该现象的原因是
您最近一年使用:0次



