解题方法
1 . 金属原子与CO形成的配合物称为金属羰基配合物,金属羰基配合物中每个CO提供一对电子与金属原子形成配位键,且金属原子的外围电子与CO提供的电子总和等于18。羰基铁[Fe(CO)5]的结构如图所示,其熔点为-21℃,沸点为102.8℃,回答下列问题。
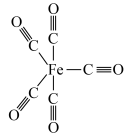
(1)基态Fe原子外围电子轨道表示式为_______ ,Fe(CO)5属于_____ 晶体。
(2)98gFe(CO)5中σ键的数目为_____ NA;Fe(CO)5中铁的配位数为_____ ,配位原子为_____ 。
(3)羰基镍的化学式为______ ,Ni、C、O的电负性由大到小的顺序为______ 。
(4)氯化羰基亚铜的结构为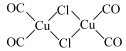 ,其中铜元素的化合价为
,其中铜元素的化合价为_____ ,标出氯化羰基亚铜中Cu周围的化学键:_____ (须用“→”表示配位键)。

(1)基态Fe原子外围电子轨道表示式为
(2)98gFe(CO)5中σ键的数目为
(3)羰基镍的化学式为
(4)氯化羰基亚铜的结构为
 ,其中铜元素的化合价为
,其中铜元素的化合价为
您最近一年使用:0次
名校
2 . 下列有关物质结构与性质的理解正确的是
| A.电负性大的元素,其第一电离能一定大 |
| B.σ键存在于所有分子中 |
C. 、 、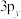 、 、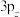 三个轨道相互垂直,能量相等 三个轨道相互垂直,能量相等 |
| D.干冰和冰的结构表明范德华力和氢键通常都具有方向性 |
您最近一年使用:0次
名校
解题方法
3 . 钡的单质和化合物在生产生活中有重要的应用。请回答下列问题:
(1)钡元素是第6周期的碱土金属元素,其基态原子的外围电子轨道表示式为_______ 。
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序是_______ ,SO 的空间构型是
的空间构型是_______ ,中心原子S的杂化方式是_______ 。
(3)部分碱土金属氧化物的熔点如下表所示:
由表中数据可知,该族元素氧化物熔点的变化规律是_______ ,产生这种规律的原因是_______ 。
(4)氯化钡的玻恩哈伯循环如下图所示:

①由图可知,Cl-Cl的键能为_______ 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),则氯元素的第一电子亲和能E1=_______ 。
(5)已知氟化钡的晶胞符合萤石结构(见下图)。

①若将M和N两点的原子分数坐标分别定义为(0,0,0)和(0, ,
, ),则下列坐标为F-分数坐标的是
),则下列坐标为F-分数坐标的是_______ 。
A.(0, ,
, ) B.(
) B.( ,
, ,
, ) C.(
) C.( ,
, ,
, ) D.(
) D.( ,
, ,
, )
)
②若晶胞中两个相邻且距离最近的Ba2+的核间距为apm,则氟化钡的密度ρ=_______ g·cm-3(列出计算式,不必化简)。
(1)钡元素是第6周期的碱土金属元素,其基态原子的外围电子轨道表示式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序是
 的空间构型是
的空间构型是(3)部分碱土金属氧化物的熔点如下表所示:
| 碱土金属氧化物 | MgO | CaO | SrO | BaO |
| 熔点/°C | 2800 | 2576 | 2430 | 1923 |
由表中数据可知,该族元素氧化物熔点的变化规律是
(4)氯化钡的玻恩哈伯循环如下图所示:

①由图可知,Cl-Cl的键能为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),则氯元素的第一电子亲和能E1=
(5)已知氟化钡的晶胞符合萤石结构(见下图)。

①若将M和N两点的原子分数坐标分别定义为(0,0,0)和(0,
 ,
, ),则下列坐标为F-分数坐标的是
),则下列坐标为F-分数坐标的是A.(0,
 ,
, ) B.(
) B.( ,
, ,
, ) C.(
) C.( ,
, ,
, ) D.(
) D.( ,
, ,
, )
)②若晶胞中两个相邻且距离最近的Ba2+的核间距为apm,则氟化钡的密度ρ=
您最近一年使用:0次
4 . 四氯化钛( )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 ,反应的化学方程式为
,反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:
(1)基态钛原子的电子排布式为___________ ,其未成对电子数为___________ 。
(2)已知:H、 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为
之间的化学键类型为___________ , 中
中 的化合价为
的化合价为___________ 。
(3)基态碳原子中,能量最高的电子位于___________ 轨道,该轨道有___________ 个伸展方向,轨道形状为___________ 。
(4)若用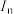 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:

 与
与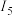 的差值明显大于其他相邻电离能的差值,原因是
的差值明显大于其他相邻电离能的差值,原因是___________ 。
(5)基态铁原子的外围电子轨道表示式为___________ 。 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为___________ 。
 )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 ,反应的化学方程式为
,反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:(1)基态钛原子的电子排布式为
(2)已知:H、
 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为
之间的化学键类型为 中
中 的化合价为
的化合价为(3)基态碳原子中,能量最高的电子位于
(4)若用
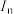 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
 与
与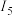 的差值明显大于其他相邻电离能的差值,原因是
的差值明显大于其他相邻电离能的差值,原因是(5)基态铁原子的外围电子轨道表示式为
 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为
您最近一年使用:0次
解题方法
5 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置_____ ,属于_____ 区。
(2)B、C、D三种元素的第一电离能数值由小到大 的顺序为___ (填元素符号),第一电离能最大的原因是____ 。
(3)D元素与氟元素相比,电负性:D____ F(填“>”、“=”或“<”),下列表述中能证明这一事实的是____ (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为___ ,它的晶体中含有多种化学键,但一定不含有的化学键是____ (填选项序号)。
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键____ mol。
(1)E元素在周期表中的位置
(2)B、C、D三种元素的第一电离能数值由
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键
您最近一年使用:0次
2021-04-21更新
|
206次组卷
|
3卷引用:河北省河间市第十四中学2020-2021学年高二下学期期中考试化学试题
名校
6 . 中科院大连化物所化学研究团队在化学链合成NH3研究方面取得新进展,该研究中涉及的物质有Ni-BaH2/Al2O3、Fe-K2O-Al2O3、Cs-Ru/MgO等,相关研究成果发表于《自然》上。请回答下列问题:
(1)Fe的基态原子共有_______ 种不同能级的电子,其最高能级的电子云形状是_______ 。
(2)氮原子的电子排布图表示的状态中,能量最低的是_______(填字母)。
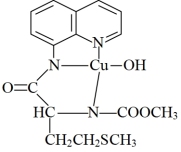
(3)一种含Cu、S元素的有机物的结构简式如图所示,N原子的杂化方式为_______ 。
(4)元素的第一电离能:Mg_______ (填“>”或“<”)Al;N、O的电负性由大到小的顺序为_______ (用元素符号表示)。
(5)某镍白铜合金的立方晶胞结构如图所示:
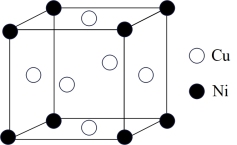
①该合金的化学式为_______ 。
②若该合金的晶胞边长为anm,则该合金的密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)Fe的基态原子共有
(2)氮原子的电子排布图表示的状态中,能量最低的是_______(填字母)。
A.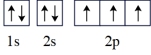 | B.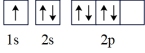 |
C.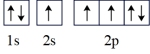 | D.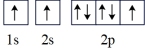 |

(4)元素的第一电离能:Mg
(5)某镍白铜合金的立方晶胞结构如图所示:

①该合金的化学式为
②若该合金的晶胞边长为anm,则该合金的密度为
您最近一年使用:0次
11-12高二·全国·课时练习
名校
7 . 下列各组元素的性质正确的是
| A.第一电离能:B>Al>Ga | B.电负性:F>N>O |
| C.最高正价:F>S>Si | D.原子半径:P>N>C |
您最近一年使用:0次
2019-04-20更新
|
293次组卷
|
17卷引用:河北省沧州市任丘市第一中学2019-2020学年高二6月月考化学试题
河北省沧州市任丘市第一中学2019-2020学年高二6月月考化学试题(已下线)2012年人教版高中化学选修3 1.2原子结构与元素的性质练习卷2014-2015山西省太原市五中高二上学期期末化学理试卷2015-2016学年湖北省黄香、航天等校高二下学期期末联化学试卷2017届河南信阳高考化学暑假自学自测专练:原子结构与性质河北省蠡县中学2016-2017学年高二6月月考化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题人教化学选修3第一章第二节课时4河北省正定中学2019-2020学年高二3月线上月考化学试题河北省邢台市2019-2020学年高二下学期期末考试化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷辽宁省清原满族自治县第二高级中学2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题新疆生产建设兵团第六师芳草湖农场中学2021-2022学年高二上学期期末考试化学试题河北省保定市崇德实验中学2020-2021学年度高二下学期期中考试化学试题
名校
8 . 在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是

| A.该配离子碳原子和氮原子都采取sp2杂化 |
| B.该配离子中铜离子的配位数是4,配位原子是N和O |
| C.基态Cu原子的价电子排布式是3d104s1 |
| D.该配离子中非金属元素的电负性大小顺序为O>N>C>H |
您最近一年使用:0次
2021-05-26更新
|
165次组卷
|
3卷引用:河北省沧州市吴桥县吴桥中学2023-2024学年高二下学期3月月考化学试题
解题方法
9 . 克菌丹是一种用于农作物的保护性杀菌剂,世界卫生组织公布其为致癌物,其结构简式如图所示。下列说法正确的是
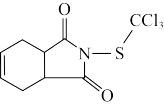

| A.电负性:O>Cl>S | B.热稳定性: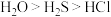 |
C.该分子中S采用 杂化 杂化 | D.酸性: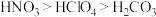 |
您最近一年使用:0次
解题方法
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,元素Y是地壳中含量最多的元素,X与Z同主族且二者可形成离子化合物,W的最外层电子数是其电子层数的2倍。下列说法正确的是
| A.电负性:X<W<Y | B.第一电离能:Z<W<Y |
| C.元素W的含氧酸均为强酸 | D.Z的氧化物对应的水化物为弱碱 |
您最近一年使用:0次



