1 . 下图是元素周期表的一部分(号元素 ,用化学用语回答下列问题:
,用化学用语回答下列问题:

(1)D的基态电子排布式可简写为:___________ ;H代表的元素在周期表中的位置是___________ 。
(2)、G、J、K、M对应的简单离子的半径由大到小的顺序是___________ (用离子符号表示)
(3)在所列元素中,电负性最大的元素是___________ (填元素符号)。
(4)已知某原子的各级电离能如下:I1=577kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11578kJ/mol,则该原子在化合物中表现的化合价为___________
(5)元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线规则。根据元素周期表对角线规则,金属铍Be与铝单质及其化合物性质十分相似。Be(OH)2和Mg(OH)2可用试剂NaOH溶液鉴别。涉及的化学方程式为:___________ 。
 ,用化学用语回答下列问题:
,用化学用语回答下列问题:
(1)D的基态电子排布式可简写为:
(2)、G、J、K、M对应的简单离子的半径由大到小的顺序是
(3)在所列元素中,电负性最大的元素是
(4)已知某原子的各级电离能如下:I1=577kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11578kJ/mol,则该原子在化合物中表现的化合价为
(5)元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线规则。根据元素周期表对角线规则,金属铍Be与铝单质及其化合物性质十分相似。Be(OH)2和Mg(OH)2可用试剂NaOH溶液鉴别。涉及的化学方程式为:
您最近一年使用:0次
2020-12-15更新
|
1011次组卷
|
5卷引用:辽宁省锦州市义县高级中学2020-2021学年高二12月月考化学试题
辽宁省锦州市义县高级中学2020-2021学年高二12月月考化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)1.2 原子结构与元素的性质(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)选择性必修第二册 期末学业水平检测江苏省盐城第一中学2023-2024学年高二上学期第二次学情调研考试(期中)化学(选修)试卷
名校
解题方法
2 . 如图为酞菁钴分子的结构简式。下列说法不正确的是


| A.电负性:N>C>H | B.4个N原子均与Co形成配位键 |
| C.分子中C的杂化轨道类型为sp2 | D.结构中存在σ键、π键和大π键 |
您最近一年使用:0次
2020-10-10更新
|
195次组卷
|
2卷引用:辽宁省2021届高三上学期测评考试化学试题
3 . (1)元素C、N、O、K的电负性从大到小依次为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______ 。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______ (填“A”“B”“C”或“D”)。

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______ ;B和N相比,电负性较大的是______ ,BN中B元素的化合价为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为
您最近一年使用:0次
2019-07-07更新
|
183次组卷
|
3卷引用:辽宁省凤城市第一中学2018-2019学年高二6月月考化学试题
名校
解题方法
4 . 下列叙述正确的是
| A.铬原子的电子排布式:ls22s22p63s23p63d44s2 |
| B.Na、Mg、Al的第一电离能逐渐增大 |
C.碳原子的电子排布图: |
| D.N、O、F的电负性逐渐增大 |
您最近一年使用:0次
2019-06-28更新
|
849次组卷
|
15卷引用:辽宁省锦州市黑山县黑山中学2019-2020学年高二下学期线上教学检测化学试题
辽宁省锦州市黑山县黑山中学2019-2020学年高二下学期线上教学检测化学试题福建省泉州市泉港区第一中学2017-2018学年高二下学期第一次(4月)月考化学试题【全国百强校】河北省武邑中学2017-2018学年高二下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题人教化学选修3第一章第二节课时5山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题四川省越西中学2019-2020学年高二5月月考化学试题安徽省亳州市涡阳县第九中学2019-2020学年高二7月月考化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题江苏省镇江市吕叔湘中学2019-2020学年高二下学期4月诊断考试化学试题福建省南安市柳城中学2020-2021学年高二下学期期中考试化学试题黑龙江省黑河市第九中学2022-2023学年高三上学期摸底考试化学试题新疆疏勒县实验学校2021-2022学年高二下学期期中考试化学试题黑龙江省大庆市大庆中学2022-2023学年高三第二次模拟考试化学试题
解题方法
5 . 磷的单质及其化合物用途非常广泛。回答下列问题。
(1)基态磷原子价电子轨道表示式为______________________ ;磷的第一电离能比硫大,其原因是_____________________________________________ 。
(2)已知反应6P2H4=P4+8PH3↑。P2H4分子中磷原子杂化类型是________________ ;P4分子的几何构型是________________________ 。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________ ;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________ 。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________ 。
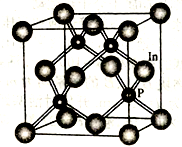
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In的配位数为_______________ ;与In原子间距离为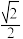 a nm的In原子有
a nm的In原子有________ 个。
(1)基态磷原子价电子轨道表示式为
(2)已知反应6P2H4=P4+8PH3↑。P2H4分子中磷原子杂化类型是
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In的配位数为
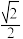 a nm的In原子有
a nm的In原子有
您最近一年使用:0次
2018-04-28更新
|
420次组卷
|
2卷引用:【全国校级联考】辽宁省朝阳市普通高中2018届高三第三次模拟考试理综化学试题
6 . 氢元素形成的化合物种类众多,在下列化合物中,氢元素显示正价的是
| A.BH3 | B.SiH4 | C.C2H2 | D.NaH |
您最近一年使用:0次
2016-12-09更新
|
314次组卷
|
2卷引用:2014-2015辽宁省葫芦岛市高二下学期市五校协作体期中化学试卷
名校
7 . 不能说明X的电负性比Y的大的是()
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
您最近一年使用:0次
2016-12-09更新
|
1716次组卷
|
31卷引用:【全国百强校】辽宁省葫芦岛市第一高级中学2017-2018学年高二下学期期中考试化学试题
【全国百强校】辽宁省葫芦岛市第一高级中学2017-2018学年高二下学期期中考试化学试题(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷2016-2017学年黑龙江哈三中高二下学期4月月考(验收)考试化学试卷福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题人教化学选修3第一章第二节课时3黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)江西省都昌县第三中学2019-2020学年高二下学期4月考试化学试题江西省都昌县第一中学2019-2020学年高二下学期期中线上考试化学试题宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷四川省越西中学2019-2020学年高二5月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时2 元素周期律——原子半径、电离能、电负性的递变规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质江苏省南京市2019-2020学年高二下学期期末考试化学试卷A卷江苏省扬州中学2020-2021学年高二下学期期中考试化学试题湖北省十堰市2016-2017学年高二下学期期末调研考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)专题1~2 综合检测(提升卷)新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题河北省邯郸市永年区第二中学2022-2023学年高二上学期12月月考化学试题江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题(已下线)题型82 电负性的比较
名校
8 . 下列元素的电负性最大的是:
| A.Na | B.S | C.O | D.C |
您最近一年使用:0次
2016-08-19更新
|
115次组卷
|
12卷引用:2015-2016学年辽宁省葫芦岛市六校协作体联考高二下期中化学试卷
2015-2016学年辽宁省葫芦岛市六校协作体联考高二下期中化学试卷(已下线)2009一2010年度吉林一中下学期高二期中考试化学卷(已下线)2011-2012学年山东省泰安宁阳二中高二下学期期末考试化学试卷(已下线)2012-2013学年云南省芒市中学高二上学期期中考试化学试卷(已下线)2012-2013学年福建省师大附中高二下学期期末考试化学试卷2015-2016学年福建省师大附中高二上期末理化学试卷2015-2016学年四川省雅安市高二上学期期末考试化学试卷2015-2016学年吉林省辽源市田家炳高中高二下期中化学试卷2015-2016学年吉林省汪清六中高二下学期期末化学试卷福建省莆田第八中学2018-2019学年高二下学期期中考试化学试题陕西省黄陵中学高新部2018-2019学年高二下学期期末考试化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)



