名校
解题方法
1 . 以甲醇为原料,采用钴碘催化法循环制醋酸,过程如图所示。下列说法正确的是

A.总反应的原子利用率为 |
B. 和 和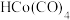 可降低该反应的活化能及反应热 可降低该反应的活化能及反应热 |
C. 与CH4为等电子体 与CH4为等电子体 |
D. 中 中 键数目 键数目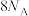 |
您最近一年使用:0次
2 . 下列方程式不能 准确解释相应实验现象的是
A. 和浓盐酸共热产生黄绿色气体: 和浓盐酸共热产生黄绿色气体: |
B.Na加入滴有酚酞的水中,溶液变红: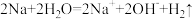 |
C.加热Fe和S的混合物生成黑色固体: |
D. 溶液中逐滴加入氨水,形成难溶沉淀。再继续添加氨水,难溶物溶解:Cu(OH)2(蓝色沉淀)+4NH3=[Cu(NH3)4](OH)2(深蓝色溶液) 溶液中逐滴加入氨水,形成难溶沉淀。再继续添加氨水,难溶物溶解:Cu(OH)2(蓝色沉淀)+4NH3=[Cu(NH3)4](OH)2(深蓝色溶液) |
您最近一年使用:0次
2023-12-11更新
|
41次组卷
|
2卷引用:四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题
2023·全国·模拟预测
名校
3 . 五羰基铁[ ]是一种具有三角双锥结构的黄色黏稠状液体,结构如图所示,已知其熔点为﹣20 ℃,沸点为103 ℃。下列推测不合理的是
]是一种具有三角双锥结构的黄色黏稠状液体,结构如图所示,已知其熔点为﹣20 ℃,沸点为103 ℃。下列推测不合理的是
 ]是一种具有三角双锥结构的黄色黏稠状液体,结构如图所示,已知其熔点为﹣20 ℃,沸点为103 ℃。下列推测不合理的是
]是一种具有三角双锥结构的黄色黏稠状液体,结构如图所示,已知其熔点为﹣20 ℃,沸点为103 ℃。下列推测不合理的是
| A.五羰基铁晶体属于分子晶体 |
| B.五羰基铁不溶于水,易溶于苯 |
| C.五羰基铁隔绝空气受热分解生成Fe和CO |
D.每个 粒子中含σ键的个数为20 粒子中含σ键的个数为20 |
您最近一年使用:0次
2023-04-21更新
|
744次组卷
|
6卷引用:四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 .  存在二种异构体,抗癌药物顺铂可由以下途径得到:
存在二种异构体,抗癌药物顺铂可由以下途径得到:  (顺铂),下列说法不正确的是
(顺铂),下列说法不正确的是
A.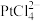 一定为平面正方形 一定为平面正方形 |
B.该变化过程说明 的配位能力大于 的配位能力大于 |
C.②过程说明Cl对位上的Cl更容易被 取代 取代 |
D.相同条件下, 在苯中的溶解度小于 在苯中的溶解度小于 |
您最近一年使用:0次
2023-04-09更新
|
670次组卷
|
5卷引用:四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题
5 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:(已知: 在溶液中为橙色,
在溶液中为橙色, 子在溶液中为黄色)
子在溶液中为黄色)
(1)下列反应曾用于检测司机是否酒后驾驶:
①基态 原子外围电子排布图为
原子外围电子排布图为_______ ;配离子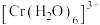 中与
中与 形成配位键的原子是
形成配位键的原子是_______ (填元素符号)。
② 与
与 可以任意比例互溶,除因为它们都是极性分子外,还因为
可以任意比例互溶,除因为它们都是极性分子外,还因为_______ 。
(2)有下列实验:

①该深蓝色晶体的化学式为_______ ,溶剂X可以是_______ (填名称),继续添加氨水,沉淀溶解,写出沉淀溶解的离子方程式为_______ 。
②该实验能说明 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是_______ 。
③下列有关化学实验“操作→现象→解释”均正确的是_______ 。
 在溶液中为橙色,
在溶液中为橙色, 子在溶液中为黄色)
子在溶液中为黄色)(1)下列反应曾用于检测司机是否酒后驾驶:

①基态
 原子外围电子排布图为
原子外围电子排布图为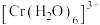 中与
中与 形成配位键的原子是
形成配位键的原子是②
 与
与 可以任意比例互溶,除因为它们都是极性分子外,还因为
可以任意比例互溶,除因为它们都是极性分子外,还因为(2)有下列实验:

①该深蓝色晶体的化学式为
②该实验能说明
 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是③下列有关化学实验“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 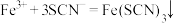 |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知 的配位数为6.则CrCl3·6H2O的化学式可表示为 的配位数为6.则CrCl3·6H2O的化学式可表示为 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加l0滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在: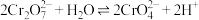 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
6 . 亚铁氰化钾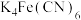 俗名黄血盐,在烧制青花瓷时用于绘画。制备方法为:
俗名黄血盐,在烧制青花瓷时用于绘画。制备方法为: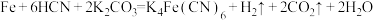 。设
。设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
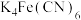 俗名黄血盐,在烧制青花瓷时用于绘画。制备方法为:
俗名黄血盐,在烧制青花瓷时用于绘画。制备方法为: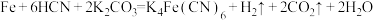 。设
。设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是A.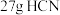 分子中含有 分子中含有 键数目为 键数目为 |
B.配合物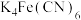 的中心离子价电子排布式为 的中心离子价电子排布式为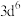 ,该中心离子的配位数为6 ,该中心离子的配位数为6 |
C.每生成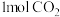 时,反应过程中转移电子数目为 时,反应过程中转移电子数目为 |
D. 中阴离子的空间构型为平面三角形,其中碳原子的价层电子对数目为4 中阴离子的空间构型为平面三角形,其中碳原子的价层电子对数目为4 |
您最近一年使用:0次
2023-03-04更新
|
1349次组卷
|
12卷引用:四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题
四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题广东省汕头市2023届高三一模化学试题广东省汕头市2023届高三下学期第一次模拟考试化学试题湖北省宜昌英杰学校2022-2023学年高二3月月考化学试题(已下线)专题08 化学反应中的能量变化(已下线)专题03 阿伏伽德罗常数的应用(已下线)专题06 物质结构与性质(已下线)专题09 氧化还原反应广东省深圳市福田区福田中学2022-2023学年高三下学期3月月考化学试题海南省嘉积中学2023届高三下学期高考模拟预测(5月)化学科试题广东省东莞市东华高级中学2022-2023学年高二下学期3月月考化学试题湖南省长沙市第一中学2023-2024学年高三上学期月考(一)化学试题
7 . 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
| C.向反应后的溶液加入乙醇,溶液没有发生变化 |
| D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
您最近一年使用:0次
2022-04-25更新
|
432次组卷
|
55卷引用:四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题
四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题(已下线)2009一2010年度吉林一中下学期高二期中考试化学卷(已下线)09~10年牡丹江一中高二下学期期末考试化学卷(已下线)2010-2011学年湖北省襄阳四校高二下学期期中联考化学试卷(已下线)2011-2012学年四川省南山中学高二上学期期末模拟考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(平行班)(已下线)2013届新疆乌鲁木齐市一中高二第二学期期中考试化学试卷(已下线)2013-2014山西省太原五中高二下学期期中化学(理)试卷2014-2015辽宁省朝阳区三校高二下学期第一次阶段性检测化学试卷2014-2015学年湖北省部分重点高中高二下期末考试化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年内蒙古赤峰二中高二下4月月考化学试卷2015-2016学年河北省邯郸市曲周一中高二下学期期末化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷2016-2017学年四川省成都市石室佳兴外国语学校高二下学期第一次月考化学试卷江苏省江阴市四校2016-2017学年高二下学期期中考试化学试题陕西省黄陵中学2016-2017学年高二(重点班)下学期第四学月考试化学试题辽宁省实验中学分校2016-2017学年高二6月月考化学试题宁夏青铜峡市高级中学2017-2018学年高二上学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第3课时)吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期中考试化学试题【全国百强校】黑龙江省大庆市铁人中学2017-2018学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题河北省邢台市第二中学2018-2019学年高二下学期第四次月考化学试题【市级联考】新疆维吾尔自治区乌鲁木齐市2018-2019学年高二下学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】宁夏育才中学2019-2020学年高二下学期开学检测化学试题宁夏银川市长庆高级中学2019-2020学年高二下学期期中考试化学试题吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期中考试化学试题四川省自贡市田家炳中学2020-2021学年高二上学期开学考试化学试题(已下线)【全国百强校】吉林省延边第二中学2018-2019学年高二下学期期中考试化学试题河南省漯河市临颍县南街高中2020-2021学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题(已下线)3.4 配合物与超分子(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题吉林省长春市清蒲中学2020-2021学年高二下学期期中考试化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题四川省遂宁中学校2020-2021学年高二下学期第一次月考化学试题专题4 分子空间结构与物质性质 第二单元 配合物的形成和应用 第1课时 配合物的形成第三章 本章达标检测2四川省绵阳市盐亭中学2023届高三上学期第一次模拟考试化学试题四川省内江市威远中学校2022-2023学年高二上学期第一次月考化学试题安徽省滁州市定远县育才学校2021-2022学年高三上学期期末考试化学试题四川省广元市苍溪中学校2022-2023学年高二下学期5月期中考试化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题广东省韶关实验中学2021-2022学年高二下学期第一次月考化学试题安徽省萧城一中2023届高三上学期期末考试化学试题四川省双流中学2023-2024学年高三上学期10月月考理综化学试题四川省泸县第一中学2023-2024学年高三上学期10月月考理综化学试题
名校
解题方法
8 . 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_____ ,3d能级上的未成对电子数为______ ,在周期表中的位置______ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为____ ,提供孤电子对的成键原子是____ ,配位数______ 。
③氨的沸点_____ (填“高于”或“低于”)膦(PH3),原因是_______ ;氨是_______ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为______ 。
(3)某镍白铜合金的立方晶胞结构如图所示,晶胞中铜原子与镍原子的数量比为_____ 。

(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为
③氨的沸点
(3)某镍白铜合金的立方晶胞结构如图所示,晶胞中铜原子与镍原子的数量比为

您最近一年使用:0次
9 . 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子的中心原子价层电子对数为________ ;水分子的空间构型为________ 。
(2)写出与H2O分子互为等电子体的离子___________ (填1种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________ 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
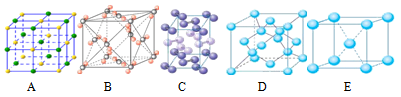
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________ (请用相应的编号填写)。
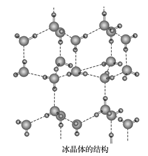
(5)在冰晶体中,每个水分子与相邻的 4个水分子形成氢键(如图所示),已知冰的升华热是 51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能 ” 是___________ kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子, 请写出生成此配合离子的离子方程式:___________ 。
(1)水分子的中心原子价层电子对数为
(2)写出与H2O分子互为等电子体的离子
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是

(5)在冰晶体中,每个水分子与相邻的 4个水分子形成氢键(如图所示),已知冰的升华热是 51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能 ” 是

(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子, 请写出生成此配合离子的离子方程式:
您最近一年使用:0次
10 . 按要求回答下列问题
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答: 该元素的元素符号为___________ ,它在周期表中的位置是___________ 。
(2)指出配合物K3[Co(CN)6]的配位体及其配位数:___________ 、___________ 。
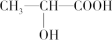
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。___________ 。
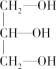
(4)在下列物质中,属于非极性分子的是(填番号)___________ 。
①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4___________ H2SO3; 其原因是____________
(6)NH3中心原子的杂化方式为___________ 杂化,VSEPR 构型为___________ ,分子中键角小于120︒的原因是___________ 。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________ 。
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答: 该元素的元素符号为
(2)指出配合物K3[Co(CN)6]的配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。

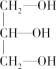
(4)在下列物质中,属于非极性分子的是(填番号)
①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)NH3中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
您最近一年使用:0次



