名校
解题方法
1 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为_______ ;基态 较基态
较基态 更稳定的原因是
更稳定的原因是_______ 。
(2) 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有_______ 个;C、N、F的电负性由大到小的顺序为_______ 。
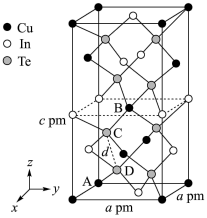
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为_______ ;该晶体的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为(0,0,0)、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ ,晶胞中C、D间距离
_______ pm。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为 较基态
较基态 更稳定的原因是
更稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C.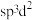 | D. |
(3)
 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 ,则C点原子的分数坐标为
,则C点原子的分数坐标为

您最近一年使用:0次
2024-04-04更新
|
697次组卷
|
3卷引用:2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学
2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学
名校
2 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标况条件下,22.4 L C2H4中含有极性键数目为6NA | B.1 mol [Cu(H2O)4]2+中含σ键数目为8NA |
| C.40g的金刚砂(SiC)中,所含的碳硅键个数为2NA | D.1LpH=2的 溶液中 溶液中 数目为0.01NA 数目为0.01NA |
您最近一年使用:0次
3 . 铬在希腊文中的原意为“颜色”,能够生成美丽多色的化合物,三价铬离子能形成形形色色的络合物。回答下列问题:
(1)铬位于元素周期表中_______ 区,其基态原子价电子排布式为_______ 。
(2)紫色[Cr(H2O)6]3+、橙红色的[Cr(NH3)4(H2O)2]3+、灰绿色的Cr(CH3COO)3,部分结构示意图如图所示。

①氮和氧中第一电离能较大的元素是_______ ,原因是_______ 。
②H2O和NH3中键角较大的分子是_______ ,[Cr(NH3)4(H2O)2]3+的同分异构体共有_______ 种。
③1 mol Cr(CH3COO)3所含σ键的数目为_______ ,结构中C原子的杂化方式为_______ 。
(3)用铬原子代替部分铜原子,可以形成一系列铜-铬合金。其中两种铜-铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为_______ 。
②晶体b中铬原子填充在由铜原子构成的_______ (填“四面体”、“六面体”或“八面体”)空隙中,NA表示阿伏加德罗常数的值,则晶体b的密度为_______ g/cm3。
(1)铬位于元素周期表中
(2)紫色[Cr(H2O)6]3+、橙红色的[Cr(NH3)4(H2O)2]3+、灰绿色的Cr(CH3COO)3,部分结构示意图如图所示。

①氮和氧中第一电离能较大的元素是
②H2O和NH3中键角较大的分子是
③1 mol Cr(CH3COO)3所含σ键的数目为
(3)用铬原子代替部分铜原子,可以形成一系列铜-铬合金。其中两种铜-铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为
②晶体b中铬原子填充在由铜原子构成的
您最近一年使用:0次
名校
4 . 乙酰丙酮是“种有酯气味的无色透明液体,常用作溶剂、有机合成中间体、金属络合剂等。它有两种主要互变异构体A、B,与Be2+、Mg2+、Cu2+、Zn2+等形成配合物C。回答下列有关问题:

(1)基态Cu2+离子的价电子排布式为_______ ,Be和Mg第一电离能较大的是_______ 原子。
(2)A中C原子杂化轨道类型有_______ ;按VSEPR预测B中∠HCC约为_______ 、_______ (填角度)。B在碱性条件下断裂极性最大的键,是_______ 键。 具有分子内氢键的是_______ (填“A”或“B”)。
(3)C中σ键与π键数目之比为_______ 。
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是_______ 。
(5)金属铜的某些参数如下:
根据上述数据,计算Cu的原子半径为_______ pm (列出计算表达式,设NA是阿伏加德罗常数的值)。

(1)基态Cu2+离子的价电子排布式为
(2)A中C原子杂化轨道类型有
(3)C中σ键与π键数目之比为
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是
(5)金属铜的某些参数如下:
| 金属 | 堆积类型 | 密度/g·cm-3 | 相对原子质量 |
| Cu | 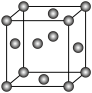 | ρ | 64 |
您最近一年使用:0次
2022-05-12更新
|
1444次组卷
|
7卷引用:四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题
四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题四川省南充市2022届高三适应性考试(三诊)理综化学试题(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)考前特训 [综合大题分类规范练]四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题四川省叙永第一中学校2023-2024学年高三上学期1月期末理综试题-高中化学
名校
5 . 在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是

| A.该配离子碳原子和氮原子都采取sp2杂化 |
| B.该配离子中铜离子的配位数是4,配位原子是N和O |
| C.基态Cu原子的价电子排布式是3d104s1 |
| D.该配离子中非金属元素的电负性大小顺序为O>N>C>H |
您最近一年使用:0次
2021-05-26更新
|
165次组卷
|
3卷引用:四川省眉山市仁寿县四校2020-2021学年高二5月月考化学试题
名校
解题方法
6 . (1) 26Fe的简化电子排布式___________ 按电子排布式它属于___________ 区
(2)C、 N、O三种元素的第一电离能有大到小的排序为___________
(3)价电子排布式为3d54s2的原子,其原子结构示意图为___________
(4)指出配合物K3[Co(CN)6]中的配体___________
(5)判断BF3分子的立体构型、中心原子成键时采取的杂化轨道类型___________ 、___________
(2)C、 N、O三种元素的第一电离能有大到小的排序为
(3)价电子排布式为3d54s2的原子,其原子结构示意图为
(4)指出配合物K3[Co(CN)6]中的配体
(5)判断BF3分子的立体构型、中心原子成键时采取的杂化轨道类型
您最近一年使用:0次
解题方法
7 . (1)基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了___________ 原理或规则。
(2)基态Cu原子核外电子排布式为_______ ,则高温下的稳定性CuO _____ Cu2O(填“>”或“<”)。
(3)在尿素CO(NH2)2中C、N的杂化方式分别为________ ,OF2的空间构型是___________ 。
(4)在Fe(NO3)3溶液中加入Na2SO3,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是_____ (用离子方程式表示)。
(5)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_____ ,并写出一种与氨硼烷互为等电子体的分子______ (填化学式)。
(2)基态Cu原子核外电子排布式为
(3)在尿素CO(NH2)2中C、N的杂化方式分别为
(4)在Fe(NO3)3溶液中加入Na2SO3,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是
(5)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式
您最近一年使用:0次
名校
8 . 下列有关说法不正确的是( )
A.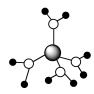 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键 |
B.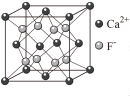 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+ CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+ |
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动 H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动 |
D. 金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12 金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12 |
您最近一年使用:0次
2019-06-04更新
|
1419次组卷
|
38卷引用:四川省眉山中学2016-2017学年高二下学期期中考试理综化学试题
四川省眉山中学2016-2017学年高二下学期期中考试理综化学试题四川省眉山一中2017-2018学年高二下学期期中考试化学试题2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷安徽省合肥市第一中学2016-2017学年高二下学期期中考试化学试题山西省应县第一中学校2016-2017学年高二6月月考(月考八)化学试题福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高二下学期期末联考化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质宁夏石嘴山市第三中学2017-2018学年高二上学期期中考试化学试题甘肃省兰州市第一中学2017-2018学年高二下学期期中考试化学试题【全国校级联考】辽宁省六校协作体2017-2018学年高二下学期期中考试化学试题【全国百强校】山西省大同市第一中学2017-2018学年高二5月月考化学试题河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题辽宁省实验中学2017-2018学年高二下学期期末考试化学试题福建省霞浦县第一中学2017-2018学年高二下学期第二次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期中考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题山西省吕梁市汾阳中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷贵州省思南中学2018-2019学年高二下学期期末考试化学试题【全国百强校】四川省棠湖中学2018-2019学年高二下学期期末考试理综-化学试题2020高三总复习二轮复习——物质结构与性质复习卷河北省新乐市第一中学2018--2019学年高二下学期第二次月考化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题宁夏青铜峡市高级中学(吴忠中学青铜峡分校)2019-2020学年高二下学期期末考试化学试题宁夏海原县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第36讲 晶体结构与性质-2021年高考化学一轮复习名师精讲练陕西省西安市西安高新第一中学2018-2019学年高二下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题(已下线)第37讲 晶体结构与性质(精练)-2021年高考化学一轮复习讲练测新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题湖北省孝感市高级中学2020—2021学年高二下学期2月调研考试化学试题(已下线)专题18 物质结构与性质-备战2021届高考化学二轮复习题型专练江苏省盐城市东台创新高级中学2021-2022学年高二3月份月检测化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题河北省唐山市迁西县职教中心2021-2022学年高二(普职融通二部)下学期4月月考化学试题广西钦州市第一中学2022-2023学年高二下学期期中考试化学试题
2019高三下·全国·专题练习
名校
9 . 铁及其化合物在生活、生产、国防等方面有广泛应用。
(1)基态铁原子的电子排布式为[Ar]_______________________ 。
(2)Fe2+易被氧化成Fe3+,从微粒的结构上分析其主要原因是______________________________ 。
(3)铁氰化钾K3[Fe(CN)6]是检验Fe2+的重要试剂,在铁氰化钾中,碳原子的杂化类型是___________ ;1 mol K3[Fe(CN)6]含_________ mol σ键。
(4)Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。Fe(CO)5是_________ 分子(填“极性”或“非极性”),它的固体熔化时克服作用力类型是____________ 。配体CO提供孤电子对的原子是C,不是O,其原因是______________________ 。
(5)铁碳合金,是铁和碳组成的二元合金。其中一种铁碳合金的结构如下:
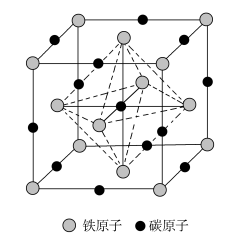
则该铁碳合金的化学式_______________ (用原子个数最简比表示)。若渗入碳原子不改变铁原子间的距离,则在该铁的晶体中渗入碳原子后,可使其密度净增_____ %(结果保留3位有效数字)。
(1)基态铁原子的电子排布式为[Ar]
(2)Fe2+易被氧化成Fe3+,从微粒的结构上分析其主要原因是
(3)铁氰化钾K3[Fe(CN)6]是检验Fe2+的重要试剂,在铁氰化钾中,碳原子的杂化类型是
(4)Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。Fe(CO)5是
(5)铁碳合金,是铁和碳组成的二元合金。其中一种铁碳合金的结构如下:

则该铁碳合金的化学式
您最近一年使用:0次
10 . 以铁矿石(Fe2O3)为起始物,经过一系列反应可以得到Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)写出Fe的原子结构示意图_____________ ,O原子核外电子轨道表示式为__________ 。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____________ 。SCN-的空间构型__________________ 。
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________________ ,该化学键能够形成的原因是______________________________ 。
(4)K3[Fe(CN)5NO]的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_________________ ,该配合物中铁原子的配位数是________________ 。
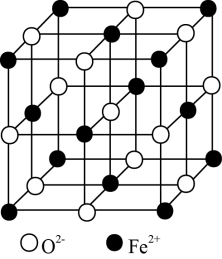
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为________________ ,若该晶胞边长为a nm,则该晶体密度为_________ g·cm-3(阿伏伽德罗常数的值为NA)。
(1)写出Fe的原子结构示意图
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为
(4)K3[Fe(CN)5NO]的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为

您最近一年使用:0次
2019-03-11更新
|
238次组卷
|
2卷引用:四川省眉山第一中学2019届高三下学期入学考试理科综合化学试题



