13-14高二下·甘肃兰州·期中
名校
解题方法
1 . 关于化学式[TiCl(H2O)5]Cl2⋅H2O的配合物的下列说法中正确的是
| A.配位体是Cl-和H2O,配位数是9 |
| B.配离子是[TiCl(H2O)5]2+,中心离子是Ti4+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
您最近一年使用:0次
2023-06-25更新
|
365次组卷
|
74卷引用:四川省越西中学2019-2020学年高二5月月考化学试题
四川省越西中学2019-2020学年高二5月月考化学试题(已下线)2013-2014甘肃省兰州一中下学期期中考试高二化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年辽宁鞍山一中高二下期中化学试卷2014-2015学年陕西西北大学附中高二下期末化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷2017届福建省华安一中高三上学期开学考试化学试卷2016-2017学年山西省太原市外国语学校高二下学期第一次月考化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测(已下线)2019年3月9日 《每日一题》人教选修3-周末培优(已下线)2019年4月13日 《每日一题》选修3-周末培优吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题吉林省延边第二中学2018-2019学年高二下学期期末考试化学试题山东省聊城市冠县2020届高三10月月考化学试题湖北省宜昌市第二中学2018-2019学年高二上学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第3节 离子键、配位键与金属键——A学习区 夯实基础(鲁科版选修3)河北省枣强中学2019-2020学年高二下学期第三次月考化学试题山西省晋中市平遥中学2019-2020高二下学期在线学习质量检测化学试题河北省博野中学2019-2020学年高二下学期开学考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题辽宁省沈阳市郊联体2019-2020学年高二下学期期中考试化学试题福建省莆田市莆田第二十五中学2019-2020学年高二下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)第36讲 分子结构与性质(精练)-2021年高考化学一轮复习讲练测新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题(已下线)专题18 物质结构与性质-备战2021届高考化学二轮复习题型专练吉林省前郭尔罗斯蒙古族自治县蒙古族中学2020-2021学年高二下学期第一次月考化学试题福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题天津市第三中学2020-2021学年高二下学期期中考试化学试题福建省龙岩市长汀县三级达标校2020-2021学年高二下学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题福建省永泰县第一中学2020-2021学年高二下学期期中考试化学试题福建省仙游县枫亭中学2020-2021学年高二下学期期中考试化学试题新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题河南省商丘市柘城县柘城第四高级中学2020-2021学年高二下学期期末考试化学(理)试题辽宁省鞍山市2020-2021学年高二下学期期末考试化学试题黑龙江省绥化市第一中学2020-2021学年高二下学期期中考试化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题福建省德化第一中学2021-2022学年高二下学期第一次质检化学试题河南省南阳市第一中学校2021-2022学年高二下学期第四次月考化学试题湖南省衡阳市第一中学2021-2022学年高二下学期5月月考化学试题福建省福州市四校联盟2021-2022学年高二下学期期中联考化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题湖北省武汉市钢城第四中学2021-2022学年高二下学期期中考试化学试题浙江省杭州市源清中学2021-2022学年高二下学期期中考试化学试题(已下线)第31讲 晶体结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)宁夏银川市景博中学2021-2022学年高二下学期第二次月考化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省遂宁中学校2022-2023学年高二上学期10月月考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第三次月考化学试题山西省朔州市怀仁市大地学校2021-2022学年高二下学期第一次月考化学试题重庆市璧山来凤中学2022-2023学年高二下学期第一次月考化学试题河南省灵宝市第一高级中学2022-2023学年高二下学期3月月考化学试题四川省广元中学2021-2022学年高二下学期第一次段考化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题北京市汇文中学2021-2022学年高二下学期期中考试化学试题江苏省江阴市华士高级中学2023-2024学年高二上学期10月学情调研化学(选修)试题(已下线)3.4 配合物与超分子-随堂练习山东省临沂市平邑县第一中学西校区2023-2024学年高二下学期四月份阶段性考试化学试题北京市大兴区第一中学2023-2024学年高二下学期期中考试化学试题(已下线)3.4 配合物与超分子课堂例题
解题方法
2 . 锌元素的化合物有着重要作用,回答下列问题:
(1)基态Zn2+价层电子排布图为:_______ ;下列锌元素的不同微粒,若再失去一个电子需要能量最大的是_______ (填序号)。
A. [Ar]3d104s2 B. [Ar]3d104s14p1 C. [Ar]3d104s1 D. [Ar]3d104p1
(2)Zn2+能与CN-形成配合物,写出一种与CN-互为等电子体的微粒_______ (填微粒符号);[Zn(CN)4]2-中,C比N更容易与Zn2+形成配位键,原因是_______ 。
(3)Zn2+能与NH3形成稳定配离子[Zn(NH3)4]2+,设NA为阿伏加德罗常数的值,1mo[Zn(NH3)4]2+中所含σ键的数目为_______ 。
(4)甘氨酸锌是研究最早和使用最广泛的第三代锌添加剂,其结构如下:
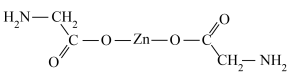
甘氨酸锌中各非金属元素电负性由大到小的顺序是_______ ,其中碳原子杂化方式为_______ 。
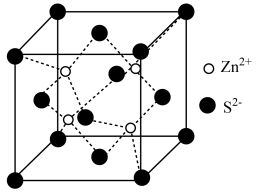
(5)ZnS的晶胞如图所示,Zn2+的配位数为_______ ,设NA为阿伏加德罗常数的值,若Zn2+与S2-最小距离apm,则ZnS的密度为_______ g·cm-3(写出表达式即可)。
(1)基态Zn2+价层电子排布图为:
A. [Ar]3d104s2 B. [Ar]3d104s14p1 C. [Ar]3d104s1 D. [Ar]3d104p1
(2)Zn2+能与CN-形成配合物,写出一种与CN-互为等电子体的微粒
(3)Zn2+能与NH3形成稳定配离子[Zn(NH3)4]2+,设NA为阿伏加德罗常数的值,1mo[Zn(NH3)4]2+中所含σ键的数目为
(4)甘氨酸锌是研究最早和使用最广泛的第三代锌添加剂,其结构如下:
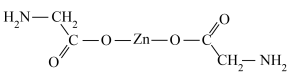
甘氨酸锌中各非金属元素电负性由大到小的顺序是
(5)ZnS的晶胞如图所示,Zn2+的配位数为

您最近一年使用:0次
名校
解题方法
3 . 按要求回答下列问题:
(1)基态Cu+核外电子排布式为_______ ;基态O原子未成对电子有_______ 个。
(2) 离子的VSEPR模型为
离子的VSEPR模型为_______ ,写出 离子的一种等电子体
离子的一种等电子体_______ 。从分于结构角度分析,HNO3酸性强于HNO2的原因是_______ 。
(3) 是一种叠氮一炔基Husigen环加成反应产物,该分子中N原子的杂化方式为
是一种叠氮一炔基Husigen环加成反应产物,该分子中N原子的杂化方式为_______ 。
(4)NH3分子中H-N-H键角为107°。如图是[Zn(NH3)6]2+的部分结构以及H-N-H键角的测量值。解释NH3形成[Zn(NH3)6]2+后H-N-H键角变大的原因:_______ 。

(5)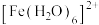 与
与 反应生成的
反应生成的 中,
中, 以
以 原子与
原子与 形成配位键。请在
形成配位键。请在 结构示意图的相应位置补填缺少的配体
结构示意图的相应位置补填缺少的配体_______ 。

(1)基态Cu+核外电子排布式为
(2)
 离子的VSEPR模型为
离子的VSEPR模型为 离子的一种等电子体
离子的一种等电子体(3)
 是一种叠氮一炔基Husigen环加成反应产物,该分子中N原子的杂化方式为
是一种叠氮一炔基Husigen环加成反应产物,该分子中N原子的杂化方式为(4)NH3分子中H-N-H键角为107°。如图是[Zn(NH3)6]2+的部分结构以及H-N-H键角的测量值。解释NH3形成[Zn(NH3)6]2+后H-N-H键角变大的原因:

(5)
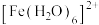 与
与 反应生成的
反应生成的 中,
中, 以
以 原子与
原子与 形成配位键。请在
形成配位键。请在 结构示意图的相应位置补填缺少的配体
结构示意图的相应位置补填缺少的配体
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)符号“3px”没有给出的信息是_______
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
(4)下列比较正确的是_______。
(5)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_______ ;
(6)Ni与CO在60~80℃时反应生成 Ni(CO)4气体,在 Ni(CO)4分子中与Ni形成配位键的原子是_______ ,Ni(CO)4晶体类型是_______ ,画出Ni(CO)4的结构 _______ 。
(1)符号“3px”没有给出的信息是_______
| A.能层 | B.能级 | C.电子云在空间的伸展方向 | D.电子的自旋方向 |
| A.4s1 | B.3p64s1 | C.3d54s1 | D.3d104s1 |
| A.HX | B.H2X | C.XH3 | D.XH4 |
| A.酸性:H3PO4>H3AsO4 | B.稳定性:H2O<H2S |
| C.离子半径:r(Al3+)>r(O2-) | D.键角:H2O>NH3 |
(6)Ni与CO在60~80℃时反应生成 Ni(CO)4气体,在 Ni(CO)4分子中与Ni形成配位键的原子是
您最近一年使用:0次
名校
解题方法
5 . 铜具有多种化合物,在工业生产中有重要作用。如醋酸二氨合铜溶液用来吸收合成氨工业中的CO,防止催化剂中毒,该反应是:[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac-代表CH3COO-)。回答下列问题:
(1)基态铜原子的核外电子排布式为_______ 。
(2)C、N、O三种元素的电负性由大到小的顺序为_______ 。
(3)NH3的VSEPR构型为_______ ,CO的电子式为_______ 。
(4)配合物[Cu(NH3)3CO]Ac中铜元素的化合价为_______ ,中心原子的配位数为_______ ,CH3COO-中碳原子的杂化方式为_______ ,该化合物存在的化学键类型为_______ 。
(5)从电子排布的角度解释一价铜比二价铜稳定的原因_______ 。
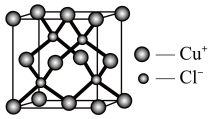
(6)铜的另一种化合物CuCl可用作有机合成的催化剂,其晶胞结构如图所示,则晶胞中Cu的配位数为_______ ,已知晶胞中Cu与Cl的最短距离为apm,则晶体密度ρ=_______ g/cm3(用NA表示阿伏加德罗常数)。
(1)基态铜原子的核外电子排布式为
(2)C、N、O三种元素的电负性由大到小的顺序为
(3)NH3的VSEPR构型为
(4)配合物[Cu(NH3)3CO]Ac中铜元素的化合价为
(5)从电子排布的角度解释一价铜比二价铜稳定的原因
(6)铜的另一种化合物CuCl可用作有机合成的催化剂,其晶胞结构如图所示,则晶胞中Cu的配位数为

您最近一年使用:0次
2022-06-28更新
|
148次组卷
|
2卷引用:四川省凉山州宁南中学2021-2022学年高二下学期期末零诊模拟考试化学试题
名校
6 . 金属单质及其化合物是化工生产、生活中常用的材料
(1)基态Ni原子价电子排布图为_______ 。
(2)某镍配合物由1个Ni2+与2个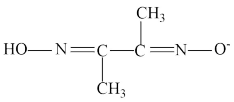 形成。
形成。
①形成该镍配合物的元素中,第二周期元素的第一电离能由小到大的顺序为_______ (用元素符号表示) ,配合物中C采用的杂化类型为_______ 。
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为_______ (填“C”、“N"”或“O")
(3)Ni(CO)4是常温下呈液态的镍的重要配合物,易溶于CCl4、苯等有机溶剂,则Ni(CO)4的空间构型为_______ ,Ni(CO)4中含有的σ键与π键的数目之比为_______ ,与CO互为等电子的离子有_______ (任写一种)。
(4)MgCO3的热分解温度低于CaCO3的原因是_______ 。
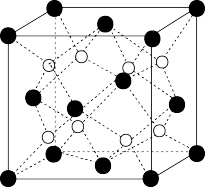
(5)Na2O的晶胞结构如图,Na+的配位数为_______ 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的氧离子间距离为_______ nm(用含ρ、NA的计算式表示)。
(1)基态Ni原子价电子排布图为
(2)某镍配合物由1个Ni2+与2个
 形成。
形成。①形成该镍配合物的元素中,第二周期元素的第一电离能由小到大的顺序为
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为
(3)Ni(CO)4是常温下呈液态的镍的重要配合物,易溶于CCl4、苯等有机溶剂,则Ni(CO)4的空间构型为
(4)MgCO3的热分解温度低于CaCO3的原因是
(5)Na2O的晶胞结构如图,Na+的配位数为

您最近一年使用:0次
解题方法
7 . 中国科学技术大学俞书宏教授团队和高敏锐教授课题组通过室温过饱和溶液共沉积法,实现了无定形NiFeMo氧化物纳米材料的宏量制备,该方法简便快捷,反应几分钟即可一次性生产多达515克的产物,制备的无定形NiFeMo氧化物在碱性条件下展示出优异的OER催化活性,明显优于结晶型NiFeMo氧化物。根据所学知识回答下列问题:
(1)区别结晶型NiFeMo氧化物和无定形NiFeMo氧化物最可靠的科学方法为___________ ,结晶型NiFeMo氧化物能自发呈现多面体外形,这种性质称为晶体的___________ 。
(2)Mo为第五周期元素与Cr同族,则Mo的价层电子排布式为___________
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,是获得高纯度纳米镍的原料,Ni(CO)4是___________ (填“极性”或“非极性”)分子。
(4)下列状态的铁中,电离最外层的一个电子所需能量最大的是___________(填编号)。
(5)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为___________ ,其中Fe的配位数为___________ 。
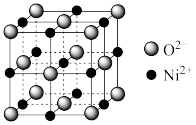
(6)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为___________ g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。
(1)区别结晶型NiFeMo氧化物和无定形NiFeMo氧化物最可靠的科学方法为
(2)Mo为第五周期元素与Cr同族,则Mo的价层电子排布式为
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,是获得高纯度纳米镍的原料,Ni(CO)4是
(4)下列状态的铁中,电离最外层的一个电子所需能量最大的是___________(填编号)。
A. | B.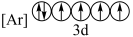 |
C.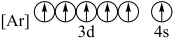 | D.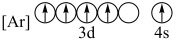 |
(6)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为

您最近一年使用:0次
2022-03-17更新
|
204次组卷
|
2卷引用:四川省西昌市2020-2021学年高二下学期期中检测化学试题
解题方法
8 . 在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的 洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了 、
、 、
、 、C等多种元素。请回答:
、C等多种元素。请回答:
(1)铁位于元素周期表中_______ 列,基态 的核外简化电子排布式为
的核外简化电子排布式为_______ 。
(2)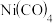 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测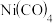 是
是_______ 晶体。
(3)实验室常用 溶液检验
溶液检验 。
。
①与 互为等电子体的非极性分子的化学式为
互为等电子体的非极性分子的化学式为_______ 。
② 中碳原子杂化类型为
中碳原子杂化类型为_______ 。
(4)配位化合物 中心原子
中心原子 的配位数为
的配位数为_______ ,配位原子为_______ 。 中含
中含 键
键_______  。
。
(5)已知 可以形成多种氧化物,其中一种
可以形成多种氧化物,其中一种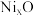 晶体的晶胞结构为
晶体的晶胞结构为 型(
型( 晶胞如下图),由于晶体缺陷导致
晶胞如下图),由于晶体缺陷导致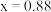 ,晶胞参数为
,晶胞参数为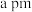 ,则晶体密度为
,则晶体密度为_______  (
( 表示阿伏加德罗常数的值,只需列出计算式)。
表示阿伏加德罗常数的值,只需列出计算式)。
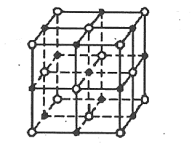
 洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志.其制作材料中包含了 、
、 、
、 、C等多种元素。请回答:
、C等多种元素。请回答:(1)铁位于元素周期表中
 的核外简化电子排布式为
的核外简化电子排布式为(2)
 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测 是
是(3)实验室常用
 溶液检验
溶液检验 。
。①与
 互为等电子体的非极性分子的化学式为
互为等电子体的非极性分子的化学式为②
 中碳原子杂化类型为
中碳原子杂化类型为(4)配位化合物
 中心原子
中心原子 的配位数为
的配位数为 中含
中含 键
键 。
。(5)已知
 可以形成多种氧化物,其中一种
可以形成多种氧化物,其中一种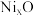 晶体的晶胞结构为
晶体的晶胞结构为 型(
型( 晶胞如下图),由于晶体缺陷导致
晶胞如下图),由于晶体缺陷导致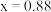 ,晶胞参数为
,晶胞参数为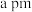 ,则晶体密度为
,则晶体密度为 (
( 表示阿伏加德罗常数的值,只需列出计算式)。
表示阿伏加德罗常数的值,只需列出计算式)。
您最近一年使用:0次
名校
9 . 下列对[Zn(NH3)4]SO4配合物的说法不正确的是( )
| A.SO42﹣是内界 | B.配位数是4 |
| C.Zn2+是中心离子 | D.NH3是配位体 |
您最近一年使用:0次
2017-12-12更新
|
469次组卷
|
7卷引用:四川省凉山木里中学2017-2018学年高二上学期期中考试化学试卷



