1 . 对下列事实的解释不正确 的是
| 选项 | 事实 | 解释 |
| A | 气态氢化物稳定性: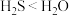 |  分子间存在氢键, 分子间存在氢键, 分子间不存在氢键 分子间不存在氢键 |
| B | 熔点:石英>干冰 | 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强 |
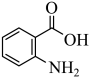
| C | 酸性: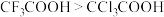 |  的电负性大于 的电负性大于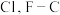 的极性大于 的极性大于 ,使 ,使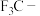 的极性大于 的极性大于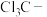 的极性,导致分子中 的极性,导致分子中 极性: 极性: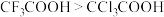 |
| D |  分子中的共价键是 分子中的共价键是 键 键 |  价电子排布为 价电子排布为 原子结合为 原子结合为 时,两个原子的 时,两个原子的 轨道“头碰头”重叠 轨道“头碰头”重叠 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列事实与解释不对应 的是
| 选项 | 事实 | 解释 |
| A | 第一电离能: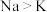 |  与K位于同一主族,原子半径: 与K位于同一主族,原子半径: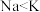 ,原子核对外层电子的吸引能力: ,原子核对外层电子的吸引能力: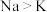 |
| B | 晶体中每个分子紧邻的分子数: 硫化氢晶体(12个)  冰(4个) 冰(4个) | 冰中水分子间主要以氢键结合,硫化氢晶体中硫化氢分子间主要以范德华力结合 |
| C | 分子的极性: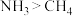 |  键的极性大于 键的极性大于 键的极性 键的极性 |
| D | 熔点: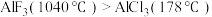 |  属于离子晶体, 属于离子晶体, 属于分子晶体 属于分子晶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-01更新
|
501次组卷
|
3卷引用:北京市第一六一中学2023-2024学年高三下学期开学考化学试题
名校
解题方法
3 . 我国科学家成功利用CO2和H2人工合成了淀粉,使淀粉的生产方式从农业种植转为工业制造成为可能,其原理如下图所示。下列说法不正确 的是
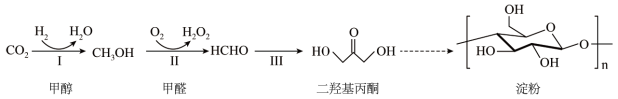
资料:部分物质的结构简式
二羟基丙酮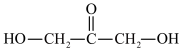 ;淀粉:
;淀粉: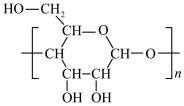

资料:部分物质的结构简式
二羟基丙酮
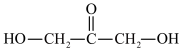 ;淀粉:
;淀粉:
A.CO2分子中σ键和π键个数比为 |
| B.甲醇沸点高于甲醛,是因为甲醇分子间能形成氢键 |
| C.淀粉分子中存在手性碳原子 |
| D.甲醇分子和二羟基丙酮分子中碳原子的杂化类型均为sp3 |
您最近一年使用:0次
名校
解题方法
4 . 下列现象与氢键有关的是
① 的熔、沸点比第
的熔、沸点比第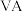 族其他元素氢化物的高
族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素 的熔、沸点比醋酸的高
的熔、沸点比醋酸的高
⑤郊羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
①
 的熔、沸点比第
的熔、沸点比第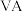 族其他元素氢化物的高
族其他元素氢化物的高②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素
 的熔、沸点比醋酸的高
的熔、沸点比醋酸的高⑤郊羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
| A.①②③⑤ | B.①②③④⑤ | C.①③④ | D.①③④⑤ |
您最近一年使用:0次
名校
解题方法
5 . 胆矾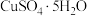 可写
可写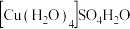 ,其结构示意图如下,关胆矾的说法正确的是
,其结构示意图如下,关胆矾的说法正确的是
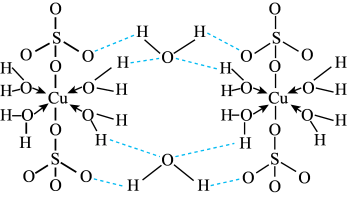
A.硫原子采取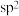 杂化 杂化 |
| B.氧原子参与形成配位键和氢键两种化学键 |
C. 价电子排布式为 价电子排布式为 |
| D.根据结构推测,胆矾中的水在不同温度下会分步失去 |
您最近一年使用:0次
名校
6 . 下列事实不能 用氢键解释的是
A.密度: | B.沸点: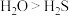 |
C.稳定性: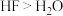 | D.溶解性(水中):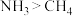 |
您最近一年使用:0次
2024-01-20更新
|
612次组卷
|
5卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
北京市西城区2023-2024学年高三上学期化学期末考试题北京市第十五中学2023-2024学年高二下学期期中考试化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)天津市河东区2024年高三下学期一模考试化学试题天津市南仓中学2024年高三下学期高考模拟化学试卷
名校
解题方法
7 . 含氮化合物具有非常广泛的应用.
(1)基态氮原子的电子有__________ 种空间运动状态.
(2)很多有机化合物中含有氮元素.
① 组成物质A的4种元素的电负性由大到小的顺序是_____________
②A的熔点高于B的原因是__________ .
(3)氮元素可以与短周期金属元素形成化合物. 是离子化合物,比较两种微粒的半径:
是离子化合物,比较两种微粒的半径:
_________  (填“>”、“<”或“=”).
(填“>”、“<”或“=”).
(4)氮元素可以与过渡金属元素形成化合物,其具备高硬度、高化学稳定性和优越的催化活性等性质.某三元氮化物是良好的超导材料,其晶胞结构如图所示.
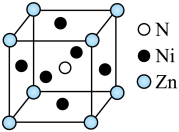
① 基态Ni原子价层电子的轨道表示式为___________ .
②与Zn原子距离最近且相等的Ni原子有___________ 个.
③ 表示阿伏加德罗常数的值.若此晶体的密度为
表示阿伏加德罗常数的值.若此晶体的密度为 ,则晶胞的边长为
,则晶胞的边长为________ nm.
(1)基态氮原子的电子有
(2)很多有机化合物中含有氮元素.
物质 | A(对氨基苯甲酸) | B(邻氨基苯甲酸) |
结构简式 |
|
|
熔点 | 188℃ | 145℃ |
作用 | 防晒剂 | 制造药物及香料 |
②A的熔点高于B的原因是
(3)氮元素可以与短周期金属元素形成化合物.
 是离子化合物,比较两种微粒的半径:
是离子化合物,比较两种微粒的半径:
 (填“>”、“<”或“=”).
(填“>”、“<”或“=”).(4)氮元素可以与过渡金属元素形成化合物,其具备高硬度、高化学稳定性和优越的催化活性等性质.某三元氮化物是良好的超导材料,其晶胞结构如图所示.

① 基态Ni原子价层电子的轨道表示式为
②与Zn原子距离最近且相等的Ni原子有
③
 表示阿伏加德罗常数的值.若此晶体的密度为
表示阿伏加德罗常数的值.若此晶体的密度为 ,则晶胞的边长为
,则晶胞的边长为
您最近一年使用:0次
名校
解题方法
8 . 下列说法正确的是
A.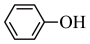 与 与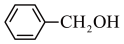 互为同系物 互为同系物 |
| B.室温下,在水中的溶解度:甘油>苯酚>1-氯丁烷 |
| C.相同压强下的沸点:乙醇>乙二醇>丙烷 |
| D.1mol 葡萄糖可水解生成2mol 乳酸(C3H6O3) |
您最近一年使用:0次
名校
解题方法
9 . 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)基态钛原子的电子排布式为___________
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为___________ (用元素符号表示);SO 的空间构型为
的空间构型为___________ ,其中S原子的杂化方式为___________ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是___________ (选填字母序号)。
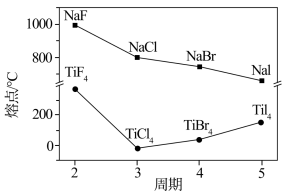
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
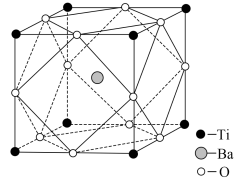
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为___________ ;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是___________ ;其晶胞参数约为a pm,钛酸钡晶体的密度ρ=___________ g·cm-3(阿伏加德罗常数的值为NA,1pm=1×10-12m)
(1)基态钛原子的电子排布式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为
 的空间构型为
的空间构型为(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是

a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为

您最近一年使用:0次
2023-12-28更新
|
217次组卷
|
2卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
名校
解题方法
10 . 有下列说法,①分子间作用力越大,分子越稳定;②离子化合物中只含有离子键;③共价化合物一定不含离子键;④氯化钠溶解于水时离子键未被破坏;⑤冰融化时水分子中的共价键发生了断裂;⑥水分子内含有氢键;⑦由分子构成的物质一定含有共价键;⑧离子化合物中不一定含有金属元素。其中不正确 的是
| A.①③④⑥⑦⑧ | B.①②④⑤⑥⑦ | C.②③④⑤⑥⑧ | D.①②④⑤⑥⑧ |
您最近一年使用:0次