名校
1 . 离子液体作为一类新型介质可实现 CO2 在温和条件下的高效捕获,某种离子液体 M捕获 CO2 机理如图所示。下列说法错误的是


| A.离子液体M 较容易吸收水分 |
| B.该捕获过程发生了氧化反应 |
| C.一个 CO2 分子中存在两个键和两个π键 |
| D.离子液体M 的粘度随着 R 链的增长而增大 |
您最近一年使用:0次
2020-12-28更新
|
151次组卷
|
2卷引用:辽宁省凌源市第二高级中学2021届高三上学期教学质量检测化学试题
名校
解题方法
2 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,第一电离能的大小顺序是___ 。根据对角线规则,B的一些化学性质与元素__ 的相似。
(2)NH3BH3分子中,N—B化学键称为__ 键,其电子对由__ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+B3O +9H2,B3O
+9H2,B3O 的结构如图所示:
的结构如图所示:
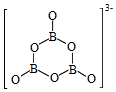
在该反应中,B原子的杂化轨道类型由___ 变为___ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性,与B原子相连的H呈负电性,电负性大小顺序是___ 。与NH3BH3原子总数相等的等电子体是___ (写分子式),其熔点比NH3BH3__ (填“高”或“低”),原因是___ 。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为apm、bpm、cpm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
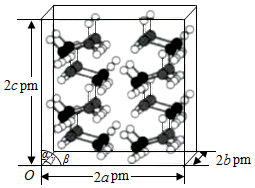
氨硼烷晶体的密度ρ=__ g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)H、B、N中,第一电离能的大小顺序是
(2)NH3BH3分子中,N—B化学键称为
 +9H2,B3O
+9H2,B3O 的结构如图所示:
的结构如图所示:
在该反应中,B原子的杂化轨道类型由
(3)NH3BH3分子中,与N原子相连的H呈正电性,与B原子相连的H呈负电性,电负性大小顺序是
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为apm、bpm、cpm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=
您最近一年使用:0次
3 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1mol•L-1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.W和Y形成的化合物一定只含离子键 |
| C.元素第一电离能:Z>W | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
2020-12-03更新
|
629次组卷
|
2卷引用:辽宁省大连市沙河口区辽宁师范大学附属中学2021届高三上学期10月模块考试化学试题
名校
4 . 类推的思维方法在化学学习与研究中可能会产生错误的结论。因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是( )
A.从CH4、 、 、 为正四面体结构,可推测 为正四面体结构,可推测 、 、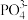 也为正四面体结构 也为正四面体结构 |
| B.H2O常温下为液态,H2S常温下也为液态 |
| C.金刚石中C-C键的键长为154.45 pm,C60中C-C键的键长为140~145 pm,所以C60的熔点高于金刚石 |
| D.MgCl2熔点较高,AlCl3熔点也较高 |
您最近一年使用:0次
2020-11-11更新
|
194次组卷
|
3卷引用:辽宁省沈阳市郊联体2021届高三上学期期中考试化学试题
名校
解题方法
5 . 铜及其化合物在生活和生产中有着广泛的应用。回答下列问题:
(1)基态铜原子价层电子排布式为___________________ ,基态铜原子有________ 种运动状态不相同的电子。
(2)单质铜是由_____________ 键形成的晶体。
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为_____________ 。
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: ;Cu2+的配位数为
;Cu2+的配位数为_____________ ,乙二胺沸点高于1,2﹣二氯乙烷(Cl-CH2-CH2-Cl)的主要原因是__________________ 。
(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为___________ 。
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于_______ (填“共价”或“离子”)化合物。
③已知该晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的 ,则该晶体中铜原子和氯原子之间的最短距离
,则该晶体中铜原子和氯原子之间的最短距离___________ cm(列计算式即可)。
(1)基态铜原子价层电子排布式为
(2)单质铜是由
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
 ;Cu2+的配位数为
;Cu2+的配位数为(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于
③已知该晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的
 ,则该晶体中铜原子和氯原子之间的最短距离
,则该晶体中铜原子和氯原子之间的最短距离
您最近一年使用:0次
2020-11-03更新
|
849次组卷
|
2卷引用:辽宁省大连市一〇三中学2021届高三一模考试化学试题
6 . 下列关于物质结构的说法错误的是
| A.晶格能:NaF>NaCl>NaBr |
| B.基态碳原子有三种能量不同的电子 |
C.CH4和 都是正四面体结构,键角均为109°28′ 都是正四面体结构,键角均为109°28′ |
| D.甲醛(HCHO)的键角约为120°,分子之间存在氢键 |
您最近一年使用:0次
2020-10-05更新
|
402次组卷
|
3卷引用:辽宁省新高考2021届高三上学期第三次调研化学试题
名校
解题方法
7 . 下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
您最近一年使用:0次
2020-09-11更新
|
617次组卷
|
33卷引用:辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题
辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题(已下线)2010-2011学年湖北省武汉市三角路中学高二下学期期中考试化学试卷(已下线)2011-2012学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2011-2012学年海南省海南中学高二下学期期末理科化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2013-2014广西桂林十八中高二下学期开学考试化学试卷(已下线)2014届江苏省启东中学第二学期期中考试高二化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷2016-2017学年四川省成都市石室佳兴外国语学校高二下学期第一次月考化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题宁夏银川市第一中学2016-2017学年高二下学期期末考试化学试题四川省乐山沫若中学2017-2018学年高二上学期第一次月考化学试题安徽省安庆市五校联盟2017-2018学年高二上学期期中联考化学试题甘肃省嘉峪关市一中2017-2018学年高二上学期期末考试化学(理)试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期4月月考化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题宁夏银川一中2018-2019学年高二下学期期末考试化学试题陕西省宝鸡中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题内蒙古自治区包头市北方重工业集团有限公司第三中学2019-2020学年高二下学期期中考试化学试题(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练山西省朔州市怀仁县大地学校2019-2020学年高二下学期第二次月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题(已下线)2.3.2 氢键 溶解性 分子的手性-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)河南省渑池高级中学2021-2022学年高二11月月考化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题山西省吕梁市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
8 . 下列有关性质的比较中,正确的是
| A.键的极性:N-H<O-H<F-H |
| B.第一电离能:Na<Mg<Al |
| C.硬度:白磷>冰>二氧化硅 |
D.熔点: > >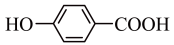 |
您最近一年使用:0次
2020-09-07更新
|
1025次组卷
|
7卷引用:辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷
辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷(已下线)第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)吉林省延边第二中学2020-2021学年高二下学期期中考试化学试题(已下线)第2章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)北京市房山区2021-2022学年高二下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测广东省广州市第十六中学2022-2023学年高二下学期5月月考化学试题
9 . 某一化合物分子式为AB2,A属于第VIA族元素,B属于第VIIA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98。下列推断不正确的是
| A.AB2分子的空间构型为V形 |
| B.A-B键为极性键,AB2分子为非极性分子 |
| C.AB2与水相比,AB2的熔沸点比水的熔沸点低 |
| D.A原子的杂化方式是sp3杂化 |
您最近一年使用:0次
解题方法
10 . 下列描述正确的是
| A.CS2为V形极性分子 |
| B.C2H2分子中σ键与π键的数目比为1:1 |
| C.当中心离子的配位数为6时,配离子常呈八面体结构 |
| D.水加热到很高温度都难分解是因水分子间存在氢键 |
您最近一年使用:0次



