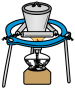
1 . 杯酚( )能够分离提纯C60与C70,其原理如图所示。下列说法错误的是
)能够分离提纯C60与C70,其原理如图所示。下列说法错误的是
 )能够分离提纯C60与C70,其原理如图所示。下列说法错误的是
)能够分离提纯C60与C70,其原理如图所示。下列说法错误的是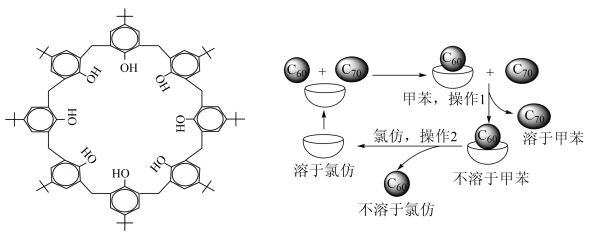
| A.操作1用到的主要玻璃仪器有普通漏斗、烧杯、玻璃棒 |
| B.杯酚与C60分子之间靠共价键结合形成超分子 |
| C.杯酚可溶于氯仿循环使用 |
| D.杯酚晶体属于分子晶体 |
您最近半年使用:0次
2023-05-25更新
|
508次组卷
|
6卷引用:山西省晋中市2023届高三下学期5月普通高等学校招生模拟(三模)理科综合化学试题(A卷)
山西省晋中市2023届高三下学期5月普通高等学校招生模拟(三模)理科综合化学试题(A卷)(已下线)考点巩固卷06 物质结构与性质(4大考点55题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第15讲物质的检验、分离和提纯河南省商丘名校联考2022-2023学年高二下学期7月期末考试化学试题黑龙江省大庆铁人中学2023-2024学年高二下学期开学考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二下学期4月月考化学试题
2023·浙江绍兴·模拟预测
2 . 硫代硫酸钠(Na2S2O3∙5H2O)俗称大苏打,主要用作照相业定影剂。实验室中用工业硫化钠、纯碱、二氧化硫等物质制备硫代硫酸钠晶体的流程如下:

已知:
①工业硫化钠含有重金属硫化物、煤粉等杂质而呈红褐色或棕黑色。硫化钠易溶于水,微溶于乙醇,能溶于热的乙醇。
②用硫化钠制备硫代硫酸钠的反应大致可分为三步进行:


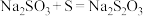
③Na2S2O3∙5H2O易溶于水,难溶于乙醇,50℃开始失去结晶水
请回答:
(1)步骤Ⅰ回流用到的主要玻璃仪器有圆底烧瓶和___________ ;回流适用的加热方式是___________ 。
A.水浴加热 B.油浴加热 C.酒精灯直接加热 D.电热套温和加热
(2)步骤Ⅱ趁热过滤的目的是___________ 。
(3)步骤Ⅳ、Ⅴ制备Na2S2O3∙5H2O的装置如图所示:
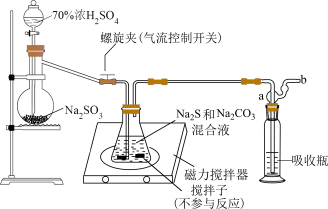
①锥形瓶中发生总反应的化学方程式为___________ ;反应中Na2CO3固体的用量不宜过少,理由是___________ 。
②步骤Ⅴ,当锥形瓶中溶液pH≈7时应停止通入SO2,若继续通入SO2,将导致产率降低,理由是___________ 。
(4)步骤Ⅵ,选出获取Na2S2O3∙5H2O晶体过程中合理的操作并排序:________
过滤,取滤液→___________→___________→___________→___________→___________→40℃下干燥40~60分钟→产品。
a.蒸发浓缩至产生细密的气泡且溶液表面出现晶膜
b.蒸发浓缩至大量晶体析出
c.停止加热,自然冷却
d.加乙醇洗涤晶体2~3次
e.过滤
f.加入乙醇,促使晶体快速析出

已知:
①工业硫化钠含有重金属硫化物、煤粉等杂质而呈红褐色或棕黑色。硫化钠易溶于水,微溶于乙醇,能溶于热的乙醇。
②用硫化钠制备硫代硫酸钠的反应大致可分为三步进行:


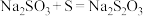
③Na2S2O3∙5H2O易溶于水,难溶于乙醇,50℃开始失去结晶水
请回答:
(1)步骤Ⅰ回流用到的主要玻璃仪器有圆底烧瓶和
A.水浴加热 B.油浴加热 C.酒精灯直接加热 D.电热套温和加热
(2)步骤Ⅱ趁热过滤的目的是
(3)步骤Ⅳ、Ⅴ制备Na2S2O3∙5H2O的装置如图所示:

①锥形瓶中发生总反应的化学方程式为
②步骤Ⅴ,当锥形瓶中溶液pH≈7时应停止通入SO2,若继续通入SO2,将导致产率降低,理由是
(4)步骤Ⅵ,选出获取Na2S2O3∙5H2O晶体过程中合理的操作并排序:
过滤,取滤液→___________→___________→___________→___________→___________→40℃下干燥40~60分钟→产品。
a.蒸发浓缩至产生细密的气泡且溶液表面出现晶膜
b.蒸发浓缩至大量晶体析出
c.停止加热,自然冷却
d.加乙醇洗涤晶体2~3次
e.过滤
f.加入乙醇,促使晶体快速析出
您最近半年使用:0次
2023·浙江金华·模拟预测
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元聚合物锂电池的正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下图所示:
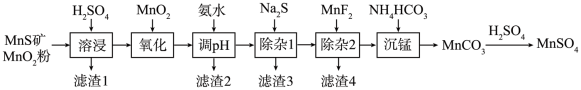
相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答:
(1)“溶浸”步骤中,可加快溶浸速率的措施有___________ (写两条)。
(2)下列有关该工艺流程的叙述正确的是___________。
(3)“除杂2”步骤的目的是生成MgF2沉淀从而除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,请从平衡移动的角度解释其原因___________ 。
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。______
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
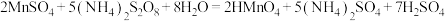
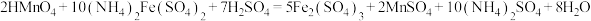 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
用___________ 称量 MnSO4样品0.250g→用100mL容量瓶将MnSO4样品配成100mL溶液→用___________ 取待测液25.00mL于锥形瓶中→加入适量硫磷混合酸和硝酸银,再加入足量过硫酸铵充分反应→加热煮沸除去多余的过硫酸铵→用酸式滴定管盛装0.1000mol/L(NH4)2Fe(SO4)2标准溶液,滴定3次,分别消耗20.04mL、19.30mL、19.96mL。
②根据以上数据计算样品中MnSO4的质量分数___________ 。

相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”步骤中,可加快溶浸速率的措施有
(2)下列有关该工艺流程的叙述正确的是___________。
| A.“溶浸”步骤中的“滤渣1”的主要成分是S和SiO2(或不溶性硅酸盐) |
| B.“氧化”步骤中添加的MnO2的作用是催化剂 |
| C.“调pH”步骤中,溶液的pH范围应调节为4.7~6 |
D.“沉锰”步骤的离子方程式为 |
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
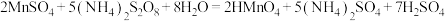
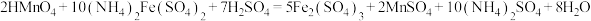 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:用
②根据以上数据计算样品中MnSO4的质量分数
您最近半年使用:0次
4 . 从废定影液(主要含有 、
、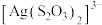 、
、 、
、 中回收Ag和
中回收Ag和 的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关说法正确的是
,用苯萃取分液。下列有关说法正确的是
 、
、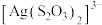 、
、 、
、 中回收Ag和
中回收Ag和 的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关说法正确的是
,用苯萃取分液。下列有关说法正确的是| A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体 |
B.配制 溶液时,向其中加入少量NaOH溶液, 溶液时,向其中加入少量NaOH溶液, 的值增 大 的值增 大 |
C.灼烧 生成Ag和 生成Ag和 ,该反应每生成1mol Ag转移3mol电子 ,该反应每生成1mol Ag转移3mol电子 |
| D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层 |
您最近半年使用:0次
2023-05-12更新
|
646次组卷
|
3卷引用:山东省聊城市2023届高考一模化学试题
5 . 实验室提供的玻璃仪器有酒精灯、烧杯、量筒、玻璃棒、胶头滴管、分液漏斗(非玻璃仪器任选),选用上述仪器不能完成的实验是
| A.重结晶法提纯苯甲酸 |
| B.分离乙酸乙酯和饱和碳酸钠溶液 |
| C.制备氢氧化铁胶体 |
| D.配制质量分数为20%的氯化钠溶液 |
您最近半年使用:0次
6 . 利用硫钨矿(主要成分是CaWO4,还含有FeS、SiO2等)制取Na2WO4和单质硅的工艺生产流程如图。已知:常温下,Ksp(CaWO4)=1.0×10-8,Ksp(CaCO3)=1.0×10-9。
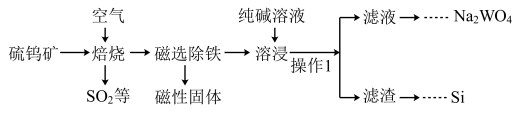
下列说法正确的是

下列说法正确的是
A.焙烧时发生反应的方程式为4FeS+7O2 2Fe2O3+4SO2 2Fe2O3+4SO2 |
| B.滤渣的主要成分是Si和CaCO3 |
| C.“溶浸”时,可以用烧碱溶液代替纯碱溶液 |
D.若滤渣中含有CaWO4,则滤液中c( )=10c( )=10c( ) ) |
您最近半年使用:0次
2023·海南·一模
7 . 《伤寒论》叙述如下“柴胡、黄芩、生姜……共七味,以水一斗二升,煮取六升,去滓,再煎,取三升,温服一升,日三服。”其中不涉及 的操作是
| A.加热 | B.过滤 | C.浓缩 | D.蒸馏 |
您最近半年使用:0次
解题方法
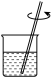
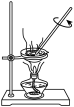
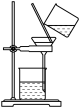
8 . 实验室用粗盐为原料制备精盐的操作中,下列不需要使用的装置是
 |  |  |  |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
9 . 检验黑木耳中铁离子的步骤为:灼烧黑木耳→加酸溶解→过滤→取滤液检验,所选择的装置(夹持装置已略去)或操作不正确的是
|
|
|
|
| A.灼烧黑木耳 | B.加酸后搅拌溶解 | C.过滤得滤液 | D.检验铁离子 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-05-04更新
|
1105次组卷
|
7卷引用:广东省梅州市2022-2023学年高一上学期1月期末化学试题
广东省梅州市2022-2023学年高一上学期1月期末化学试题广东省惠州市2024届高三第一次调研考试化学试题(已下线)考点2 物质的分离、提纯、检验与鉴别 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题 广东省深圳市福田区福田中学2023-2024学年高三上学期12月月考化学考试海南省海南中学2023-2024学年高三下学期第6次月考化学试题2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
10 . 我省为沿海省份,海洋中有丰富的食品、矿产、能源、药物和水产等资源,海水资源的综合利用可以用下图表示。
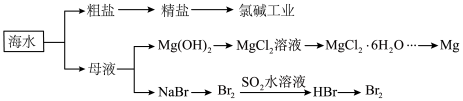
下列装置应用于母液的处理,不能达到实验目的的是
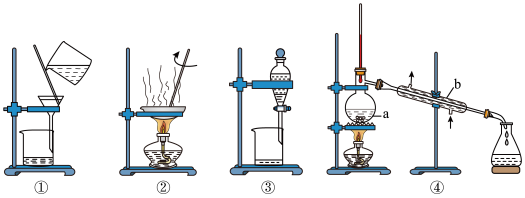

下列装置应用于母液的处理,不能达到实验目的的是

| A.用①装置将母液中的Mg(OH)2和NaBr分开 |
| B.用②装置蒸干氯化镁溶液获得 MgCl2·6H2O |
| C.用③装置CCl4能使水溶液中Br2富集,再通过分液操作获得Br2的CCl4溶液 |
| D.用④装置从Br2的CCl4溶液中分离出较纯的Br2 |
您最近半年使用:0次