名校
解题方法
1 . 关于实验室制备、分离乙酸乙酯的装置,说法正确的是

| A.图甲用于分离乙酸乙酯 |
| B.乙用于蒸馏纯化乙酸乙酯 |
| C.图丙可从分液漏斗下端放出乙酸乙酯 |
| D.图丁用于制备并收集乙酸乙酯 |
您最近半年使用:0次
解题方法
2 . 玻璃棒是化学实验中的常用仪器。下列有关玻璃棒的使用不合理的是
A. | B. |
C.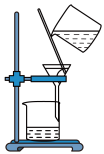 | D.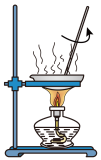 |
您最近半年使用:0次
名校
3 . 下列实验操作或装置正确的是

A.图甲可用于实验室制备 |
| B.图乙装置可用于完成过滤操作 |
| C.图丙可用于验证氨气在水中的溶解性 |
| D.图丁表示为配制一定物质的量浓度NaOH溶液时称量溶质的操作 |
您最近半年使用:0次
2024-02-23更新
|
216次组卷
|
4卷引用:四川省成都市成华区列五中学2023-2024学年高一下学期4月月考化学试题
4 . 下列实验中仪器使用合理的是
| A.用镊子夹持铁丝在氯气中燃烧 | B.用坩埚蒸发食盐水得 固体 固体 |
| C.用分液漏斗、铁架台、烧杯完成过滤操作 | D.透过蓝色钴玻璃观察钾元素的焰色 |
您最近半年使用:0次
5 . Ⅰ.现有下列物质:①蔗糖、②Na2CO3溶液、③稀硫酸、④CO2、⑤CuSO4·5H2O固体、⑥石墨棒、⑦含泥沙的氯化钠溶液、⑧淀粉溶液
(1)属于电解质的是___________ (填序号,下同),属于非电解质的是___________ 。
(2)除去⑦中的泥沙杂质的实验操作方法是___________ 。
(3)将气体④通入②会发生化学反应,其化学方程式为___________ 。
Ⅱ.央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(4)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________ 价。Fe(CrO2)2属于___________ (填“酸”、“碱”、“盐”或“氧化物”)。
(5)明胶的水溶液和K2SO4溶液共同具备的性质是___________(填序号)。
(1)属于电解质的是
(2)除去⑦中的泥沙杂质的实验操作方法是
(3)将气体④通入②会发生化学反应,其化学方程式为
Ⅱ.央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(4)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是
(5)明胶的水溶液和K2SO4溶液共同具备的性质是___________(填序号)。
| A.都不稳定,密封放置会产生沉淀 | B.分散质粒子可通过滤纸 |
| C.分散质粒子可通过半透膜 | D.二者均有丁达尔效应 |
您最近半年使用:0次
名校
6 . 实验室有一包含锰混合物样品,可能含有MnO2(63.2%,难溶于水),MnO(77.5%,难溶于水),MnCO3(47.8%,难溶于水)和MnCl2(43.7%,易溶于水)(括号内是该物质锰元素质量分数)中的一种或几种,为测定其中锰元素的含量,小明查阅资料设计了如下流程。请回答下列问题:

(1)操作X是_______ 。
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是_______ 。
(3)“氧化”步骤的离子方程式是_______ ,上述流程中能够循环利用的物质是_______ 。
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为_______ (保留1位小数)。李华经过分析认为上述结果存在问题,理由是_______ ,经过检查,原来是小明忘记了操作X处所得的MnO2。

(1)操作X是
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是
(3)“氧化”步骤的离子方程式是
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为
您最近半年使用:0次
7 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
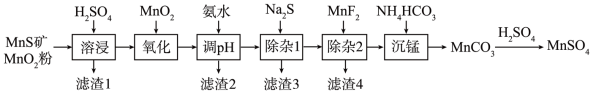
相关金属离子[c0(Mn+)=0.1mol∙L-1]形成氢氧化物沉淀的 pH范围如表:
(1)“滤渣1”含有S和_______ ; 写出“溶浸”中二氧化锰与硫化锰反应的化学方程式为_______
(2)“氧化”中添加适量的MnO2的作用是将 Fe2+氧化为 Fe3+,写出该反应的离子方程式为_______ 。
(3)调pH范围为4.7~6,滤渣2成分的化学式为_________ 。
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是__________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(6)写出“沉锰”的离子方程式_______
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4 当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1mol∙L-1]形成氢氧化物沉淀的 pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe³⁺ | Al3⁺ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将 Fe2+氧化为 Fe3+,写出该反应的离子方程式为
(3)调pH范围为4.7~6,滤渣2成分的化学式为
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4 当x=y=
 时,z=
时,z=
您最近半年使用:0次
8 . 氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。粗盐中一般含有 、
、 、
、 和
和 杂质。粗盐制得精盐的过程如下:
杂质。粗盐制得精盐的过程如下:

下列说法错误的是
 、
、 、
、 和
和 杂质。粗盐制得精盐的过程如下:
杂质。粗盐制得精盐的过程如下:
下列说法错误的是
A.试剂I是足量 溶液 溶液 |
| B.操作a所需的玻璃仪器有烧杯、漏斗、玻璃棒 |
C.试剂II为碳酸钠,其作用为除去溶液中的 和 和 |
| D.用pH试纸检验溶液B,可发现溶液B显碱性 |
您最近半年使用:0次
2023-11-10更新
|
362次组卷
|
6卷引用:四川省雅安市2023-2024学年高一上学期期中考试化学试题
9 . 己二酸是一种重要的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用。
Ⅰ.反应原理(图甲):

Ⅱ.反应装置图(图乙):
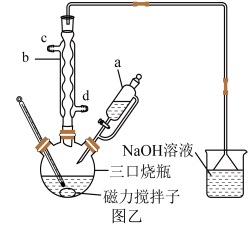
Ⅲ.反应步骤:
①在仪器a中加入环己醇,三口烧瓶中加入浓硝酸(适当过量),开启磁力搅拌,并通入冷凝水,打开仪器a的活塞,缓慢滴加环己醇。
②控制反应温度为80℃至反应结束,按顺序拆除导气吸收装置和冷凝回流装置,取下三口烧瓶,置于冰水中冷却20min以上,然后进行抽滤,用少量的冰水洗涤滤饼,即可制得己二酸粗品。
回答下列问题:
(1)加入实验药品前应进行的操作为___________ 。
(2)仪器a中的支管的用途为___________ 。
(3)仪器b的名称为___________ ,冷凝水的进水口为___________ (填“c”或“d”)。
(4)本实验最好在通风橱中进行,其原因是___________ 。
(5)写出己二酸与过量乙醇酯化反应的化学方程式___________ 。
(6)本实验需严格控制反应温度为80℃左右,温度过高可能产生的后果是___________ (写出一点即可)。
(7)己二酸可发生下列哪些反应类型___________ 。
a. 取代反应 b. 氧化反应 c. 消去反应 d. 加聚反应
Ⅰ.反应原理(图甲):

Ⅱ.反应装置图(图乙):

Ⅲ.反应步骤:
①在仪器a中加入环己醇,三口烧瓶中加入浓硝酸(适当过量),开启磁力搅拌,并通入冷凝水,打开仪器a的活塞,缓慢滴加环己醇。
②控制反应温度为80℃至反应结束,按顺序拆除导气吸收装置和冷凝回流装置,取下三口烧瓶,置于冰水中冷却20min以上,然后进行抽滤,用少量的冰水洗涤滤饼,即可制得己二酸粗品。
回答下列问题:
(1)加入实验药品前应进行的操作为
(2)仪器a中的支管的用途为
(3)仪器b的名称为
(4)本实验最好在通风橱中进行,其原因是
(5)写出己二酸与过量乙醇酯化反应的化学方程式
(6)本实验需严格控制反应温度为80℃左右,温度过高可能产生的后果是
(7)己二酸可发生下列哪些反应类型
a. 取代反应 b. 氧化反应 c. 消去反应 d. 加聚反应
您最近半年使用:0次
10 . 从海带中提取碘的实验过程中,涉及下列操作,其中正确的是


| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
您最近半年使用:0次
2023-08-03更新
|
807次组卷
|
90卷引用:2013届四川省乐山市高三“一调”考试理综化学试卷
(已下线)2013届四川省乐山市高三“一调”考试理综化学试卷四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二下学期10月月考化学试题四川省成都外国语学校2021-2022学年高一上学期期中化学试题四川省安岳县兴隆中学2020-2021学年高一上学期9月月考化学试题(已下线)2010年上海市虹口区高三第二次模拟考试化学试题(已下线)09~10年泰州中学高一下学期期末考试化学卷(已下线)2011届上海市卢湾区高三上学期期末考试化学试卷(已下线)2011-2012学年浙江省余姚中学高一上学期期中化学(理)试卷(化学实验班)(已下线)2013届湖北省黄冈中学高三10月月考化学试卷(已下线)2013届广东省珠海市高三5月综合测试(二)理综化学试卷(已下线)2013届上海市四区(杨浦、青浦、宝山、静安)高三下学期二模化学试卷(已下线)2014届湖北省襄阳市襄州一中等四校高三上学期期中联考化学试卷(已下线)2013-2014学年江苏省南京市高淳区高一上学期期末考试化学试卷(已下线)2013-2014上海市静安区第二学期高二学业水平测试化学试卷(已下线)2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(已下线)2014届浙江省杭州外国语学校高二第二学期期中考试化学试卷 2014-2015河北省唐山一中高一上学期第二次月考化学试卷2015-2016学年山东省淄博市淄川一中高一上学期期中测试化学试卷2016届陕西省西北农林科技大学附属中学高三上学期期中化学试卷2015-2016学年山东省淄博五中高一下开学收心考试化学试卷2015-2016学年浙江省杭州市西湖高中高二5月月考化学试卷2015-2016学年湖南常德一中高一下期末化学试卷2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2017届湖南省岳阳市华容县四校高三联考二化学试卷2017届新疆哈密地区第二中学高三上月考二化学卷2016-2017学年黑龙江双鸭山一中高一上期中考试化学试卷2016-2017学年广西桂林中学高一上学期段考化学卷(已下线)同步君 必修2 第4章 第1节 海水资源的开发利用2016-2017学年河北省承德一中高一上学期月考二化学试卷 2016-2017学年广东省肇庆市高一上学期期末化学试卷福建省三明市第一中学2016-2017学年高二下学期第二次月考化学试题甘肃省武威市第六中学2016-2017学年高一下学期期末考试化学试题黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题甘肃省会宁县第四中学2018届高三上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一上学期期中考试化学试题(B)高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用浙江省诸暨中学2017-2018学年高二上学期第二阶段考试化学试题(已下线)2018年5月23日 海带提碘——《每日一题》2017-2018学年高一化学人教必修2云南省景东县第一中学2017-2018学年高一下学期6月份考试化学试题河南省驻马店经济开发区高级中学2018-2019学年高一上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高一上学期期中考试化学试题云南省普洱市景东一中2018-2019学年高一上学期期末考试化学试题江西省南昌市第十中学2018-2019学年高一下学期期末考试化学试题内蒙古开来中学2018-2019学年高一下学期期末考试化学试题(已下线)2019年8月18日 《每日一题》 (一轮复习) 每周一测海南省海口第四中学2018-2019学年高一下学期期末(选考)化学试题上海市浦东新区2016-2017学年高一上学期期末考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高一上学期期中考试化学试题湖南省麓山国际学校人教版高中化学必修2检测第四章单元检测2020届高三化学二轮微专题突破训练:物质的检验、分离与提纯(已下线)上海市静安区2012-2013学年高二下学期期中教学质量检测化学试题(已下线)上海卢湾区2011届高三一模化学试题(已下线)上海市奉贤区2012届高三上学期期末调研测试化学试题(已下线)上海市闸北区2010届高三第二次模拟考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期第三次月考化学试题辽宁省营口市部分重点高中2017-2018学年高二下学期期末考试化学试题甘肃省武威市民勤县第一中学2019-2020学年高一下学期期末考试(理)化学试题重庆市主城区七校2019-2020学年高一下学期期末考试化学试题海南省海口市海南枫叶国际学校2019-2020学年高一下学期期中考试化学试题海南省海口市海南枫叶国际学校2019-2020学年高一下学期期末考试化学试题黑龙江省牡丹江市第一高级中学2020-2021学年高二上学期8月开学考试化学试题河北省张家口市第一中学2019-2020学年高二上学期开学考试化学试题(实验班)山东省临沂市2019-2020学年高一下学期期末考试化学试题湖南省长沙市雨花区2017-2018学年高一下学期期末考试化学试题云南省曲靖市第二中学学联体2019-2020学年高二下学期联合考试(第四次)化学试题河南省南阳市第一中学2020-2021学年高一上学期第一次月考化学试题内蒙古包头市第一中学2020-2021学年高一上学期10月月考化学试题甘肃省临夏中学2020-2021学年高一上学期期中考试化学试题湖南省娄底市2020-2021学年高二上学期期中考试化学试题上海市杨浦高级中学2019-2020学年高一上学期期末考化学试题(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用江苏省南京市高淳高级中学2021届高三10月阶段性检测化学试题上海市黄浦区向明中学2020-2021学年高一上学期期末化学试题黑龙江省大庆市铁人中学2020-2021学年高二上学期期末考试化学试题山东省枣庄市第八中学2020-2021学年高一4月月考化学试题山东省济南市第一中学2020-2021学年高一下学期期中考试化学试题(等级考)(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市第二十中学2020-2021学年高一下学期期末考试化学试题贵州省遵义市2021 2022学年高二上学期第一次月考化学试题山东省东营市广饶县第一中学2021-2022学年高一3月线上检测化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)河北省张家口市张北县第一中学2021-2022学年高一下学期6月月考化学试题(已下线)第八章 化学与可持续发展(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)专题突破卷12 化学实验基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)陕西省宝鸡市金台区2022-2023学年高一下学期期末考试化学试题河北省唐县第一中学2023-2024学年高一上学期10月月考化学试题广东省佛山市第四中学2023-2024学年上学期高二开学考试化学试题第1课时 金属矿物、海水资源的开发利用1(已下线)第八章 化学与可持续发展【单元测试B卷】



