名校
1 . 某小组利用一定浓度 溶液制备
溶液制备 ,再用
,再用 氧化
氧化 ,并检验氧化产物。
,并检验氧化产物。
Ⅰ.制备 。
。
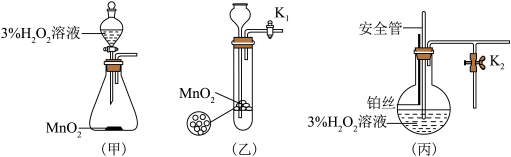
该小组同学设计了如下气体发生装置(夹持装置省略)___________ 。
(2)乙装置中,用粘合剂将 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入3%
,经长颈漏斗向试管中缓慢加入3% 溶液至
溶液至___________ ,欲使反应停止,关闭活塞 即可,此时装置中的现象是
即可,此时装置中的现象是___________ 。
(3)丙装置中盛装3% 溶液的仪器名称为
溶液的仪器名称为___________ 。丙装置可用于制备较多 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的 含量高、杂质种类少
含量高、杂质种类少
Ⅱ.氧化 。
。
该小组同学设计的氧化 的装置如图(夹持装置省略)
的装置如图(夹持装置省略)___________ 。
②乙醇催化氧化的化学方程式为___________ 。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
已知:a.乙醛的结构简式为 。
。
b.乙醛的官能团为醛基( ),常温下能使酸性
),常温下能使酸性 溶液褪色;加热条件下,能与新制
溶液褪色;加热条件下,能与新制 悬浊液反应生成砖红色沉淀(
悬浊液反应生成砖红色沉淀( )。
)。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
 溶液制备
溶液制备 ,再用
,再用 氧化
氧化 ,并检验氧化产物。
,并检验氧化产物。Ⅰ.制备
 。
。该小组同学设计了如下气体发生装置(夹持装置省略)
(2)乙装置中,用粘合剂将
 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入3%
,经长颈漏斗向试管中缓慢加入3% 溶液至
溶液至 即可,此时装置中的现象是
即可,此时装置中的现象是(3)丙装置中盛装3%
 溶液的仪器名称为
溶液的仪器名称为 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的
 含量高、杂质种类少
含量高、杂质种类少Ⅱ.氧化
 。
。该小组同学设计的氧化
 的装置如图(夹持装置省略)
的装置如图(夹持装置省略)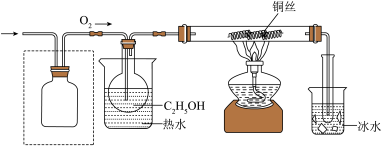
②乙醇催化氧化的化学方程式为
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
已知:a.乙醛的结构简式为
 。
。b.乙醛的官能团为醛基(
 ),常温下能使酸性
),常温下能使酸性 溶液褪色;加热条件下,能与新制
溶液褪色;加热条件下,能与新制 悬浊液反应生成砖红色沉淀(
悬浊液反应生成砖红色沉淀( )。
)。| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性 溶液 溶液 | 紫色褪去 | 产物含有乙醛 |
| ② | 新制 悬浊液,加热 悬浊液,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的 溶液 溶液 | 微红色褪去 | 产物可能含有乙酸 |
您最近一年使用:0次
2023-06-01更新
|
139次组卷
|
2卷引用:吉林省长春市吉大附中实验学校2022-2023学年高一下学期期中考试化学试题
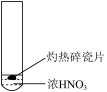
2 . 为探究木炭与浓硝酸的反应原理,某同学设计如下四组实验,发现所有实验过程均有红棕色气体产生,不考虑空气对反应的影响,下列说法错误的是
|
|
|
|
| ① | ② | ③ | ④ |
| A.所有实验产生的气体均为混合物 |
| B.③和④中生成的气体成分可能相同 |
| C.②中红棕色气体全部为木炭与浓硝酸反应产生 |
| D.①说明浓硝酸不稳定受热易分解 |
您最近一年使用:0次
2023-05-27更新
|
380次组卷
|
2卷引用:吉林省长春市第五中学2023-2024学年高一下学期第一学程考试化学试题
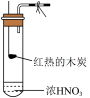
3 . 过多的NOx排放,往往会产生污染。某研究性小组探究 与炽热的铜粉反应,设计如下
与炽热的铜粉反应,设计如下
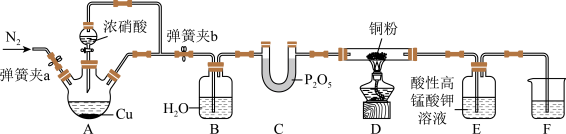
已知: 能被酸性高锰酸钾溶液氧化成NO
能被酸性高锰酸钾溶液氧化成NO ,此体系中产生的NO
,此体系中产生的NO 浓度较稀。
浓度较稀。
(1)实验开始前,检查装置气密性涉及到以下操作,给出合理的操作顺序:将F中的长导管插入液面以下→_______→_______→_______→_______→_______ (操作可重复使用)。
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象 ③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用_______ 。
(3)反应一段时间后,装置D中铜粉变黑,写出装置D中发生反应的化学方程式_______ 。
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为_______ ;
(5)实验前和实验结束时,都需通一段时间的 ,目的分别是
,目的分别是_______ 、_______ 。
(6)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中不可行 的是_______。
 与炽热的铜粉反应,设计如下
与炽热的铜粉反应,设计如下
已知:
 能被酸性高锰酸钾溶液氧化成NO
能被酸性高锰酸钾溶液氧化成NO ,此体系中产生的NO
,此体系中产生的NO 浓度较稀。
浓度较稀。(1)实验开始前,检查装置气密性涉及到以下操作,给出合理的操作顺序:将F中的长导管插入液面以下→_______→_______→_______→_______→____
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象 ③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用
(3)反应一段时间后,装置D中铜粉变黑,写出装置D中发生反应的化学方程式
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为
(5)实验前和实验结束时,都需通一段时间的
 ,目的分别是
,目的分别是(6)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中
| A.加热该绿色溶液,观察颜色变化 |
| B.加水稀释绿色溶液,观察颜色变化 |
| C.向该绿色溶液中通入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
您最近一年使用:0次
名校
解题方法
4 .  的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:

已知 与
与 、
、 在溶液中存在以下平衡:
在溶液中存在以下平衡: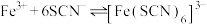 (红色);
(红色);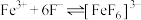 (无色)。
(无色)。
下列说法不正确的是
 的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 、
、 、
、 、
、 等形成配离子使溶液显色。如:显浅紫色的
等形成配离子使溶液显色。如:显浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
已知
 与
与 、
、 在溶液中存在以下平衡:
在溶液中存在以下平衡: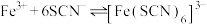 (红色);
(红色);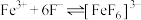 (无色)。
(无色)。下列说法不正确的是
A.Ⅰ中溶液呈黄色可能是由 水解产物的颜色引起的 水解产物的颜色引起的 |
B. 与 与 的配位能力强于 的配位能力强于 |
C.为了能观察到溶液Ⅰ中 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
| D.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色 |
您最近一年使用:0次
2023-03-25更新
|
590次组卷
|
8卷引用:吉林省长春外国语学校2022-2023学年高二下学期3月月考化学试题
名校
解题方法
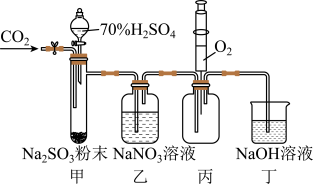
5 . 实验室用如下图所示装置探究 与
与 溶液的反应(实验前先通入
溶液的反应(实验前先通入 排除装置中的空气)。下列说法不正确的是
排除装置中的空气)。下列说法不正确的是
 与
与 溶液的反应(实验前先通入
溶液的反应(实验前先通入 排除装置中的空气)。下列说法不正确的是
排除装置中的空气)。下列说法不正确的是
A.用装置甲产生 |
B.装置乙中无明显现象,则 与 与 未发生反应 未发生反应 |
C.装置丙中注入 ,产生红棕色气体,说明装置乙中 ,产生红棕色气体,说明装置乙中 发生了氧化反应 发生了氧化反应 |
| D.装置丁吸收尾气并防止空气进入装置丙 |
您最近一年使用:0次
2023-03-23更新
|
1327次组卷
|
7卷引用:吉林省长春市第八中学2022-2023学年高一下学期4月考试化学试题
6 . 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”,请回答该实验中的问题。_______ ,该反应的氧化剂是_______ 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是_______ ;烧瓶底部放置了几片碎瓷片,其作用是_______ 。
(3)酒精灯和酒精喷灯点燃的顺序是先点燃_______ 。
(4)试管中收集气体是_______ ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行_______ 。
(5)若该反应中有16.8gFe参加反应,则生成H2的质量为_______ g。
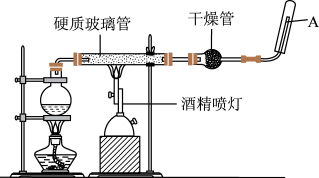
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是
(3)酒精灯和酒精喷灯点燃的顺序是先点燃
(4)试管中收集气体是
(5)若该反应中有16.8gFe参加反应,则生成H2的质量为
您最近一年使用:0次
2023-03-02更新
|
132次组卷
|
2卷引用:吉林省洮南市第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 某兴趣小组为了探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是
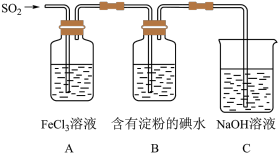
| A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 |
| B.装置C的作用是吸收SO2尾气,防止污染空气 |
| C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫色褪去 |
| D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
您最近一年使用:0次
2023-02-21更新
|
922次组卷
|
55卷引用:2015-2016学年吉林省松原市油田高中高二下期末化学试卷
2015-2016学年吉林省松原市油田高中高二下期末化学试卷(已下线)2014年高考化学鲁科版3.3硫的转化练习卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届黑龙江省牡丹江高级中学高三10月月考化学卷2017届河北省衡水中学高三上期中化学卷2017届山东省莱芜一中高三上学期10月月考化学试卷2017届河南省南阳一中高三上第三次周考化学卷福建省泰宁第一中学2018届高三上学期第一阶段考试化学试题宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【押题专练】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期中考试化学试题山东省东营市第二中学2019届高三上学期模块考试(期中)化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题云南省西畴县二中2019-2020学年高二上学期开学考试化学试题安徽省滁州市定远县重点中学2018-2019学年高一上学期期末考试化学试题苏教版高中化学必修1专题4《硫 氮可持续发展》测试卷云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高一上学期期末考试化学试题河南省商丘市第一高级中学2020届高三上学期期中考试化学试题河南省开封市第二十五中2019-2020高一下学期初分科考试化学试卷(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题(已下线)4.2.1 含硫物质之间的转化(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)河南省林州市第一中学2021-2022学年高一下学期开学检测化学试题课后-5.1.3 不同价态含硫物质的转化-人教2019必修第二册广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期期中考试化学试题上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题湖北省公安县第三中学2021-2022学年高三上学期8月质量检测化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省阜阳市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省安庆市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题广东省广州市培英中学2022-2023学年高一下学期期中考试化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一下学期开学考试化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题
8 . 向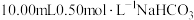 溶液中滴加不同浓度的
溶液中滴加不同浓度的 溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
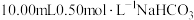 溶液中滴加不同浓度的
溶液中滴加不同浓度的 溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是| 实验 | 序号 | 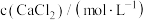 | 滴加 溶液时的实验现象 溶液时的实验现象 | 加热浑浊液时的实验现象 |
 溶液 溶液 | ① | 0.05 | 至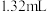 时产生明显浑浊,但无气泡产生 时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
| ② | 0.005 | 至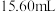 时产生明显浑浊,但无气泡产生 时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
| ③ | 0.0005 | 至 未见浑浊 未见浑浊 | — |
A.①中产生浑浊的原因是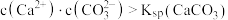 |
B.未加热前①和②中发生了反应: |
C.加热浊液产生气泡主要是因为 受热分解产生了更多的 受热分解产生了更多的 |
D.向上述 溶液中加入足量 溶液中加入足量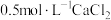 溶液,可能同时产生浑浊和气泡 溶液,可能同时产生浑浊和气泡 |
您最近一年使用:0次
2023-02-03更新
|
327次组卷
|
14卷引用:2024届吉林省长春市高三下学期质量监测(四)化学试题
2024届吉林省长春市高三下学期质量监测(四)化学试题北京市海淀区2020届高三上学期期末考试化学试题北京市八一学校2019-2020学年高二下学期期末考试化学试题湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题江苏省常熟市2021-2022学年高三上学期阶段性抽测一化学试题江苏省盐城市阜宁中学2021-2022学年高三下学期第三次综合测试化学试题北京市第八中学2021-2022学年高二上学期期末考试化学试题北京十中2022-2023学年高三上学期期末统练3化学试题浙江省衢州五校联盟2022-2023学年高二上学期期末联考(普通班)化学试题(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用(已下线)T13-实验方案的设计与评价浙江省衢温“5+1”联盟2022-2023学年高二上学期期末联考化学试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题
9 . 学习小组在实验室中利用下图所示装置制备SO2并进行相关性质的探究。回答下列问题:
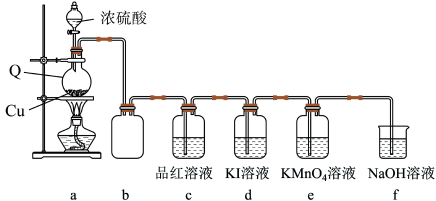
(1)仪器Q的名称为_______ ;装置c中品红溶液褪色,可证明SO2具有_______ 性,装置b的作用是_______ 。
(2)向分液漏斗中滴加浓硫酸之前,需先通入一段时间N2,此操作的目的是_______ 。
(3)装置a中反应的化学方程式为_______ 。
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O= +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴_______ 溶液(填试剂名称),振荡,无明显变化,浊液中无I2。
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,_______ ,出现白色沉淀,产物溶液中存在 。
。
综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为_______ 。

(1)仪器Q的名称为
(2)向分液漏斗中滴加浓硫酸之前,需先通入一段时间N2,此操作的目的是
(3)装置a中反应的化学方程式为
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O=
 +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。Ⅰ.取适量装置d中浊液,向其中滴加几滴
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,
 。
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
您最近一年使用:0次
2023-01-19更新
|
877次组卷
|
4卷引用:吉林省长春市新解放学校2022-2023学年高一下学期4月月考化学试题
10 . 如下图所示的“化学多米诺实验”装置中分别盛放的物质为①稀硫酸;②锌粒;装置③、④、⑤、⑥中的试剂及反应现象见下表,其中设计合理且实验现象符合预测的是
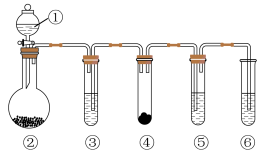

| ③中试剂 | ④中固体逐渐消失 | ⑤中溶液褪色 | ⑥中尾气处理 | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | NaOH溶液 |
| B | 浓HNO3 | Cu | FeSO4溶液 | 水 |
| C | 浓H2SO4 | 木炭 | 品红溶液 | 饱和NaHSO3溶液 |
| D | 浓NaOH溶液 | NH4Cl固体 | 少量CuSO4溶液 | CCl4和水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-12更新
|
1611次组卷
|
6卷引用:吉林省延边第一中学2023届高三下学期第七次模拟考试理科综合化学试题