1 . 某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:
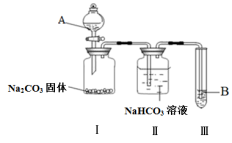
(1)A处的试剂是_______ (填序号,下同),B处的试剂是_______ 。
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(2)装置II中饱和NaHCO3溶液的作用_______ 。
(3)能证明三种酸的酸性强弱的现象_______ 。
(4)写出装置III中发生反应的化学方程式_______ 。

(1)A处的试剂是
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(2)装置II中饱和NaHCO3溶液的作用
(3)能证明三种酸的酸性强弱的现象
(4)写出装置III中发生反应的化学方程式
您最近一年使用:0次
2021-04-29更新
|
684次组卷
|
4卷引用:吉林省长春市第二十中学2020-2021学年高二下学期第二次质量测试化学试题
吉林省长春市第二十中学2020-2021学年高二下学期第二次质量测试化学试题北京市丰台区2020-2021学年高二下学期期中联考化学(B卷)试题(已下线)作业07 醇 酚-2021年高二化学暑假作业(人教版2019)(已下线)第08讲 酚(讲义)-【寒假自学课】2023年高二化学寒假精品课(人教版2019选择性必修3)
名校
2 . 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2g铜。
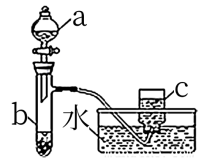
①请写出铜与稀硝酸反应的离子反应方程式:___ 。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有____ 。
③若a中液体为浓硝酸,则仪器c中收集的气体主要是___ (填化学式)。
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,生成沉淀的质量是___ g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用amolFe和含有bmolHNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。
①反应结束后溶液中NO 的物质的量的取值范围是
的物质的量的取值范围是__ (用含a的代数式表示)。
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比[n(Fe3+):n(Fe2+)]为3:1,则b:a的值为__ 。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2g铜。

①请写出铜与稀硝酸反应的离子反应方程式:
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有
③若a中液体为浓硝酸,则仪器c中收集的气体主要是
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,生成沉淀的质量是
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用amolFe和含有bmolHNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。
①反应结束后溶液中NO
 的物质的量的取值范围是
的物质的量的取值范围是②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比[n(Fe3+):n(Fe2+)]为3:1,则b:a的值为
您最近一年使用:0次
2021-04-21更新
|
86次组卷
|
2卷引用:吉林省汪清县第四中学2020-2021学年高一下学期第一次阶段考试化学试题
3 . 亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有__ ,反应的现象是__ ,反应的离子方程式为__ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有__ ,看到的现象是__ ,反应的化学方程式为___ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
您最近一年使用:0次
4 . 某课外活动小组在实验室用如图所示的装置进行实验,验证氨的某些性质并收集少量纯净的氮气。试回答:
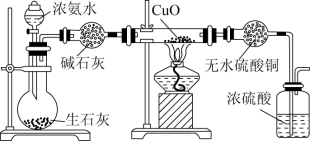
(1)实验前先将仪器按图连接好,然后_______ ,此操作进行的方法是_______ ,然后再开始实验。
(2)实验进行一段时间后,可以观察到硬质玻璃管内黑色的CuO粉末变成_______ 色,盛无水CuSO4的干燥管内出现_______ 色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质玻璃管中反应的化学方程式为_______ ,这个反应说明氨气具有_______ (填选项字母,下同)。
A.碱性 B.氧化性 C.还原性 D.不稳定性
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气的原因是_______ 。烧瓶中的生石灰可以用_______ (填药品名称)代替。
(4)洗气瓶中浓硫酸的作用是吸水和_______ 。
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是_______ 。
A.排气法 B.排水法 C.用塑料袋或球胆收集

(1)实验前先将仪器按图连接好,然后
(2)实验进行一段时间后,可以观察到硬质玻璃管内黑色的CuO粉末变成
A.碱性 B.氧化性 C.还原性 D.不稳定性
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气的原因是
(4)洗气瓶中浓硫酸的作用是吸水和
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是
A.排气法 B.排水法 C.用塑料袋或球胆收集
您最近一年使用:0次
名校
解题方法
5 . 某课外学习小组的同学设计了如图的装置,利用亚硫酸钠与硫酸反应制备并验证SO2的氧化性、还原性和漂白性。请完成下列空白。

(1))装置A的作用是___________ ,小组同学发现产生气体的速率缓慢,可能的原因是___________ 。
(2)装置B中可观察到的实验现象是___________ 。
(3)装置D中观察到的现象是_______________ ,通过E装置时的现象是___________ 。
(4)F中盛有碱石灰,其作用是___________ 。

(1))装置A的作用是
(2)装置B中可观察到的实验现象是
(3)装置D中观察到的现象是
(4)F中盛有碱石灰,其作用是
您最近一年使用:0次
2021-04-03更新
|
152次组卷
|
2卷引用:吉林省德惠市实验中学2020-2021学年高一下学期第一次月考化学试题
6 . 为模拟二氧化氮溶于水生成硝酸,现进行如下实验:
实验I:制备并收集一试管二氧化氮
(1)某同学用图1所示装置制备并收集一试管二氧化氮,该装置的缺点是___________ 。(只填一个缺点即可)
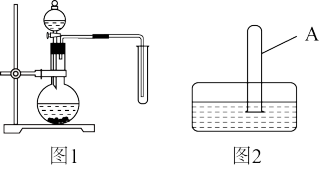
实验II:尽可能多地使试管中的二氧化氮被水吸收
(2)将充满二氧化氮的试管A倒放在盛有水的水槽中(如图2),并轻轻晃动试管,观察到的现象是___________ ,反应的化学方程式是___________ 。
(3)在该装置的基础上,请你设计实验,要求尽可能多地使试管中的二氧化氮被水吸收,实验操作是___________ 。
实验I:制备并收集一试管二氧化氮
(1)某同学用图1所示装置制备并收集一试管二氧化氮,该装置的缺点是

实验II:尽可能多地使试管中的二氧化氮被水吸收
(2)将充满二氧化氮的试管A倒放在盛有水的水槽中(如图2),并轻轻晃动试管,观察到的现象是
(3)在该装置的基础上,请你设计实验,要求尽可能多地使试管中的二氧化氮被水吸收,实验操作是
您最近一年使用:0次
7 . 实验室利用SO2合成硫酰氯(SO2Cl2),并对H2SO3和HClO的酸性强弱进行探究。
I.磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应,制取少量的SO2Cl2,SO2(g)+Cl2(g) = SO2Cl2(l),该反应放热,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾。
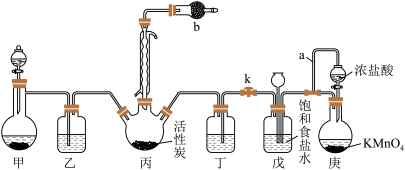
回答下列问题。
(1)甲装置可以用于实验室制SO2,则下列试剂组合中合适的是______ 。
A.18.4 mol·L-1的硫酸和Cu B.10 mol·L-1的硝酸和Na2SO3固体 C.70%的硫酸和Na2SO3固体
(2)导管a的作用是______ 。仪器b盛放的试剂为______ ,其作用是______ ,装置乙和丁中可以使用同一种试剂,该试剂为______ 。
(3)控制反应过程中装置丙中进气速率的方法是______ ,实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是______ 。
(4)若反应中消耗的氯气体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为______ (保留三位有效数字)。(产率:实际产量/理论产量×100%)
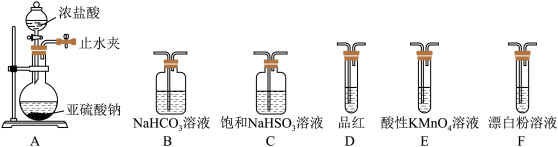
II.(5)选用下面的装置探究酸性:H2SO3>HClO,其连接顺序为A→______ 。能证明H2SO3的酸性强于HClO的实验现象为______ 。
I.磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应,制取少量的SO2Cl2,SO2(g)+Cl2(g) = SO2Cl2(l),该反应放热,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾。

回答下列问题。
(1)甲装置可以用于实验室制SO2,则下列试剂组合中合适的是
A.18.4 mol·L-1的硫酸和Cu B.10 mol·L-1的硝酸和Na2SO3固体 C.70%的硫酸和Na2SO3固体
(2)导管a的作用是
(3)控制反应过程中装置丙中进气速率的方法是
(4)若反应中消耗的氯气体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为
II.(5)选用下面的装置探究酸性:H2SO3>HClO,其连接顺序为A→

您最近一年使用:0次
2021-03-29更新
|
278次组卷
|
2卷引用:吉林省辽源市第五中学2020-2021学年高一下学期第一次月考化学试题
解题方法
8 . 钠和氯是我们熟悉的典型金属元素与非金属元素,研究它们的性质对于生产、生活、科研具有重要意义。
I.某化学兴趣小组为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如图1所示装置进行实验(夹持仪器已省略)。
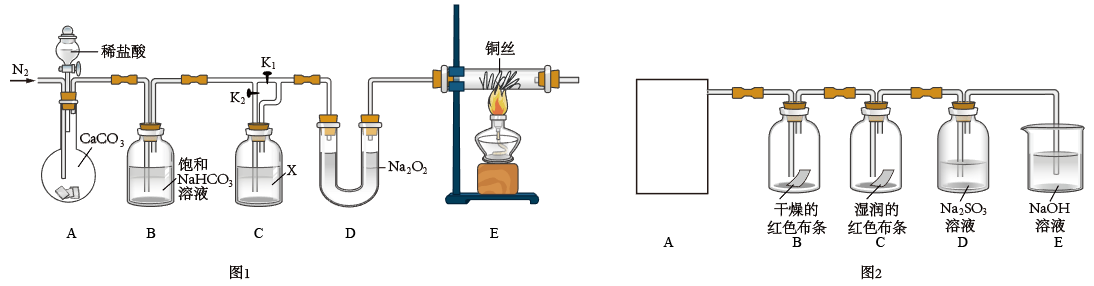
回答下列问题:
(1)实验开始前先通入一段时间的N2,目的是___ 。
(2)饱和NaHCO3溶液的作用是___ ,试剂X是___ 。
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,实验中观察到E中灼热的铜丝颜色未发生变化,则得出的结论是___ 。
(4)写出D中CO2与Na2O2反应的化学方程式___ 。
II.为探究氯气的性质,某同学利用此原理制氯气并设计了如图2所示的实验装置(A为氯气制取装置,未画出)。
(1)装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,其目的是___ 。实验过程中该同学发现装置B中的布条也褪色,说明该装置存在明显的缺陷,改进的方法是___ 。
(2)E中NaOH溶液吸收氯气时发生反应的化学方程式是___ 。
(3)D中氯气可将SO 氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是
氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是___ (提示:SO 遇盐酸生成SO2气体。写出操作试剂和现象)
遇盐酸生成SO2气体。写出操作试剂和现象)
(4)“84消毒液”是生活中常用的消毒剂,可与硫酸反应制取氯气,反应原理为NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O,制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是
Na2SO4+Cl2↑+H2O,制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是___ mol。
I.某化学兴趣小组为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如图1所示装置进行实验(夹持仪器已省略)。

回答下列问题:
(1)实验开始前先通入一段时间的N2,目的是
(2)饱和NaHCO3溶液的作用是
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,实验中观察到E中灼热的铜丝颜色未发生变化,则得出的结论是
(4)写出D中CO2与Na2O2反应的化学方程式
II.为探究氯气的性质,某同学利用此原理制氯气并设计了如图2所示的实验装置(A为氯气制取装置,未画出)。
(1)装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,其目的是
(2)E中NaOH溶液吸收氯气时发生反应的化学方程式是
(3)D中氯气可将SO
 氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是
氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是 遇盐酸生成SO2气体。写出操作试剂和现象)
遇盐酸生成SO2气体。写出操作试剂和现象)(4)“84消毒液”是生活中常用的消毒剂,可与硫酸反应制取氯气,反应原理为NaClO+NaCl+H2SO4
 Na2SO4+Cl2↑+H2O,制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是
Na2SO4+Cl2↑+H2O,制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是
您最近一年使用:0次
9 . 某实验小组欲在实验室利用浓盐酸和MnO2制取氯气并探究氯气的性质,设计了如图所示的实验装置:
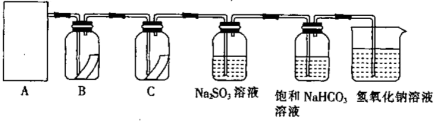
(1)从装置I、II、III中选择合适的制氯气的装置(A处):___ (填标号)。
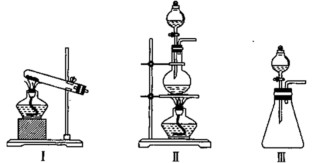
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___ ;说明该装置存在明显的缺陷,请提出合理的改进方法:___ 。
(3)验证氯气的氧化性:将氯气通入Na2SO3溶液中,氯气可将Na2SO3氧化成Na2SO4。写出该反应的离子方程式:___ 。
(4)氯气通入饱和NaHCO3溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸。(强酸可以制弱酸)该实验证明氯气与水反应的生成物中含有___ (填“盐酸”或“次氯酸”)。
(5)实验装置中烧杯内氢氧化钠溶液的作用是___ 。

(1)从装置I、II、III中选择合适的制氯气的装置(A处):

(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)验证氯气的氧化性:将氯气通入Na2SO3溶液中,氯气可将Na2SO3氧化成Na2SO4。写出该反应的离子方程式:
(4)氯气通入饱和NaHCO3溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸。(强酸可以制弱酸)该实验证明氯气与水反应的生成物中含有
(5)实验装置中烧杯内氢氧化钠溶液的作用是
您最近一年使用:0次
2021-02-22更新
|
202次组卷
|
2卷引用:吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题
名校
解题方法
10 . 如图装置用来检验氯气的部分性质。

(1)装置A的作用是___ 。
(2)装置B、C中的布条褪色的是___ 。
(3)装置D中发生的反应方程式为___ 。
(4)氯气可以用于自来水消毒,请用化学方程式和简要文字说明理由___ 。

(1)装置A的作用是
(2)装置B、C中的布条褪色的是
(3)装置D中发生的反应方程式为
(4)氯气可以用于自来水消毒,请用化学方程式和简要文字说明理由
您最近一年使用:0次



