名校
解题方法
1 . 某实验小组为了证明过氧化钠可在呼吸面具和潜水艇中做供氧剂,设计了如图实验装置进行实验,则下列说法不正确的是
A.c中盛放的是 ,装置中会发生2个反应 ,装置中会发生2个反应 |
B.b中盛放的是浓硫酸,作用是干燥 |
| C.c中会观察到固体颜色逐渐变白,伴有发热的现象 |
D.d中盛放的是NaOH溶液,作用是吸收多余的 |
您最近一年使用:0次
2023-12-06更新
|
137次组卷
|
3卷引用:广东省广州市第六中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
2 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
名校
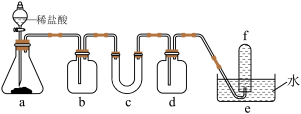
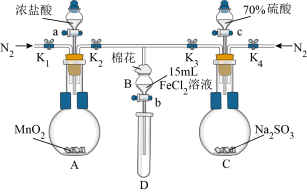
3 . 为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
Ⅶ.实验结束后,打开弹簧夹K1~K4,再通入一段时间N2,然后拆卸,洗涤,整理仪器。
(1)A中反应的离子方程式为___________ 。
(2)步骤Ⅲ中溶液变黄的离子方程式是___________ ,能说明氧化性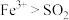 的离子方程式是
的离子方程式是___________ 。
(3)棉花中浸润的溶液是___________ 。
(4)过程Ⅶ的目的是___________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性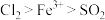 的是
的是___________ (填“甲”、“乙”、“丙”)。
(6)将B中的 溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有
溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有 的
的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为___________ ,该过程的离子方程式为:___________ 。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
Ⅶ.实验结束后,打开弹簧夹K1~K4,再通入一段时间N2,然后拆卸,洗涤,整理仪器。
(1)A中反应的离子方程式为
(2)步骤Ⅲ中溶液变黄的离子方程式是
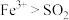 的离子方程式是
的离子方程式是(3)棉花中浸润的溶液是
(4)过程Ⅶ的目的是
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性
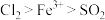 的是
的是| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有SO |
| 乙 | 有Fe3+无Fe2+ | 有Fe2+ |
| 丙 | 有Fe3+无Fe2+ | 有SO |
(6)将B中的
 溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有
溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有 的
的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
4 . 某化学兴趣小组同学利用如图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
(1)仪器a的名称_________ 。
(2)装置D和F的作用是_________ 。
(3)加热时,装置A中反应的化学方程式__________ 。
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是___________ ,若要证明其过程是可逆的,还需要的操作是______________ 。

(1)仪器a的名称
(2)装置D和F的作用是
(3)加热时,装置A中反应的化学方程式
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是
您最近一年使用:0次
解题方法
5 . 在呼吸面具和潜水艇中,可用过氧化钠作供氧剂。采用下图所示实验装置进行实验,证明过氧化钠可用作供氧剂。下列说法正确的是

| A.装置A中所装药品为碳酸钙和稀硫酸 |
B.装置B盛饱和 溶液除去 溶液除去 中的HCl 中的HCl |
C.装置C中 发生反应时既作氧化剂又作还原剂 发生反应时既作氧化剂又作还原剂 |
| D.装置D中的试剂是浓硫酸 |
您最近一年使用:0次
名校
解题方法
6 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
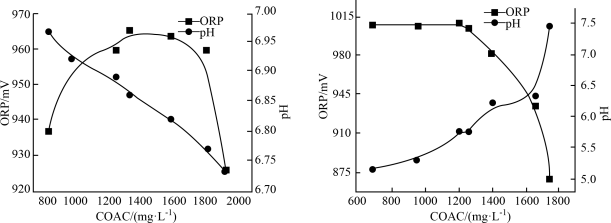
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
7 . 磺酰氯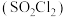 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量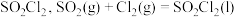 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为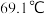 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4) 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量 )。
)。
(6)已知酸性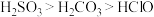 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为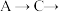
___________ 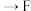 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
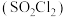 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量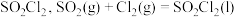 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为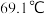 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.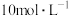 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为 )。
)。(6)已知酸性
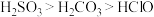 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为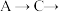
 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
154次组卷
|
2卷引用:广东省惠州市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
8 . 某小组从电极反应的角度研究物质氧化性和还原性的变化规律.
(1)实验室以 和浓盐酸为原料制取氯气的化学方程式为:
和浓盐酸为原料制取氯气的化学方程式为: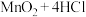 (浓)
(浓)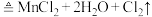 ,该反应的氧化产物是
,该反应的氧化产物是__________ ,将该反应设计成原电池,氧化反应为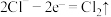 ,还原反应为
,还原反应为___________ 。
(2)当氯气不再逸出时,固液混合物A中仍存在 和盐酸.小组同学分析认为随着反应的进行、
和盐酸.小组同学分析认为随着反应的进行、 的氧化性和
的氧化性和 -的还原性均减弱,为此进行探究.
-的还原性均减弱,为此进行探究.
实验任务探究离子浓度对 氧化性的影响
氧化性的影响
提出猜想
猜想a:随 减小,
减小, 的氧化性减弱.
的氧化性减弱.
猜想b:随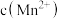 增大,
增大, 的氧化性减弱.
的氧化性减弱.
查阅资料电极电势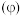 是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.
是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.
验证猜想用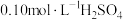 溶液、
溶液、 溶液和蒸馏水配制混合液(溶液总体积相同),将
溶液和蒸馏水配制混合液(溶液总体积相同),将 电极置于混合液中测定其电极电势
电极置于混合液中测定其电极电势 ,进行表中实验
,进行表中实验 ,数据记录。
,数据记录。
①根据实验1和2的结果,猜想a成立.补充数据:
___________ ,
__________ .
②根据实验1和3的结果,猜想b成立.判断依据是___________ (用电极电势关系表示).
探究结果固液混合物A中仍存在 和盐酸的原因是随着反应进行,溶液中
和盐酸的原因是随着反应进行,溶液中 减小、
减小、 增大,
增大, 氧化性减弱.
氧化性减弱.
③根据上述探究结果,小组同学作出如下推断:随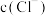 增大,
增大, 还原性增强.
还原性增强.
实验验证:在固液混合物A中加入____________ (填化学式)固体,加热.证明推断正确的实验现象是_____________ .
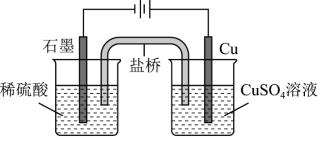
(3)根据电化学的相关知识,小组同学利用如图电解池装置,成功实现了铜与稀硫酸制氢气._____________ .
(1)实验室以
 和浓盐酸为原料制取氯气的化学方程式为:
和浓盐酸为原料制取氯气的化学方程式为: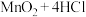 (浓)
(浓)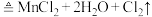 ,该反应的氧化产物是
,该反应的氧化产物是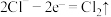 ,还原反应为
,还原反应为(2)当氯气不再逸出时,固液混合物A中仍存在
 和盐酸.小组同学分析认为随着反应的进行、
和盐酸.小组同学分析认为随着反应的进行、 的氧化性和
的氧化性和 -的还原性均减弱,为此进行探究.
-的还原性均减弱,为此进行探究.实验任务探究离子浓度对
 氧化性的影响
氧化性的影响提出猜想
猜想a:随
 减小,
减小, 的氧化性减弱.
的氧化性减弱.猜想b:随
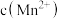 增大,
增大, 的氧化性减弱.
的氧化性减弱.查阅资料电极电势
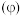 是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.
是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.验证猜想用
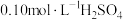 溶液、
溶液、 溶液和蒸馏水配制混合液(溶液总体积相同),将
溶液和蒸馏水配制混合液(溶液总体积相同),将 电极置于混合液中测定其电极电势
电极置于混合液中测定其电极电势 ,进行表中实验
,进行表中实验 ,数据记录。
,数据记录。| 实验序号 | 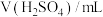 |  | 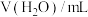 | 电极电势/V |
| 1 | 20 | 20 | 0 | 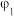 |
| 2 | m | n | 10 | 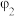 |
| 3 | 20 | 10 | 10 | 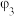 |


②根据实验1和3的结果,猜想b成立.判断依据是
探究结果固液混合物A中仍存在
 和盐酸的原因是随着反应进行,溶液中
和盐酸的原因是随着反应进行,溶液中 减小、
减小、 增大,
增大, 氧化性减弱.
氧化性减弱.③根据上述探究结果,小组同学作出如下推断:随
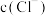 增大,
增大, 还原性增强.
还原性增强.实验验证:在固液混合物A中加入
(3)根据电化学的相关知识,小组同学利用如图电解池装置,成功实现了铜与稀硫酸制氢气.
您最近一年使用:0次
9 . 连四硫酸钠 是生物酶的修复剂,其与盐酸反应的离子方程式为:
是生物酶的修复剂,其与盐酸反应的离子方程式为: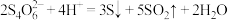 ,按如下装置制备足量
,按如下装置制备足量 并探究其性质,下列表述不正确的是
并探究其性质,下列表述不正确的是
 是生物酶的修复剂,其与盐酸反应的离子方程式为:
是生物酶的修复剂,其与盐酸反应的离子方程式为: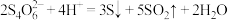 ,按如下装置制备足量
,按如下装置制备足量 并探究其性质,下列表述不正确的是
并探究其性质,下列表述不正确的是
A.Ⅱ中溶液由紫色变成红色一定能证明 是酸性氧化物 是酸性氧化物 |
B.Ⅲ中溶液褪色说明 有还原性 有还原性 |
| C.Ⅳ中溶液有白色沉淀生成 |
D.Ⅳ装置后连接浓 溶液可进行尾气处理 溶液可进行尾气处理 |
您最近一年使用:0次
10 .  可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。
(1) 的制备
的制备
实验室可用 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:__________________________ 。
(2) 的收集
的收集
为收集纯净的 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→_______ →e。 的性质探究
的性质探究
ⅰ)探究 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: 的变化速率
的变化速率__________  。
。
②ab段变化及溶液的pH减小,表明 与水发生反应,其方程式为
与水发生反应,其方程式为_____________________ ,该反应的产物不稳定,可通过以下实验证明,请补充操作填在表格横线中。
若____________________ ,证明该反应产物不稳定。
ⅱ)探究 使品红溶液褪色的原因
使品红溶液褪色的原因
操作1:将 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。 、
、 、
、____________________ 。
已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是 请完成表格。
请完成表格。
 可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。(1)
 的制备
的制备实验室可用
 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:(2)
 的收集
的收集为收集纯净的
 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→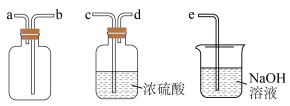
 的性质探究
的性质探究ⅰ)探究
 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: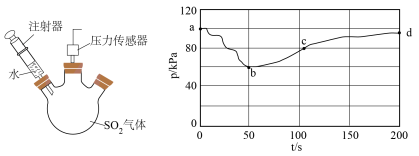
 的变化速率
的变化速率 。
。②ab段变化及溶液的pH减小,表明
 与水发生反应,其方程式为
与水发生反应,其方程式为操作 | 100s内压强变化/kPa |
待烧瓶中压强稳定后,将其置于热水浴中,重新测定压强变化 |
|
|
ⅱ)探究
 使品红溶液褪色的原因
使品红溶液褪色的原因操作1:将
 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。
 、
、 、
、已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是
 请完成表格。
请完成表格。操作2 | 现象 |
不褪色 |
您最近一年使用:0次