2024高三·全国·专题练习
解题方法
1 . 某化学兴趣小组设计如图所示装置探究物质间的氧化性大小。下列说法错误的是
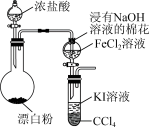
| A.烧瓶中的离子反应式为ClO-+Cl-+2H+=Cl2↑+H2O |
| B.浸有NaOH溶液的棉花起吸收尾气的作用 |
| C.CCl4可用淀粉溶液替换 |
| D.试管下层出现紫红色,可证明氧化性:Cl2>Fe3+>I2 |
您最近一年使用:0次
解题方法
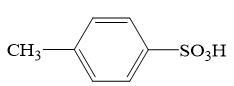
2 . Ⅰ.对甲苯磺酸是一种白色晶体,熔点107℃,易溶于醇、醚和水,是用途广泛的化工原料。
(2)写出反应的化学方程式。___________
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式: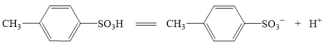 ,设计简单实验证明猜想。
,设计简单实验证明猜想。___________
(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有___________ 。
(5)向吸收液中滴加一定量___________ 溶液,仍未观察到明显现象,说明对甲苯磺酸不具有强氧化性。
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率____ 。(产率= ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)
(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点___________ 。
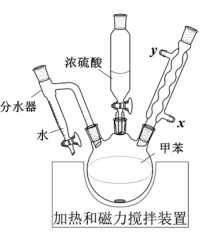
| A.当分水器中的水量不再增加时,停止加热 |
| B.分水器可将反应体系中的甲苯移除 |
| C.烧瓶中不需要添加沸石 |
| D.冷凝水从x口进入 |
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式:
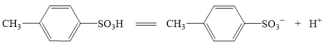 ,设计简单实验证明猜想。
,设计简单实验证明猜想。(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有
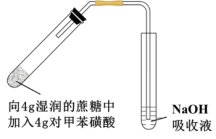
(5)向吸收液中滴加一定量
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率
 ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点
您最近一年使用:0次
22-23高一下·四川泸州·期末
名校
解题方法
3 . 教师在课堂上通过以下装置对原电池的原理和形成条件开展了实验探究,结合探究判断下列说法不正确 的是
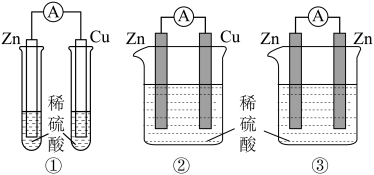
| A.通过装置①金属表面是否产生气泡,可证明Zn比Cu活泼 |
| B.对比①②中Cu片上是否有气泡,可预测②中电流表指针会偏转 |
| C.装置②③对比实验的目的是:探究原电池电极材料应满足的条件 |
D.装置③能形成原电池,正极的电极反应式为: |
您最近一年使用:0次
2023-07-12更新
|
241次组卷
|
4卷引用:6.1.2化学反应与电能课后作业提高篇
22-23高一上·陕西汉中·期末
名校
解题方法
4 . 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(气密性良好)。
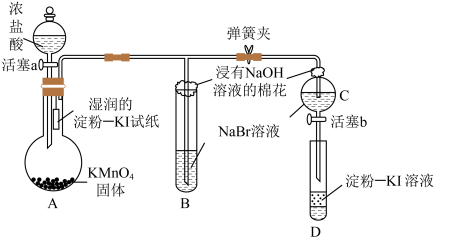
已知:浓盐酸与 固体混合会产生
固体混合会产生 。
。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.……
下列说法错误的是

已知:浓盐酸与
 固体混合会产生
固体混合会产生 。
。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.……
下列说法错误的是
| A.A中湿润的淀粉-KI试纸变蓝,证明氯气的氧化性强于碘单质 |
| B.B中溶液变黄色,证明氯气的氧化性强于溴单质 |
C.B中发生反应的离子方程式为 |
| D.实验过程Ⅲ为关闭活塞a,打开活塞b,滴加溶液后充分振荡试管D,观察到D中溶液变蓝,即证明了溴单质的氧化性强于碘单质 |
您最近一年使用:0次
2023-02-04更新
|
1007次组卷
|
6卷引用:寒假作业09 原子结构与元素周期表-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
(已下线)寒假作业09 原子结构与元素周期表-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)浙江省杭州第四中学2023-2024学年高一上学期期末考试化学试题河南省名校联盟2023-2024学年高一下学期3月月考化学试题河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题陕西省汉中市多校2022-2023学年高一上学期期末校际联考化学试题重庆市缙云教育联盟2023-2024学年高一上学期1月期末化学试题
解题方法
5 . 某化学兴趣小组探究 溶液与
溶液与 溶液的反应。向
溶液的反应。向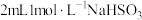 溶液
溶液 中逐滴加入
中逐滴加入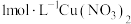 溶液,溶液变为绿色,静置
溶液,溶液变为绿色,静置 后,溶液变蓝,底部产生大量砖红色沉淀。
后,溶液变蓝,底部产生大量砖红色沉淀。
(1)测得 溶液
溶液 ,结合化学原理解释原因
,结合化学原理解释原因________________ 。
(2)甲同学认为 溶液与
溶液与 溶液发生了氧化还原反应。通过检验反应体系中是否含有
溶液发生了氧化还原反应。通过检验反应体系中是否含有 即可证明,检验
即可证明,检验 的方法是
的方法是________________ 。
(3)乙同学认为上述方法不能排除空气中 的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:
的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:
假设1:砖红色沉淀为 ;
;
假设2:砖红色沉淀为 ;
;
假设3:________________ ..
(4)查阅资料1: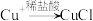 (白色难溶固体)
(白色难溶固体)
将砖红色沉淀过滤洗涤后,滴加 盐酸至过量,
盐酸至过量,________________ (填实验现象),可证明假设1成立,同时溶液变为蓝绿色,并伴有刺激性气味的气体生成。
(5)丙同学做对照实验时,向 中滴加
中滴加 盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。
盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。
①刺激性气味的气体可能是 或
或 ,在试管口用
,在试管口用蘸有碘水的淀粉试纸 检验,发现蓝色褪去,写出反应的离子方程式________________ 。
②向红色沉淀中加入过量氨水,发现沉淀溶解,溶液立即变蓝。 被空气氧化缓慢变蓝的原理
被空气氧化缓慢变蓝的原理________________ 。
③上述实验现象表明,砖红沉淀中除了含有 外,还含有
外,还含有________ 。(写出离子成分即可)
(6)丁同学通过如图装置证明了此条件下, 也能氧化
也能氧化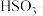 ,图中甲溶液是
,图中甲溶液是________ ,通过对比实验证明了此时空气中的 不是
不是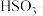 被氧化的主要原因,操作及现象是
被氧化的主要原因,操作及现象是________________ 。
 溶液与
溶液与 溶液的反应。向
溶液的反应。向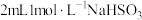 溶液
溶液 中逐滴加入
中逐滴加入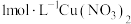 溶液,溶液变为绿色,静置
溶液,溶液变为绿色,静置 后,溶液变蓝,底部产生大量砖红色沉淀。
后,溶液变蓝,底部产生大量砖红色沉淀。(1)测得
 溶液
溶液 ,结合化学原理解释原因
,结合化学原理解释原因(2)甲同学认为
 溶液与
溶液与 溶液发生了氧化还原反应。通过检验反应体系中是否含有
溶液发生了氧化还原反应。通过检验反应体系中是否含有 即可证明,检验
即可证明,检验 的方法是
的方法是(3)乙同学认为上述方法不能排除空气中
 的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:
的干扰,应该进一步分析沉淀的成分。对反应产物中的砖红色沉淀提出以下假设:假设1:砖红色沉淀为
 ;
;假设2:砖红色沉淀为
 ;
;假设3:
(4)查阅资料1:
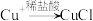 (白色难溶固体)
(白色难溶固体)将砖红色沉淀过滤洗涤后,滴加
 盐酸至过量,
盐酸至过量,(5)丙同学做对照实验时,向
 中滴加
中滴加 盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。
盐酸至过量后,没有观察到溶液变蓝和生成气体的现象。因此,他认为砖红色沉淀中还可能含有其它成分,并设计实验进行证实。①刺激性气味的气体可能是
 或
或 ,在试管口用
,在试管口用②向红色沉淀中加入过量氨水,发现沉淀溶解,溶液立即变蓝。
查阅资料2:
 被空气氧化缓慢变蓝的原理
被空气氧化缓慢变蓝的原理③上述实验现象表明,砖红沉淀中除了含有
 外,还含有
外,还含有(6)丁同学通过如图装置证明了此条件下,
 也能氧化
也能氧化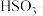 ,图中甲溶液是
,图中甲溶液是 不是
不是 被氧化的主要原因,操作及现象是
被氧化的主要原因,操作及现象是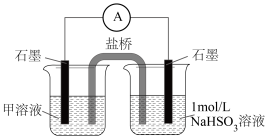
您最近一年使用:0次
23-24高三上·北京房山·期末
解题方法
6 . 某学习小组对 与
与 的反应进行了研究。
的反应进行了研究。___________ 。
(2)利用如图装置完成 与
与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
①为排尽整套装置内的空气,先打开弹簧夹,通入_______ (填化学式),一段时间后关闭弹簧夹。
②C中液面上方为红棕色气体,其原因是________ (用化学方程式表示)。
(3)学习小组在做铜与硝酸反应的实验时观察到了以下现象:实验Ⅰ中蓝色溶液A遇铜片立即产生气泡,而相同条件下实验Ⅱ中 硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
①假设1:___________ (填化学式)对该反应有催化作用。
实验验证:向 硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
结论:假设1不成立。
②假设2: 对该反应有催化作用。
对该反应有催化作用。
向A中鼓入 数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率:
数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率: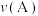
______ 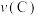 (填“
(填“ ”“
”“ ”“
”“ ”)。实验证明假设2成立。
”)。实验证明假设2成立。
③经检验,蓝色溶液A中还含有少量亚硝酸 。
。
设计实验证明 也对该反应有催化作用。操作和预期的现象是:
也对该反应有催化作用。操作和预期的现象是:___________ 。向含有铜片的溶液B中___________ 。
实验总结: 和
和 对铜与硝酸的反应都有催化作用。
对铜与硝酸的反应都有催化作用。
(4)请推测 与浓硝酸反应中
与浓硝酸反应中 和
和 参与的可能的催化过程:
参与的可能的催化过程:
①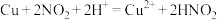 ②
②___________ 。
 与
与 的反应进行了研究。
的反应进行了研究。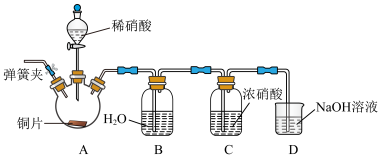
(2)利用如图装置完成
 与
与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。①为排尽整套装置内的空气,先打开弹簧夹,通入
②C中液面上方为红棕色气体,其原因是
(3)学习小组在做铜与硝酸反应的实验时观察到了以下现象:实验Ⅰ中蓝色溶液A遇铜片立即产生气泡,而相同条件下实验Ⅱ中
 硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:实验Ⅰ: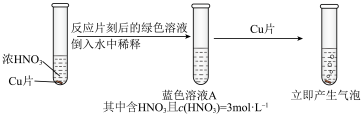
实验Ⅱ: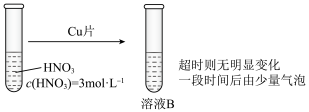
①假设1:
实验验证:向
 硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。结论:假设1不成立。
②假设2:
 对该反应有催化作用。
对该反应有催化作用。向A中鼓入
 数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率:
数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率: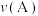
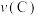 (填“
(填“ ”“
”“ ”“
”“ ”)。实验证明假设2成立。
”)。实验证明假设2成立。③经检验,蓝色溶液A中还含有少量亚硝酸
 。
。设计实验证明
 也对该反应有催化作用。操作和预期的现象是:
也对该反应有催化作用。操作和预期的现象是:实验总结:
 和
和 对铜与硝酸的反应都有催化作用。
对铜与硝酸的反应都有催化作用。(4)请推测
 与浓硝酸反应中
与浓硝酸反应中 和
和 参与的可能的催化过程:
参与的可能的催化过程:①
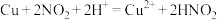 ②
②
您最近一年使用:0次
7 . 兴趣小组查阅文献后,设计实验对苯酚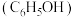 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。
已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。
Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为___________ 。
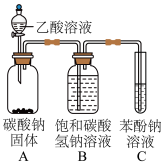
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为___________ ,C中反应的化学方程式为___________ 。
兴趣小组对以上实验的现象提出猜想。
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(3)向实验1反应后溶液中继续加入 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是___________ 。
(4)向实验1反应后溶液中加入___________ 固体(填化学式),若溶液颜色变为浅紫色,说明猜想2成立。
(5)兴趣小组同学提出猜想3:溶液的 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。
①实验4中生成的红褐色沉淀是___________ (填化学式)。
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因___________ 。
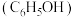 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与
 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为
| 实验1 | 实验2 |
|
|
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(3)向实验1反应后溶液中继续加入
 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是(4)向实验1反应后溶液中加入
(5)兴趣小组同学提出猜想3:溶液的
 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。| 实验 | 操作 | 现象 |
| 3 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 溶液显紫色 |
| 4 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 生成红褐色沉淀 |
| 5 | 向实验4所得悬浊液中逐滴加入0.1mol/L盐酸至过量 | 沉淀逐渐溶解,溶液变为紫色;继续滴加盐酸,溶液由紫色变为浅黄色 |
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因
您最近一年使用:0次
2024-04-26更新
|
167次组卷
|
2卷引用:北京市北京大学附属中学2023-2024学年高二下学期期中考试化学试题
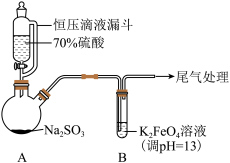
8 . 某实验小组探究SO2与K2FeO4的反应,实验如下。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;
(1)A中产生SO2的化学方程式为___________ 。
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO 、SO
、SO ,检验如下:
,检验如下:
实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在___________ 。另取少量溶液滴加BaCl2溶液,产生白色沉淀,但不能确认含有SO ,原因是
,原因是___________ 。
实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO 。
。
实验三中用H2C2O4溶液溶解沉淀的目的是:___________ 。
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:___________ 。
(3)查阅资料:a.Fe3+、SO 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是___________ 。
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:___________ 。
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
您最近一年使用:0次
23-24高一上·广东汕头·期中
名校
解题方法
9 . 某同学欲探究 的氧化还原性:
的氧化还原性:
资料: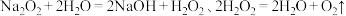
制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。
检验 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。
I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
(2)猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有___________ 性,能与 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是 。
。
综上所述, 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
 的氧化还原性:
的氧化还原性:资料:
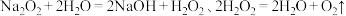
制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。检验
 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:(2)猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i |  | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是
 。
。综上所述,
 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
您最近一年使用:0次
23-24高三上·河南南阳·阶段练习
10 . 高铁酸钾(K2FeO4,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备K2FeO4并探究其性质。回答下列问题:
实验(一)制备K2FeO4。___________ ,装置B的作用是___________ ,盛装的试剂为 ___________ 。
(2)装置C中生成K2FeO4的化学方程式为___________
实验(二)探究K₂FeO4的性质。
(3)R溶液为______ (填“稀硫酸”或“盐酸”),写出装置a中的离子方程式:____________ ,不选择另一种酸的主要原因是____________ .
(4)设计一种方案检验从d口逸出的气体:______ 。
ll.探究K₂FeO4在酸性条件下的氧化性。
(5)向K₂FeO4溶液中滴加少量用稀硫酸酸化后的MnSO4溶液,溶液呈紫红色。______ (填“能”或“不能”)证明氧化性:  >MnSO4,原因是
>MnSO4,原因是____________ (用文字说明)。
实验(一)制备K2FeO4。

(2)装置C中生成K2FeO4的化学方程式为
实验(二)探究K₂FeO4的性质。
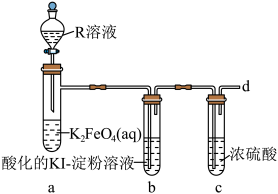
(3)R溶液为
(4)设计一种方案检验从d口逸出的气体:
ll.探究K₂FeO4在酸性条件下的氧化性。
(5)向K₂FeO4溶液中滴加少量用稀硫酸酸化后的MnSO4溶液,溶液呈紫红色。
 >MnSO4,原因是
>MnSO4,原因是
您最近一年使用:0次