福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题
福建
高二
期中
2021-06-06
205次
整体难度:
适中
考查范围:
物质结构与性质、有机化学基础、常见无机物及其应用、化学反应原理、化学实验基础、认识化学科学
福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题
福建
高二
期中
2021-06-06
205次
整体难度:
适中
考查范围:
物质结构与性质、有机化学基础、常见无机物及其应用、化学反应原理、化学实验基础、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 若将14Si的电子排布式写成1s22s22p63s23p ,它违背了
,它违背了
 ,它违背了
,它违背了| A.能量守恒原理 | B.泡利原理 | C.能量最低原理 | D.洪特规则 |
您最近一年使用:0次
2021-05-21更新
|
230次组卷
|
7卷引用:2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷
2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷云南省新平县一中2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】吉林省长春市外国语学校2018-2019学年高二下学期期中考试化学试题云南省盈江县第一高级中学2019-2020学年高二上学期期末考试化学试题福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
单选题
|
较易(0.85)
名校
解题方法
您最近一年使用:0次
2020-10-13更新
|
244次组卷
|
4卷引用:湖北省武汉市五校联合体2019-2020学年高二下学期期中考试化学试题
湖北省武汉市五校联合体2019-2020学年高二下学期期中考试化学试题(已下线)1.1 原子结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题
单选题
|
较易(0.85)
3. 元素性质存在周期性变化的本质原因是( )
| A.元素原子相对原子质量周期性变化的结果 |
| B.元素原子核外电子排布周期性变化的结果 |
| C.元素的原子序数递增的结果 |
| D.元素金属性和非金属性周期性变化的结果 |
您最近一年使用:0次
2019-04-01更新
|
86次组卷
|
2卷引用:山东省济宁市实验中学2018-2019学年高一下学期3月月考化学试题
单选题
|
较易(0.85)
解题方法
4. 周期表中第三周期元素,按原子序数递增的顺序(稀有气体除外),以下说法正确的是
| A.原子半径逐渐增大 |
| B.金属性减弱,非金属性增强 |
| C.氧化物对应的水化物碱性减弱,酸性增强 |
| D.简单离子的离子半径减小 |
您最近一年使用:0次
2020-01-05更新
|
215次组卷
|
3卷引用:天津市部分区2019-2020学年高一上学期期末考试化学试题
单选题
|
较易(0.85)
名校
5. 依据元素周期律进行推断,下列不正确的是
| A.碱性:KOH>NaOH | B.氧化性:C12>S |
| C.稳定性:HBr>HI | D.酸性 H3PO4>HNO3 |
您最近一年使用:0次
2016-12-09更新
|
367次组卷
|
4卷引用:2016届北京市东城区高三一模理综化学试卷
单选题
|
适中(0.65)
名校
6. 下列说法正确的是( )
| A.原子半径:P<S<Cl |
| B.电负性:C<N<O |
| C.热稳定性:HF<HCl<HBr |
| D.第一电离能:Na<Mg<Al |
您最近一年使用:0次
2020-05-19更新
|
412次组卷
|
6卷引用:天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题
单选题
|
适中(0.65)
解题方法
7. 下表中的实验,操作和现象与结论对应关系正确的一组是
| 选项 | 操作和现象 | 结论 |
| A | 向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体 | 氯元素的非金属性强于碳元素 |
| B | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物中一定含有乙烯 |
| C | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀 | 蔗糖未水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-30更新
|
175次组卷
|
3卷引用:四川省成都彭州市2019-2020学年高一下学期期末调研考试化学试题
单选题
|
适中(0.65)
名校
8. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是
| A.W、X、Y、Z的简单离子的半径依次增大 |
| B.X的简单氢化物的热稳定性比W的强 |
| C.析出的黄色沉淀易溶于乙醇 |
| D.X与Z属于同一主族,X与Y属于同一周期 |
您最近一年使用:0次
2019-01-27更新
|
494次组卷
|
8卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
单选题
|
适中(0.65)
名校
9. X、Y、Z、W是短周期主族元素,且原子序数依次增大,X元素的周期序数等于其主族序数,且X为同主族元素中唯一非金属元素,Y元素的单质是一种强力漂白剂,Z元素形成的简单离子是同周期半径最小的离子,含元素W的一种化合物是木材防火剂的原料,下列叙述错误的是( )
| A.上述四种元素的原子半径大小:Z>W>Y>X |
| B.Z的氢氧化物和NaHCO3均可中和过多的胃酸 |
| C.X与Y只形成既含极性共价键又含非极性共价键的共价化合物 |
| D.W与Y形成的化合物既是建筑材料,也是工艺品(玛瑙等)的原料 |
您最近一年使用:0次
2020-06-02更新
|
95次组卷
|
4卷引用:【全国百强校】黑龙江省大庆实验中学2018届高三得分训练(三)化学试题
单选题
|
适中(0.65)
10. 下列根据操作和现象所得出的结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 | H2O2氧化性比I2强 |
| B | 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 | 非金属性:S>C>Si |
| C | 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
| D | 向某溶液中滴加稀NaOH溶液时。将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液一定不含NH4+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
261次组卷
|
2卷引用:2016届江苏省清江中学高三下冲刺模拟四化学试卷
单选题
|
适中(0.65)
11. 关于氮族元素(从N到Bi)单质及其化合物的性质递变规律说法正确的是
| A.单质的熔、沸点依次增大 | B.单质磷的化学活泼性比氮气强 |
| C.气态氢化物的还原性依次减弱 | D.磷酸的酸性比硝酸强 |
【知识点】 同主族元素性质递变规律
您最近一年使用:0次
单选题
|
适中(0.65)
12. 下列有关碱金属元素和卤素的说法中,错误的是
A.溴单质与 的反应比碘单质与 的反应比碘单质与 的反应更剧烈 的反应更剧烈 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.随着核电荷数的增加,卤素单质的熔、沸点逐渐降低 |
【知识点】 碱金属物理性质及其变化规律解读 同主族元素性质递变规律
您最近一年使用:0次
2020-09-08更新
|
286次组卷
|
2卷引用:人教版(2019)高一必修第一册 第四章 第一节课时5 卤族元素的原子结构与性质
单选题
|
适中(0.65)
13. 下列事实不能用元素周期律解释的是( )
| A.氧化性:O2>S | B.碱性:NaOH>Mg(OH)2 |
| C.酸性:H2CO3>HClO | D.稳定性:HF>HI |
您最近一年使用:0次
2020-04-30更新
|
97次组卷
|
2卷引用:河北省唐山遵化市2018-2019学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
14. W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )
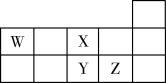

| A.Z、Y、W的最高价氧化物的水化物的酸性依次减弱 |
| B.Z、Y、X的原子半径依次减小,非金属性依次减弱 |
| C.气态氢化物的稳定性:H2X>H2Y |
| D.W的位置是第二周期第ⅣA族 |
您最近一年使用:0次
2020-07-14更新
|
79次组卷
|
2卷引用:贵州省铜仁市伟才学校2019-2020学年高一下学期期中考试化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
15. 下表给出14~17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是________ ,还原性最差的是_____ 。
(2)四种元素的非金属性随着元素原子序数的递增而逐渐_____________________ ,试从原子结构的角度加以解释____________ 。
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由___________ 。
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2反应的条件 | 高温 | 磷蒸气与H2能反应 | 加热 | 光照或点燃时发生爆炸 |
| 最高价氧化物的水化物 | H4SiO4弱酸 | H3PO4中强酸 | H2SO4强酸 | HClO4最强含氧酸 |
(1)它们所形成的氢化物中稳定性最差的是
(2)四种元素的非金属性随着元素原子序数的递增而逐渐
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由
您最近一年使用:0次
2015-07-20更新
|
508次组卷
|
3卷引用:2014-2015学年辽宁省沈阳郊联体高一下学期期中化学文试卷
填空题
|
适中(0.65)
16. 阻燃剂又称防火剂,主要用于延迟或防止可燃物的燃烧。根据组成,阻燃剂可分为卤系阻燃剂、无机阻燃剂等。
(1)卤系阻燃剂多为有机氯化物和有机溴化物,受热会分解产生卤化氢(HX),起到阻燃作用。卤化氢的电子式为________ ;氯离子的结构示意图为________ 。
(2)下列能说明氯的非金属性强于溴的事实是________ (选填编号)。
a.HClO酸性强于HBrO
b.稳定性:HBr小于HCl
c.在二者形成的化合物BrCl 中氯显负价,溴显正价
无机阻燃剂中,氢氧化铝和氢氧化镁两种阻燃剂占据着重要位置。两者的阻燃机理都是在达到热分解温度时迅速分解为氧化物与水,起到吸热降温的作用。
(3)写出氢氧化铝在酸性溶液中的电离方程式_________ 。
写出氢氧化铝与氢氧化钠反应的离子方程式_________ 。
(4)无水碳酸镁也是一种新型无机阻燃剂,除了具有单位质量吸热量更大的特点外,还能释放具有灭火作用的气体。写出该气体的结构式___________ 。与镁离子核外电子排布相同的另外两个阳离子的半径大小关系为________ (填微粒符号)。
(1)卤系阻燃剂多为有机氯化物和有机溴化物,受热会分解产生卤化氢(HX),起到阻燃作用。卤化氢的电子式为
(2)下列能说明氯的非金属性强于溴的事实是
a.HClO酸性强于HBrO
b.稳定性:HBr小于HCl
c.在二者形成的化合物BrCl 中氯显负价,溴显正价
无机阻燃剂中,氢氧化铝和氢氧化镁两种阻燃剂占据着重要位置。两者的阻燃机理都是在达到热分解温度时迅速分解为氧化物与水,起到吸热降温的作用。
(3)写出氢氧化铝在酸性溶液中的电离方程式
写出氢氧化铝与氢氧化钠反应的离子方程式
(4)无水碳酸镁也是一种新型无机阻燃剂,除了具有单位质量吸热量更大的特点外,还能释放具有灭火作用的气体。写出该气体的结构式
您最近一年使用:0次
2015-10-23更新
|
242次组卷
|
2卷引用:2015届上海市民本中学高三第一学期第一次月考化学试卷
填空题
|
适中(0.65)
名校
17. A、B、C、D、E 代表五种元素。请填空:
(1)A 元素基态原子的最外层有 3 个未成对电子,次外层有 2 个电子,其元素符号为_____ , 电子排布图为_____ ,原子核外电子的运动状态有_____ 种。
(2)B 元素的-2 价离子和 C 元素的+1 价离子的电子层结构都与氩原子的相同,B 的原子结构 示意图为_____ ,B、C 所形成的化合物的电子式为_____ 。
(3)D 元素的+3 价离子的 3d 能级为半充满状态,D 的元素名称为________ ,其基态原子的所有 电子占有________ 个原子轨道。
(4)E 元素基态原子的 M 层为全充满状态,N 层没有成对电子,只有一个未成对电子,则 E 的基态原子的电子有________________ 个 伸 展 方 向 ,其基态原子的电子排布式 为_________________________ ,E +的外围电子排布图为_____________________ 。
(1)A 元素基态原子的最外层有 3 个未成对电子,次外层有 2 个电子,其元素符号为
(2)B 元素的-2 价离子和 C 元素的+1 价离子的电子层结构都与氩原子的相同,B 的原子结构 示意图为
(3)D 元素的+3 价离子的 3d 能级为半充满状态,D 的元素名称为
(4)E 元素基态原子的 M 层为全充满状态,N 层没有成对电子,只有一个未成对电子,则 E 的基态原子的电子有
您最近一年使用:0次
2018-12-24更新
|
346次组卷
|
2卷引用:【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高二上学期第二次月考化学试题
三、解答题 添加题型下试题
解答题-无机推断题
|
较易(0.85)
名校
18. X、Y、Z、M、W、Q、R是7种短周期元素,其性质如下:
完成下列填空:
(1)上述元素中,X在周期表中的位置是__ ,由Y、Q形成的简单离子半径大小关系是Y___ Q(填“>”或“<”)。
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为___ ,是18e-分子的有__ 种。
(3)写出证明Z、M非金属性强弱的化学方程式为__ 。
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为___ 。(填选项)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
| 元素代号 | X | Y | Z | M | W | Q | R |
| 原子半径/nm | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | ||
| 主要化合价 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | ||
| 其它 | 焰色为黄色 | 形成气体单质密度最小 |
(1)上述元素中,X在周期表中的位置是
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为
(3)写出证明Z、M非金属性强弱的化学方程式为
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
您最近一年使用:0次
2020-11-14更新
|
149次组卷
|
2卷引用:湖南省衡阳市第一中学2021届高三上学期期中考试化学试题
解答题-实验探究题
|
适中(0.65)
19. 同周期元素从左到右失电子能力逐渐减弱。某研究性学习小组为了用实验的方法验证镁和铝的失电子能力强弱,学生甲和学生乙分别设计了两种不同的方案。
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)上述两个实验方案中实验现象较为明显的是方案__________ 。
(2)学生乙在实验时取了一段黑色的镁带投入稀盐酸中,现象并不明显,请分析原因____________________ 。
(3)学生丙用镁、铝的可溶性盐溶液及一些其他化学试剂进行实验也得出了正确结论,简述学生丙采用的方法:__________________________________________________ 。
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)上述两个实验方案中实验现象较为明显的是方案
(2)学生乙在实验时取了一段黑色的镁带投入稀盐酸中,现象并不明显,请分析原因
(3)学生丙用镁、铝的可溶性盐溶液及一些其他化学试剂进行实验也得出了正确结论,简述学生丙采用的方法:
您最近一年使用:0次
2020-03-02更新
|
69次组卷
|
2卷引用:第1章原子结构与元素周期律第3节课时1 认识同周期元素性质的递变规律
解答题-实验探究题
|
适中(0.65)
20. Ⅰ、某同学想通过下列实验装置来验证硫、碳、硅的非金属性的强弱:

则A中的药品是____________ (写化学式,下同),B中的药品是_________ ,C中的药品是___________ 。
Ⅱ、为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
(1)上表中,反应速率最快的是____ ;
(2)设计实验2、3的目的是____________________ ;
(3)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响___________ 。

则A中的药品是
Ⅱ、为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
| 实验序号 | 温度 | H2O2溶液初始浓度 | MnO2颗粒大小 |
| 1 | 25℃ | 4% | 无MnO2 |
| 2 | 25℃ | 12% | 1g细颗粒MnO2 |
| 3 | 25℃ | 4% | 1g细颗粒MnO2 |
| 4 | 25℃ | 4% | 1g粗颗粒MnO2 |
(2)设计实验2、3的目的是
(3)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响
您最近一年使用:0次
2017-09-19更新
|
244次组卷
|
2卷引用:湖南省双峰县第一中学2017-2018学年高二上期第一次月考化学试题
四、计算题 添加题型下试题
计算题
|
适中(0.65)
21. 某元素及其气态氢化物化学式为H2R,其高价氧化物中氧的质量分数是60%,且该元素的质子数和中子数相等,写出元素R的相对原子质量__________ 和元素符号___________ 。
您最近一年使用:0次
2011-11-24更新
|
1315次组卷
|
3卷引用:2011-2012学年上海市上海理工大学附属中学高二上学期期中考试化学试卷
(已下线)2011-2012学年上海市上海理工大学附属中学高二上学期期中考试化学试卷沪科版化学拓展性课程1《原子结构与元素周期律》测试题福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题
试卷分析
整体难度:适中
考查范围:物质结构与性质、有机化学基础、常见无机物及其应用、化学反应原理、化学实验基础、认识化学科学
试卷题型(共 21题)
题型
数量
单选题
14
填空题
3
解答题
3
计算题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 核外电子能级分布 基态核外电子排布规律 泡利原理 洪特规则 | |
| 2 | 0.85 | 元素周期表结构分析 原子核外电子的排布 核外电子运动 电子排布式 | |
| 3 | 0.85 | 元素周期律实质 | |
| 4 | 0.85 | 金属与非金属在周期表中位置及其性质递变的规律 元素周期律的应用 同周期元素性质递变规律理解及应用 由元素性质的递变规律进行相关推断 | |
| 5 | 0.85 | 同周期元素性质递变规律 同主族元素性质递变规律 元素周期律的应用 元素非金属性强弱的比较方法 | |
| 6 | 0.65 | 同周期元素性质递变规律 电离能变化规律 元素性质与电负性的关系 | |
| 7 | 0.65 | 石蜡油分解实验 乙醇中含有羟基的验证实验 蔗糖水解相关实验 元素非金属性强弱的比较方法 | |
| 8 | 0.65 | 金属与非金属在周期表中位置及其性质递变的规律 “定位法”在推断中的应用 “位构性”关系理解及应用 | |
| 9 | 0.65 | 元素周期律、元素周期表的推断 微粒半径大小的比较方法 化学键与物质类别关系的判断 | |
| 10 | 0.65 | 铵根离子的检验 沉淀转化 元素非金属性强弱的比较方法 化学实验方案的设计与评价 | |
| 11 | 0.65 | 同主族元素性质递变规律 | |
| 12 | 0.65 | 碱金属物理性质及其变化规律 同主族元素性质递变规律 | |
| 13 | 0.65 | 同周期元素性质递变规律理解及应用 元素金属性强弱的比较方法 元素非金属性强弱的比较方法 由元素性质的递变规律进行相关推断 | |
| 14 | 0.65 | 元素周期律、元素周期表的推断 元素金属性与非金属性递变规律的理解及应用 由元素性质的递变规律进行相关推断 “位构性”关系理解及应用 | |
| 二、填空题 | |||
| 15 | 0.65 | 同周期元素性质递变规律 元素金属性与非金属性递变规律的理解及应用 元素非金属性强弱的比较方法 | |
| 16 | 0.65 | 原子结构示意图、离子结构示意图 共价型分子结构式、电子式 元素非金属性强弱的比较方法 | |
| 17 | 0.65 | 电子排布式 轨道表示式 | |
| 三、解答题 | |||
| 18 | 0.85 | 元素周期律、元素周期表的推断 元素非金属性强弱的比较方法 根据物质性质进行元素种类推断 化学键概念理解及判断 | 无机推断题 |
| 19 | 0.65 | 镁的结构与化学性质 氢氧化铝与强碱反应 同周期元素性质递变规律探究实验 元素金属性、非金属性强弱探究实验 | 实验探究题 |
| 20 | 0.65 | 外因对化学反应速率影响的综合分析 同周期元素性质递变规律 | 实验探究题 |
| 四、计算题 | |||
| 21 | 0.65 | 摩尔质量与相对原子质量区别与联系 同周期元素性质递变规律理解及应用 原子中相关数值及其之间的相互关系 | |



