辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
辽宁
高二
期末
2024-01-11
913次
整体难度:
容易
考查范围:
常见无机物及其应用、物质结构与性质、有机化学基础、化学反应原理
辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
辽宁
高二
期末
2024-01-11
913次
整体难度:
容易
考查范围:
常见无机物及其应用、物质结构与性质、有机化学基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 下列有关化学用语表示错误的是
A.氯气的共价键电子云轮廓图: |
| B.二氧化硅的分子式为SiO2 |
C.N2H4的电子式: |
D.基态氧原子电子轨道表示式为: |
您最近一年使用:0次
2024-01-11更新
|
1059次组卷
|
4卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
2. 下列叙述中正确的
| A.p区元素均有p轨道 |
| B.所有元素中,氟的第一电离能最大 |
| C.主族元素的电负性越大,其元素原子的第一电离能不一定越大 |
D.处于最低能量状态原子叫基态原子,1s22s22p →1s22s22p →1s22s22p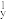 过程中形成的是发射光谱 过程中形成的是发射光谱 |
您最近一年使用:0次
2023-03-05更新
|
695次组卷
|
7卷引用:广东省广东实验中学2022-2023学年高二上学期期末考试化学试题
单选题
|
较易(0.85)
名校
3. 下列说法错误的是
| A.水很稳定是因为水中含有大量氢键 |
| B.乳酸分子[CH3CH(OH)COOH]中含有一个手性碳原子 |
| C.碘易溶于四氯化碳、甲烷难溶于水,二者都可用相似相溶原理解释 |
| D.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
您最近一年使用:0次
2024-01-11更新
|
1145次组卷
|
3卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 氧氰的化学式为(OCN)2,结构式为N C-O-O-C
C-O-O-C N,下列叙述正确的是( )
N,下列叙述正确的是( )
 C-O-O-C
C-O-O-C N,下列叙述正确的是( )
N,下列叙述正确的是( )A.N C键中含有2个σ键和1个π键 C键中含有2个σ键和1个π键 |
| B.分子中含有3个σ键和4个π键 |
C.N C键的键长小于C C键的键长小于C C键的键长 C键的键长 |
| D.分子中只含有极性键 |
【知识点】 共价键的形成及主要类型解读 键能、键长、键角及应用解读
您最近一年使用:0次
2020-04-10更新
|
1140次组卷
|
11卷引用:第2章 化学键与分子间作用力——B拓展区综合拓展(鲁科版选修3)
第2章 化学键与分子间作用力——B拓展区综合拓展(鲁科版选修3)安徽省滁州市明光市明光中学2019-2020高二下学期第二次月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区吉林省长春市第二十九中学2020-2021学年高二下学期期中考试化学试题黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题广东省惠州市惠东县惠东荣超中学2021-2022学年高二下学期期中考试 化学试题广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题广东梅州五华县中英文实验学校2023-2024学年高二下学期3月考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. W、X、Y、Z、R是五种原子序数依次增大的短周期主族元素,W元素的一种离子与Li+具有相同的核外电子排布且半径比Li+大,X的基态原子核外L层的电子数与Y的基态原子核外M层的电子之比为3∶2,X与Z同主族,Z的基态原子价层电子排布式为3s23p4。下列说法错误的是
| A.简单气态氢化物的热稳定性:Z>Y |
| B.原子半径:W<Li |
| C.第一电离能:X>Y |
| D.电负性:R<Z |
您最近一年使用:0次
2024-01-11更新
|
501次组卷
|
3卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
6. 我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是
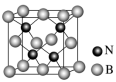

| A.11BN和10BN的性质无差异 |
| B.该晶体中只含有σ键 |
| C.该晶胞中含有14个B原子,4个N原子 |
| D.该晶体具有良好的导电性 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 下列关于物质的结构或性质及解释均正确的是
选项 | 物质的结构或性质 | 解释 |
A | 键角:H2O>NH3 | 水分子中O上孤电子对数比氨分子中N上的多 |
B | 热稳定性:NH3>PH3 | NH3分子间氢键强于PH3分子间作用力 |
C | 熔点:晶体硅>碳化硅 | Si-Si的键能大于C-Si的键能 |
D | 电子云半径:3s>1s | 3s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-05更新
|
494次组卷
|
4卷引用:湖北省恩施州高中教育联盟2022-2023学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
8. 一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的二倍,下列说法正确的是
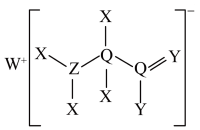
| A.X、Z、Q、W均可与Y形成二元化合物 |
B.简单离子半径: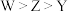 |
| C.Y的氢化物的稳定性和沸点都高于Q的氢化物 |
| D.X、Y、Z三种元素只能形成共价化合物 |
您最近一年使用:0次
2023-11-11更新
|
1285次组卷
|
9卷引用:四川省成都市第七中学2023-2024学年高三上学期期中考试理科综合化学试题
四川省成都市第七中学2023-2024学年高三上学期期中考试理科综合化学试题辽宁省沈阳市东北育才学校高中部2023-2024学年高二上学期第二次月考化学试题辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题江西省宜春市宜丰中学创新部2023-2024学年高二上学期12月月考化学试卷吉林省长春外国语学校2023-2024学年高二下学期开学化学试题广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题(已下线)T11-元素周期表与元素周期律黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期4月月考化学试题吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 物质的组成与结构决定了物质的性质与变化,结构化学是化学研究的重要领域。下列说法正确的是
| A.元素周期系和元素周期表都不只有一个,都是多种多样的 |
| B.在基态14C原子中,核外存在2对自旋相反的电子,其核外电子有4种运动状态 |
C.I 离子的几何构型为V型,其中心原子的杂化形式为sp2杂化 离子的几何构型为V型,其中心原子的杂化形式为sp2杂化 |
D.已知苯酚( )具有弱酸性,其Ka=1.1×10-10;水杨酸( )具有弱酸性,其Ka=1.1×10-10;水杨酸( )第一级电离形成的离子( )第一级电离形成的离子( )能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚) )能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚) |
您最近一年使用:0次
2021-01-15更新
|
747次组卷
|
5卷引用:辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题
单选题
|
较易(0.85)
名校
解题方法
10. 氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物, 原子部分填充在
原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为
原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为 ,下列说法正确的是
,下列说法正确的是
 原子部分填充在
原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为
原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为 ,下列说法正确的是
,下列说法正确的是
A.氮化钼的化学式为 |
B.相邻两个最近的 原子的距离为 原子的距离为 |
C.晶体的密度 |
D.每个钼原子周围与其距离最近的钼原子有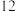 个 个 |
【知识点】 根据晶胞结构确定晶体化学式解读 晶胞的有关计算解读
您最近一年使用:0次
2023-06-16更新
|
171次组卷
|
8卷引用:三轮冲刺卷3-【赢在高考黄金20卷】备战2022年高考化学模拟卷(辽宁专用)
(已下线)三轮冲刺卷3-【赢在高考黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖北省南漳县第一中学2021-2022学年高二下学期3月月考化学试题安徽省定远中学2022-2023学年高二下学期6月阶段性检测化学试题(已下线)选择题11-14(已下线)晶体结构的分析与计算辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题江西省宜春市丰城中学2023-2024学年高二上学期1月期末考试化学试题黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期4月月考化学试题
单选题
|
适中(0.65)
名校
11. 利用超分子可分离C60和C70,将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法正确的是

| A.杯酚与C60形成氢键 |
| B.C60与C70晶体类型不同 |
| C.该分离过程利用的是超分子的分子识别特征 |
| D.一个C60晶胞中含有8个C60分子 |
您最近一年使用:0次
2024-01-11更新
|
495次组卷
|
5卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
单选题
|
较易(0.85)
名校
解题方法
12. 下列与金属腐蚀有关的说法,正确的是
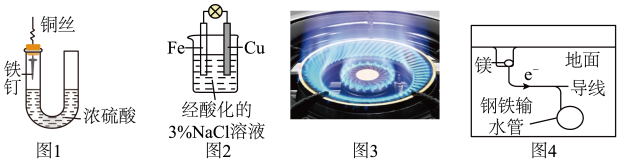

| A.图1中,铁钉易被腐蚀 |
| B.图2中,在铁电极附近滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 |
| C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
【知识点】 金属的电化学腐蚀与防护
您最近一年使用:0次
2016-12-27更新
|
1376次组卷
|
16卷引用:2016-2017学年辽宁省实验中学分校高二上期中化学卷
2016-2017学年辽宁省实验中学分校高二上期中化学卷辽宁省实验中学分校2016-2017学年高二上学期期中考试化学试题山西省临猗县临晋中学2019届高三9月月考化学试题陕西省西安中学2019-2020学年高二上学期期末考试化学试题四川省南充市白塔中学2019-2020学年高二下学期开学考试化学试题四川省成都外国语学校2019-2020学年高二下学期期中考试化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护福建省莆田第一中学2020-2021学年高二上学期期末考试化学试题四川省遂宁市射洪中学2020—2021学年高二下学期期中考试化学试题吉林省长春市第二实验中学2021-2022学年高二上学期10月月考化学试题广东省广州市南海中学2022-2023学年高二上学期期末考试化学试题(已下线)专题六 金属的化学腐蚀与防护(已下线)专题六 金属的化学腐蚀与防护(练习)辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题云南省保山市腾冲市第八中学2023-2024学年高二下学期开学化学试题
单选题
|
适中(0.65)
名校
13. 利用微生物处理有机废水,可在获得电能的同时实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用图甲所示装置处理含 的有机废水,并用该装置在铁上镀铜(如图乙),下列说法不正确的是
的有机废水,并用该装置在铁上镀铜(如图乙),下列说法不正确的是

 的有机废水,并用该装置在铁上镀铜(如图乙),下列说法不正确的是
的有机废水,并用该装置在铁上镀铜(如图乙),下列说法不正确的是
A.电极b应与铜棒相连, 溶液浓度基本保持不变 溶液浓度基本保持不变 |
| B.隔膜1为阴离子交换膜,隔膜2为阳离子交换膜 |
C.当生成 时,模拟海水理论上除盐117g 时,模拟海水理论上除盐117g |
D.a极生物膜上发生的电极反应为: |
您最近一年使用:0次
2023-12-06更新
|
426次组卷
|
2卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高二上学期第二次月考化学试题
14. 已知p(Ba2+)=-lgc(Ba2+)、p(X2-)=-lgc(X2-),常温下BaSO4、BaCO3的沉淀溶解平衡曲线如图所示,下列叙述中正确的是


A.p(Ba2+)=a时,两种盐的饱和溶液中离子浓度c(SO )>c(CO )>c(CO ) ) |
B.M点对应的溶液中Ba2+、CO 能形成BaCO3沉淀 能形成BaCO3沉淀 |
C.相同条件下,SO 比CO 比CO 更易与Ba2+结合形成沉淀 更易与Ba2+结合形成沉淀 |
| D.BaSO4不可能转化为BaCO3 |
您最近一年使用:0次
2021-03-15更新
|
535次组卷
|
6卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高二下学期开学考试化学试题
黑龙江省哈尔滨市第六中学2020-2021学年高二下学期开学考试化学试题(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)T12-难溶电解质的沉淀溶解平衡辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题
单选题
|
适中(0.65)
名校
解题方法
15. 常温下,Ka(CH3COOH)=1.8×10-5,分别向体积均为20 mL,浓度均为0.1 mol·L-1 NaHCO3溶液和CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,滴定曲线如图所示,下列叙述正确的是


A.a点溶液中存在:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| B.b、d点溶液中离子浓度的大小关系均为c(Na+)<c(CH3COO-) |
C.c点溶液中存在:c(H+)+c(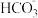 )+c(H2CO3)=c(OH-) )+c(H2CO3)=c(OH-) |
D.d点溶液中存在: =180 =180 |
您最近一年使用:0次
2021-01-15更新
|
707次组卷
|
4卷引用:湖南省益阳市2018届高三4月调研考试理综化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
16. 过渡元素的化合物在生活中有着广泛的应用。请回答下列问题:
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是______ 。Zn位于元素周期表的______ 区。
(2)基态锰原子有______ 种空间运动状态的电子,锰有多种化合价,在+2、+3、+4、+5和+6中,最稳定的化合价是______ 。
(3)基态铁原子有______ 个未成对电子,三价铁离子的电子排布式为______ 。可用硫氰化钾检验氯化铁溶液中的铁离子,形成的血红色配合物中,主要是Fe3+与SCN-以个数比1:1形成的配离子的颜色,含该离子的配合物的化学式是______ 。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)基态锰原子有
(3)基态铁原子有
您最近一年使用:0次
2024-01-11更新
|
644次组卷
|
2卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
三、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
名校
17. 已知X、Y、Z、W、Q、R为前四周期元素,且只有R为金属元素。X原子是元素周期表中半径最小的原子;Y原子的电子占据2个能层且原子中成对的电子数是未成对电子数的2倍;Z的基态原子中有7种运动状态不同的电子;W元素在地壳中含量最多;Q是元素周期表中电负性最大的元素;R+离子的核外电子占据3个能层且完全充满电子。回答下列问题:
(1)R的基态原子的价层电子轨道表示式为:______ 。
(2)Y、Z、W、Q元素的第一电离能由小到大的顺序为(用元素符号表示)______ 。
(3)Z2Q2分子中Z的杂化方式为:______ ;1molZ2Q2分子有______ molσ键。
(4)ZW 的空间结构为:
的空间结构为:______ 。
(5)2019年《Science》杂志报道了制取X2W2的绿色方法,原理如图所示______ mole-
②用该电池电解一定浓度R元素的硫酸盐溶液(电解池电极为惰性电极),写出阳极的电极反应式:______
(1)R的基态原子的价层电子轨道表示式为:
(2)Y、Z、W、Q元素的第一电离能由小到大的顺序为(用元素符号表示)
(3)Z2Q2分子中Z的杂化方式为:
(4)ZW
 的空间结构为:
的空间结构为:(5)2019年《Science》杂志报道了制取X2W2的绿色方法,原理如图所示

②用该电池电解一定浓度R元素的硫酸盐溶液(电解池电极为惰性电极),写出阳极的电极反应式:
您最近一年使用:0次
2024-01-11更新
|
228次组卷
|
2卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
解答题-结构与性质
|
适中(0.65)
18. 铜是人类最早使用的金属之一,用黄铜矿(主要成分为CuFeS2)生产粗铜的反应原理如下:
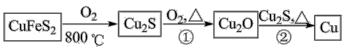
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有______ 种,H2S的沸点比H2O的______ (填“高”或“低”),原因是______ 。
(2)Cu2O和Cu2S均为______ 晶体,Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是______ 。
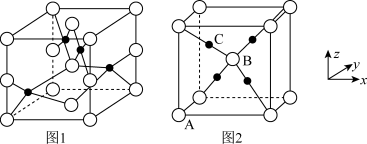
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示______ (填化学式),图2中,A原子坐标参数为(0,0,0),B原子为( ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为______ 。
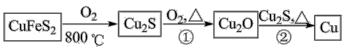
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有
(2)Cu2O和Cu2S均为
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为
【知识点】 氢键对物质性质的影响解读 晶胞的有关计算解读 离子晶体的物理性质
您最近一年使用:0次
四、填空题 添加题型下试题
填空题
|
较易(0.85)
19. 常温下,向100mL 的HA溶液中逐滴加入
的HA溶液中逐滴加入 的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为______ 酸(填“强”或“弱”),理由是______ 。
(2)常温下一定浓度的MA稀溶液的 ,则a
,则a______ (填“>”“<”或“=”)7,用离子方程式表示其原因:______ ,此时,溶液中由水电离出的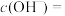
______ 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:______ 。
(4)K点对应的溶液中,
______ (填“>”“<”或“=”) 。
。
 的HA溶液中逐滴加入
的HA溶液中逐滴加入 的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的
 ,则a
,则a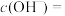
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,

 。
。
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、物质结构与性质、有机化学基础、化学反应原理
试卷题型(共 19题)
题型
数量
单选题
15
填空题
2
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 二氧化硅的用途 电子云 电子排布式 轨道表示式 | |
| 2 | 0.65 | 能层与能级 电子排布式 光谱 电离能 | |
| 3 | 0.85 | 分子的手性 元素性质与电负性的关系 相似相溶原理及应用 氢键对物质性质的影响 | |
| 4 | 0.65 | 共价键的形成及主要类型 键能、键长、键角及应用 | |
| 5 | 0.65 | 元素金属性与非金属性递变规律的理解及应用 根据原子结构进行元素种类推断 电离能变化规律 元素性质与电负性的关系 | |
| 6 | 0.65 | 元素、核素、同位素 共价键的形成及主要类型 晶胞的有关计算 | |
| 7 | 0.65 | 键能、键长、键角及应用 氢键对物质性质的影响 共价晶体的物理性质 | |
| 8 | 0.65 | 元素周期律、元素周期表的推断 微粒半径大小的比较方法 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 9 | 0.65 | 元素周期表结构 洪特规则 利用杂化轨道理论判断化学键杂化类型 弱电解质的电离平衡常数 | |
| 10 | 0.85 | 根据晶胞结构确定晶体化学式 晶胞的有关计算 | |
| 11 | 0.65 | 含有氢键的物质 根据晶胞结构确定晶体化学式 常见分子晶体的结构 | |
| 12 | 0.85 | 金属的电化学腐蚀与防护 | |
| 13 | 0.65 | 原电池原理理解 原电池电极反应式书写 电镀 原电池有关计算 | |
| 14 | 0.85 | 沉淀转化 溶度积规则及其应用 | |
| 15 | 0.65 | 酸碱中和滴定 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、填空题 | |||
| 16 | 0.65 | 电子排布式 元素性质与电负性的关系 配合物的结构与性质 | |
| 19 | 0.85 | 水溶液中水的电离程度及的计算 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 三、解答题 | |||
| 17 | 0.65 | 电解池电极反应式及化学方程式的书写与判断 轨道表示式 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 | 无机推断题 |
| 18 | 0.65 | 氢键对物质性质的影响 晶胞的有关计算 离子晶体的物理性质 | 结构与性质 |



