砷(As)位于元素周期表的第四行与氮、磷同列。砷有多种化合物,用途广泛。完成下列填空:
(1)写出砷原子核外最外层电子的电子排布式。_______ 。
(2)1个砷的氢化物分子中含_______ 个化学键。
(3)砷化镓(GaAs)和氮化镓(GaN)都是原子间以共价键结合而成的晶体。GaAs熔点为1238°C、GaN熔点为1500°C,GaAs熔点低于GaN的原因是_______ 。
亚砷酸(H3AsO3) 可以用于治疗白血病。25°C,向0.1mol·L-1 H3AsO3溶液中滴加0.1mol·L-1KOH溶液,各种微粒的物质的量分数与溶液pH的关系如图所示。
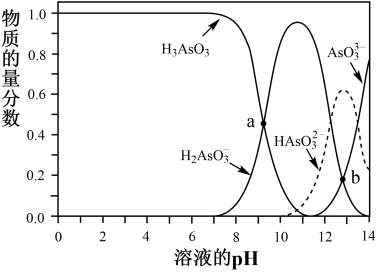
(4)人体血液的pH在7.35~7.45,患者用药后人体中含砷元素的主要微粒是_______ 。
(5)25°C,H2AsO 电离程度小于水解程度,依据是:
电离程度小于水解程度,依据是: _______ 。
(6)以酚酞为指示剂,将KOH溶液滴入H3AsO3溶液中,滴定终点的离子方程式是_______ 。
(7)b点溶液中:c(K+)_______ 2c(HAsO )+4c(AsO
)+4c(AsO ) (选填 “<”“>”或“=”)
) (选填 “<”“>”或“=”)
(1)写出砷原子核外最外层电子的电子排布式。
(2)1个砷的氢化物分子中含
(3)砷化镓(GaAs)和氮化镓(GaN)都是原子间以共价键结合而成的晶体。GaAs熔点为1238°C、GaN熔点为1500°C,GaAs熔点低于GaN的原因是
亚砷酸(H3AsO3) 可以用于治疗白血病。25°C,向0.1mol·L-1 H3AsO3溶液中滴加0.1mol·L-1KOH溶液,各种微粒的物质的量分数与溶液pH的关系如图所示。

(4)人体血液的pH在7.35~7.45,患者用药后人体中含砷元素的主要微粒是
(5)25°C,H2AsO
 电离程度小于水解程度,依据是:
电离程度小于水解程度,依据是: (6)以酚酞为指示剂,将KOH溶液滴入H3AsO3溶液中,滴定终点的离子方程式是
(7)b点溶液中:c(K+)
 )+4c(AsO
)+4c(AsO ) (选填 “<”“>”或“=”)
) (选填 “<”“>”或“=”)
更新时间:2022-04-14 17:40:29
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】回答下列有关问题
(1)KW的数学表达式是KW =__________ ,温度升高KW的变化情况是______ (选填“变大”“变小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行程度越________ ,对于反应2NO2(g)  N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是
N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________ 。
(3)Kα通常表示弱酸的电离平衡常数,Kα值越大表示该弱酸的酸性_______ ,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Kα的变化情况是________ (选填“变大”“变小”或“不变”)
(4)Ksp表示难溶物的溶度积常数,该常数越大表示难溶物在水中的__________ 。
(5)实验室可用NaOH溶液吸收NO2 ,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-) 和c(CH3COO-) 由大到小的顺序为_____________ 。(已知HNO2的电离常数Ka=7.1×10−4 mol/L,CH3COOH的电离常数为:Ka=1.7×10−5 mol/L),可使溶液A和溶液B的pH相等的方法是_____________ 。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH.
(1)KW的数学表达式是KW =
(2)K通常表示化学平衡常数,K值越大表示该反应进行程度越
 N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是
N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是(3)Kα通常表示弱酸的电离平衡常数,Kα值越大表示该弱酸的酸性
(4)Ksp表示难溶物的溶度积常数,该常数越大表示难溶物在水中的
(5)实验室可用NaOH溶液吸收NO2 ,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-) 和c(CH3COO-) 由大到小的顺序为
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH.
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Na2SO3是中学化学中常用的试剂。测定0.1 mol·L-1的Na2SO3溶液的pH与温度关系如下表所示(已知d>c>b>a)。
(1)水的离子积:Kw(a)___________ (填“>”“<”或“=”,下同)Kw(d);水解常数:Kh1(a)___________ Kh1(b)。
(2)分别取a、d时刻的溶液各10 mL,加入足量的用盐酸酸化的BaCl2溶液做对比实验,d时刻溶液产生的白色沉淀比a时刻的多。该白色沉淀的化学式是___________ ,d时刻沉淀比a时刻溶液多的原因是___________ 。
(3)数据显示:a→c的过程中,___________ (填“浓度”或“温度”)对水解平衡移动方向的影响程度更大。
(4)为了证明上述规律的普遍性,可以选择下列物质做类似实验,该物质是___________(填字母)。
| 时刻 | a | b | c | d |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
(1)水的离子积:Kw(a)
(2)分别取a、d时刻的溶液各10 mL,加入足量的用盐酸酸化的BaCl2溶液做对比实验,d时刻溶液产生的白色沉淀比a时刻的多。该白色沉淀的化学式是
(3)数据显示:a→c的过程中,
(4)为了证明上述规律的普遍性,可以选择下列物质做类似实验,该物质是___________(填字母)。
| A.Na2CO3 | B.NaHCO3 | C.Na2S | D.Na2SO4 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】醋酸是一种常见的弱酸,回答下列问题:
(1)下列哪些措施能够使醋酸溶液中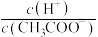 增大___________。
增大___________。
(2)向100mL 0.1 的醋酸中加入V mL 0.1
的醋酸中加入V mL 0.1 的NaOH溶液完全反应后,溶液呈中性,则V
的NaOH溶液完全反应后,溶液呈中性,则V___________ 100mL(填“>”,“<”或“=”)。
(3)在 与
与 的混合溶液中,测得某一时刻混合溶液中:
的混合溶液中,测得某一时刻混合溶液中: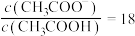 ,则此时溶液的pH=
,则此时溶液的pH=___________ 。(已知: 的电离常数
的电离常数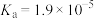 )
)
(4)常温下,将amol/L的醋酸与
 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在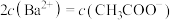 ,则该混合溶液中醋酸的电离常数
,则该混合溶液中醋酸的电离常数
___________ (用含a和b的代数式表示)。
(5)已知室温时0.1
 溶液的电离度约为1%,
溶液的电离度约为1%, 的电离平衡常数
的电离平衡常数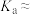
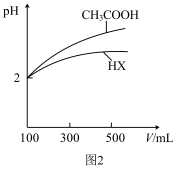
___________ ;室温下,体积均为100mL、pH均为2的 与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数
与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数___________ (填“大于”、“小于”或“等于”) 的电离平衡常数。
的电离平衡常数。
(6)某温度时,纯水的电离平衡曲线如图3所示:该温度下,浓度为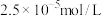 的
的 溶液中由水电离的
溶液中由水电离的
___________ mol/L。

(7)利用 制备
制备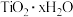 的化学方程式:
的化学方程式:___________ 。
(8)泡沫灭火器(里面装饱和 溶液和
溶液和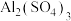 )的工作原理(用离子方程式表示)
)的工作原理(用离子方程式表示)___________ 。
(1)下列哪些措施能够使醋酸溶液中
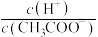 增大___________。
增大___________。| A.升温 | B.通入HCl气体 | C.加入 固体 固体 | D.加入NaOH固体 |
(2)向100mL 0.1
 的醋酸中加入V mL 0.1
的醋酸中加入V mL 0.1 的NaOH溶液完全反应后,溶液呈中性,则V
的NaOH溶液完全反应后,溶液呈中性,则V(3)在
 与
与 的混合溶液中,测得某一时刻混合溶液中:
的混合溶液中,测得某一时刻混合溶液中: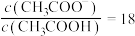 ,则此时溶液的pH=
,则此时溶液的pH= 的电离常数
的电离常数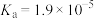 )
)(4)常温下,将amol/L的醋酸与

 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在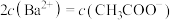 ,则该混合溶液中醋酸的电离常数
,则该混合溶液中醋酸的电离常数
(5)已知室温时0.1

 溶液的电离度约为1%,
溶液的电离度约为1%, 的电离平衡常数
的电离平衡常数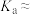
 与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数
与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数 的电离平衡常数。
的电离平衡常数。
(6)某温度时,纯水的电离平衡曲线如图3所示:该温度下,浓度为
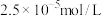 的
的 溶液中由水电离的
溶液中由水电离的

(7)利用
 制备
制备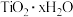 的化学方程式:
的化学方程式:(8)泡沫灭火器(里面装饱和
 溶液和
溶液和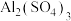 )的工作原理(用离子方程式表示)
)的工作原理(用离子方程式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在常温25℃下,回答下列问题:
(1) 的水解常数
的水解常数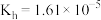 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显___________ (填“酸”“碱”或“中”)性,该溶液中各离子浓度由大到小的顺序为___________ 。
(2) 可用氨水吸收生成
可用氨水吸收生成 ,将
,将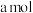
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是___________ (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________  (
( 的电离平衡常数取
的电离平衡常数取 )。
)。
(3)向氨水中加入 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
___________ (填“>”“<”或“=”)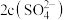 ,此时混合溶液中
,此时混合溶液中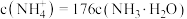 ,则
,则 的电离常数
的电离常数 为
为___________ 。
(1)
 的水解常数
的水解常数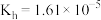 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显(2)
 可用氨水吸收生成
可用氨水吸收生成 ,将
,将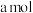
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是 (
( 的电离平衡常数取
的电离平衡常数取 )。
)。(3)向氨水中加入
 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
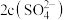 ,此时混合溶液中
,此时混合溶液中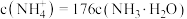 ,则
,则 的电离常数
的电离常数 为
为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.回答下列问题
(1)下列能说明醋酸溶液一定呈酸性的是___________ 。
a.含 的溶液 b.能使酚酞呈无色的溶液
的溶液 b.能使酚酞呈无色的溶液
c. 的溶液 d.
的溶液 d.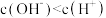
(2)①25℃时, 醋酸加水稀释至
醋酸加水稀释至 ,下列说法正确的是
,下列说法正确的是___________ 。
a.溶液中 不变 b.溶液中
不变 b.溶液中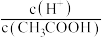 不变
不变
c.醋酸电离平衡正向移动, 增大 d.
增大 d. 减小
减小
②下列物质溶于水时会破坏水的电离平衡,且属于电解质的是___________ 。
a.氨气 b.硫酸氢钠 c.氯化钾 d.醋酸钠
Ⅱ.取 一定浓度的硫酸溶液,用
一定浓度的硫酸溶液,用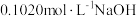 标准溶液滴定。实验数据如下:
标准溶液滴定。实验数据如下:
(3)若实验选用酚酞做指示剂,滴定至终点的现象是___________ ,根据上表数据计算硫酸溶液的物质的量浓度为___________ (保留4位小数)。
Ⅲ.将等体积、等pH的 溶液和HNO2溶液分别加水稀释,pH随加水稀释倍数的变化如图所示。
溶液和HNO2溶液分别加水稀释,pH随加水稀释倍数的变化如图所示。

(4)比较a、b、c三点水的电离程度最大的是___________ 。
a.a b.b c.c
(5)已知25℃时, 的溶度积常数
的溶度积常数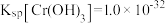 。则使
。则使 恰好完全沉淀(即溶液中
恰好完全沉淀(即溶液中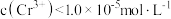 时),应调节pH的最小值为多少
时),应调节pH的最小值为多少___________ 。
Ⅳ.已知:25℃时 、
、 和
和 (亚磷酸)的电离平衡常数:
(亚磷酸)的电离平衡常数:
(6)书写 溶液中加入足量醋酸的离子方程式
溶液中加入足量醋酸的离子方程式___________ 。
(7)NaHS是一种重要的化工原料,在化肥工业用于脱去活性炭脱硫剂中的单体硫,在采矿工业大量用于铜矿选矿,在人造纤维生产中用于亚硫酸染色等。写出NaHS溶液中的电荷守恒___________ ;NaHS溶液中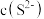
___________  (填“>”、“=”或“<”),通过计算解释原因
(填“>”、“=”或“<”),通过计算解释原因___________ 。
(1)下列能说明醋酸溶液一定呈酸性的是
a.含
 的溶液 b.能使酚酞呈无色的溶液
的溶液 b.能使酚酞呈无色的溶液c.
 的溶液 d.
的溶液 d.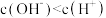
(2)①25℃时,
 醋酸加水稀释至
醋酸加水稀释至 ,下列说法正确的是
,下列说法正确的是a.溶液中
 不变 b.溶液中
不变 b.溶液中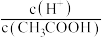 不变
不变c.醋酸电离平衡正向移动,
 增大 d.
增大 d. 减小
减小②下列物质溶于水时会破坏水的电离平衡,且属于电解质的是
a.氨气 b.硫酸氢钠 c.氯化钾 d.醋酸钠
Ⅱ.取
 一定浓度的硫酸溶液,用
一定浓度的硫酸溶液,用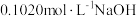 标准溶液滴定。实验数据如下:
标准溶液滴定。实验数据如下:| 实验次数 | 1 | 2 | 3 | 4 |
 | 19.82 | 19.80 | 22.00 | 19.78 |
(3)若实验选用酚酞做指示剂,滴定至终点的现象是
Ⅲ.将等体积、等pH的
 溶液和HNO2溶液分别加水稀释,pH随加水稀释倍数的变化如图所示。
溶液和HNO2溶液分别加水稀释,pH随加水稀释倍数的变化如图所示。
(4)比较a、b、c三点水的电离程度最大的是
a.a b.b c.c
(5)已知25℃时,
 的溶度积常数
的溶度积常数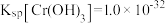 。则使
。则使 恰好完全沉淀(即溶液中
恰好完全沉淀(即溶液中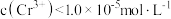 时),应调节pH的最小值为多少
时),应调节pH的最小值为多少Ⅳ.已知:25℃时
 、
、 和
和 (亚磷酸)的电离平衡常数:
(亚磷酸)的电离平衡常数:| 化学式 |  |  |  (亚磷酸) (亚磷酸) |
电离平衡常数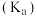 | 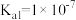 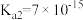 | 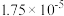 | 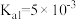 , ,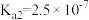 |
(6)书写
 溶液中加入足量醋酸的离子方程式
溶液中加入足量醋酸的离子方程式(7)NaHS是一种重要的化工原料,在化肥工业用于脱去活性炭脱硫剂中的单体硫,在采矿工业大量用于铜矿选矿,在人造纤维生产中用于亚硫酸染色等。写出NaHS溶液中的电荷守恒
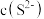
 (填“>”、“=”或“<”),通过计算解释原因
(填“>”、“=”或“<”),通过计算解释原因
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氯在饮用水处理中常用作杀菌剂,且 的杀菌能力比
的杀菌能力比 强。
强。 时氯气-氯水体系中存在以下平衡关系:
时氯气-氯水体系中存在以下平衡关系:
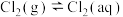

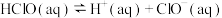



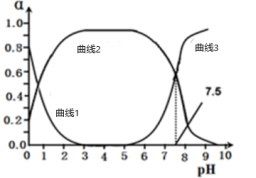
已知该体系中,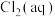 、
、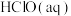 和
和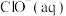 在三者中所占分数
在三者中所占分数 随
随 变化的关系如图所示。
变化的关系如图所示。
回答下列问题:
(1)该体系中, 所占分类
所占分类 随
随 变化的关系是
变化的关系是____________ 。(曲线1、曲线2或曲线3)
(2)在氯水中,下列有关说法正确的是____________ (选填编号)。
a.
b.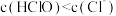
c.
d.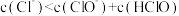
(3)反应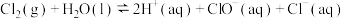 的化学平衡常数
的化学平衡常数
____________ 。
(4)请解释氯处理饮用水时,冬季的杀菌效果比夏季效果好的原因____________ 。
 的杀菌能力比
的杀菌能力比 强。
强。 时氯气-氯水体系中存在以下平衡关系:
时氯气-氯水体系中存在以下平衡关系: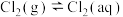

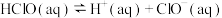



已知该体系中,
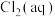 、
、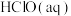 和
和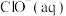 在三者中所占分数
在三者中所占分数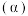 随
随 变化的关系如图所示。
变化的关系如图所示。
回答下列问题:
(1)该体系中,
 所占分类
所占分类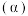 随
随 变化的关系是
变化的关系是(2)在氯水中,下列有关说法正确的是
a.

b.
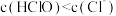
c.

d.
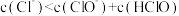
(3)反应
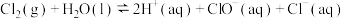 的化学平衡常数
的化学平衡常数
(4)请解释氯处理饮用水时,冬季的杀菌效果比夏季效果好的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】室温下,用0.1000mol·L−1NaOH滴定20.00mL0.1000mol·L−1HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。
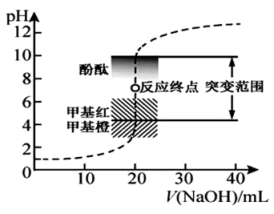
(1)酸碱式滴定管在加溶液滴定前,需要的操作是___________ 和___________ 。
(2)配制上述NaOH标准溶液时,下列仪器中不必要 用到的有___________ 。(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(3)当V(NaOH)=20.00mL时,溶液中所有离子的浓度存在的关系是___________ 。
(4)已知lg5=0.7.当加入的V(NaOH)=30.00mL时,溶液中pH=___________ 。
(5)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+和CrO 反应生成砖红色沉淀表示滴定终点。当溶液中的Cl-恰好完全沉淀时,溶液中的c(Ag+)=
反应生成砖红色沉淀表示滴定终点。当溶液中的Cl-恰好完全沉淀时,溶液中的c(Ag+)=___________ mol/L;c(CrO )=
)=___________ mol/L;
已知:①25℃时,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10;

(1)酸碱式滴定管在加溶液滴定前,需要的操作是
(2)配制上述NaOH标准溶液时,下列仪器中
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(3)当V(NaOH)=20.00mL时,溶液中所有离子的浓度存在的关系是
(4)已知lg5=0.7.当加入的V(NaOH)=30.00mL时,溶液中pH=
(5)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+和CrO
 反应生成砖红色沉淀表示滴定终点。当溶液中的Cl-恰好完全沉淀时,溶液中的c(Ag+)=
反应生成砖红色沉淀表示滴定终点。当溶液中的Cl-恰好完全沉淀时,溶液中的c(Ag+)= )=
)=已知:①25℃时,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10;
②当溶液中某种离子的浓度等于或小于1.0×10-5mol/L时,可认为已完全沉淀。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】
(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比______________________________ 。
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO−) + c(CH3COOH)=_______ mol/L
c(H+)_______ c(CH3COO−) - c(CH3COOH) +2c(OH−) (填“>”、“<”或“=”)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是__________________________________________ 。
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是_________ 。
(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO−) + c(CH3COOH)=
c(H+)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题
(1)将FeCl3溶液进行蒸干,得到的固体化学式为_______
(2)25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中铵根离子浓度分别为a、b、c(单位为mol/L),由大到小_______ 。
(3)在日常生活中经常用Al2(SO4)3和NaHCO3混合溶液作灭火剂,请用离子方程式表示其灭火原理:_______ 。
(4)某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为2.0mol/L,通常认为残留在溶液中的离子浓度小于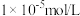 时即沉淀完全(注:lg2=0.3),已知
时即沉淀完全(注:lg2=0.3),已知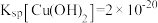 ,
,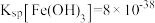 ,则:
,则:
①该溶液中的Fe3+刚好沉淀完全时溶液的pH为_______ ;
②该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH为_______ ;
(5)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=_______
(1)将FeCl3溶液进行蒸干,得到的固体化学式为
(2)25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中铵根离子浓度分别为a、b、c(单位为mol/L),由大到小
(3)在日常生活中经常用Al2(SO4)3和NaHCO3混合溶液作灭火剂,请用离子方程式表示其灭火原理:
(4)某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为2.0mol/L,通常认为残留在溶液中的离子浓度小于
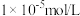 时即沉淀完全(注:lg2=0.3),已知
时即沉淀完全(注:lg2=0.3),已知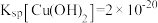 ,
,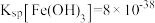 ,则:
,则:①该溶液中的Fe3+刚好沉淀完全时溶液的pH为
②该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH为
(5)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)写出铜原子价电子排布式:______ 。与铜同一周期的副族元素原子中最外层电子数与铜原子的相同的元素有________ (填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有______ 种。
(3)某种原子的结构示意图为 。则该原子的核电荷数x取值范围为
。则该原子的核电荷数x取值范围为______ 。
(4)Cr在周期表中位于_____ 周期___ 族,属于___ 区,价电子排布图为______
(5)ClO4-互为等电子体的分子或离子为____ 。
(6)Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为_____ 。
(2)第三周期第一电离能处于Al和P之间的元素有
(3)某种原子的结构示意图为
 。则该原子的核电荷数x取值范围为
。则该原子的核电荷数x取值范围为(4)Cr在周期表中位于
(5)ClO4-互为等电子体的分子或离子为
(6)Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】请填空:
(1)A元素L能层p电子数比s电子数多2个,A的元素符号为______ ;B元素M能层p电子数为s电子数的一半,B的元素名称为______ 。
(2)下图是s能级和p能级的原子轨道图。____ 形,每个s能级有____ 个原子轨道;p电子的原子轨道呈____ 形,每个p能级有____ 个原子轨道。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素符号为____ ,其基态原子的核外电子排布式为______ 。
(4)常温下,向100 mL 0.01 mol⋅L HA溶液中逐滴加入0.02 mol⋅L
HA溶液中逐滴加入0.02 mol⋅L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。
MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。_____ (填“强”或“弱”)酸。常温下一定浓度的MA稀溶液的 ,则a
,则a_____ (填“>”“<”或“=”)7,用离子方程式表示其原因:______ 。
(1)A元素L能层p电子数比s电子数多2个,A的元素符号为
(2)下图是s能级和p能级的原子轨道图。
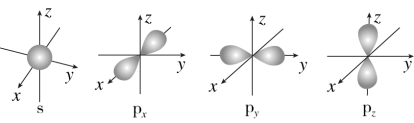
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素符号为
(4)常温下,向100 mL 0.01 mol⋅L
 HA溶液中逐滴加入0.02 mol⋅L
HA溶液中逐滴加入0.02 mol⋅L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。
MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题。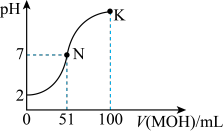
 ,则a
,则a
您最近一年使用:0次




