人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq)、②NaUr(s)
Ur-(尿酸根,aq)+H+(aq)、②NaUr(s) Ur-(aq)+Na+(aq)。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Ur-(aq)+Na+(aq)。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,Ka(HUr)=4×10-6,Kw=2.4×10-14,Ksp(NaUr)=6.4×10-5。
②37℃时,模拟关节滑液pH=7.4,c(Ur-)=4.6×10-4mol•L-1。
(1)37℃时,0.01mol•L-1HUr溶液的pH约为______ (已知lg2=0.3)。
(2)下列事实可以证明尿酸是弱电解质的是______ (填字母)。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)______ c(Ur-)(填“>”“<”或“=”)。
(4)关节炎发作大都在脚趾和手指的关节处,反应②是______ (填“放热”或“吸热”)反应。
(5)对于尿酸偏高的人群,下列建议正确的是______ (填字母)。
 Ur-(尿酸根,aq)+H+(aq)、②NaUr(s)
Ur-(尿酸根,aq)+H+(aq)、②NaUr(s) Ur-(aq)+Na+(aq)。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Ur-(aq)+Na+(aq)。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,Ka(HUr)=4×10-6,Kw=2.4×10-14,Ksp(NaUr)=6.4×10-5。
②37℃时,模拟关节滑液pH=7.4,c(Ur-)=4.6×10-4mol•L-1。
(1)37℃时,0.01mol•L-1HUr溶液的pH约为
(2)下列事实可以证明尿酸是弱电解质的是
| A.NaUr溶液显碱性 |
| B.HUr溶液可使石蕊溶液变红 |
| C.常温下,等浓度的尿酸溶液导电性比盐酸弱 |
| D.10mL0.01mol•L-1HUr溶液与10mL0.01mol•L-1NaOH溶液完全反应 |
(4)关节炎发作大都在脚趾和手指的关节处,反应②是
(5)对于尿酸偏高的人群,下列建议正确的是
| A.多喝水,食用新鲜蔬果 | B.饮食宜多盐、多脂 |
| C.适度运动,注意关节保暖 | D.减少摄入易代谢出尿酸的食物 |
更新时间:2023-03-10 01:29:56
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业合成氨原理:N2(g)+3H2(g) 2NH3(g) ∆H<0。
2NH3(g) ∆H<0。
(1)下列关于合成氨的说法正确的是_______ 。
A.合成氨是目前自然固氮最重要的途径
B.合成氨反应的∆H与温度有关,而∆S与温度无关
C.合成氨反应常采用400~500℃是综合考虑了反应速率与平衡产率的矛盾
D.将原料气加压至10MPa~30MPa,是为了保证尽可能高的平衡转化率和快的反应速率
E.合成氨生产过程中将NH3液化分离,是为了加快正反应速率,提高N2、H2的转化率
(2)已知某温度下合成氨反应达平衡时各物质均为 ,容器容积为VL,保持温度和压强不变,又充入3amol N2后,平衡
,容器容积为VL,保持温度和压强不变,又充入3amol N2后,平衡_______ (填“向左”、“向右”或“不”)移动。
(3) 压强下,向密闭容器中充入一定量的N2和H2,相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
压强下,向密闭容器中充入一定量的N2和H2,相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
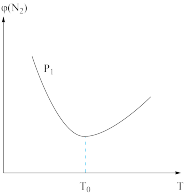
①N2的体积分数随温度升高先减小后增大的原因是_______ 。
②研究表明,温度越高,温度对平衡的影响大于压强对平衡的影响。保持其他条件不变,请在上图中画出P2压强下 (P2>P1)N2的体积分数与温度(T)的关系趋势图_______ 。
(4)LiH-3d过渡金属复合催化剂可用于催化合成氨,已知N2被吸附发生反应3LiH+N2=Li2NH+LiNH2,用一个化学方程式表示H2被吸附发生的反应_______ 。
 2NH3(g) ∆H<0。
2NH3(g) ∆H<0。(1)下列关于合成氨的说法正确的是
A.合成氨是目前自然固氮最重要的途径
B.合成氨反应的∆H与温度有关,而∆S与温度无关
C.合成氨反应常采用400~500℃是综合考虑了反应速率与平衡产率的矛盾
D.将原料气加压至10MPa~30MPa,是为了保证尽可能高的平衡转化率和快的反应速率
E.合成氨生产过程中将NH3液化分离,是为了加快正反应速率,提高N2、H2的转化率
(2)已知某温度下合成氨反应达平衡时各物质均为
 ,容器容积为VL,保持温度和压强不变,又充入3amol N2后,平衡
,容器容积为VL,保持温度和压强不变,又充入3amol N2后,平衡(3)
 压强下,向密闭容器中充入一定量的N2和H2,相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
压强下,向密闭容器中充入一定量的N2和H2,相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
①N2的体积分数随温度升高先减小后增大的原因是
②研究表明,温度越高,温度对平衡的影响大于压强对平衡的影响。保持其他条件不变,请在上图中画出P2压强下 (P2>P1)N2的体积分数与温度(T)的关系趋势图
(4)LiH-3d过渡金属复合催化剂可用于催化合成氨,已知N2被吸附发生反应3LiH+N2=Li2NH+LiNH2,用一个化学方程式表示H2被吸附发生的反应
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】工业级氯化钙(CaCl2)通常用作道路的融雪除冰和干燥剂,主要利用纯碱工业废液生产。完成下列填空:
(1)氯原子的核外电子排布式_______ ;氯化钙的电子式_______ ;比较构成CaCl2的微粒半径大小(用微粒符号表示)_______
(2)纯碱生产的工业方法有多种,其中废液含有大量氯化钙的是_______ 制碱法
(3)氯化钙不能干燥NH3,因为CaCl2(s)+8NH3(g)⇌CaCl2·8NH3(s)+Q(Q>0),该反应的平衡常数K=_______ ;向2L装有CaCl2的密闭容器中,通入2molNH3,反应10分钟,固体增重17g,则0~10分钟内,NH3的平均反应速率v=_______ ;若要将已吸收的CaCl2重新恢复吸收NH3的能力,写出一种可采取的措施_______
(1)氯原子的核外电子排布式
(2)纯碱生产的工业方法有多种,其中废液含有大量氯化钙的是
(3)氯化钙不能干燥NH3,因为CaCl2(s)+8NH3(g)⇌CaCl2·8NH3(s)+Q(Q>0),该反应的平衡常数K=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】乙酸是典型的有机酸,在生产、生活中有广泛应用。
I.乙酸是一种弱酸,结构式如图所示。
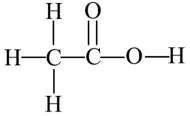
(1)若按照共用电子对是否偏移对共价键分类,乙酸中共价键类型是___________ 。
(2)常温下,Ka(CH3COOH)=Kb(NH3·H2O)≈2.0×10-5。
①0.1mol∙L-1 CH3COONH4溶液中离子浓度大小关系式为___________ 。
②0.2mol·L-1 CH3COONH4溶液和0.1mol·L-1 NaOH溶液等体积混合,所得混合溶液pH___________ 7(填“>”“<”或“=”)
(3)利用电催化还原CO2制备CH3COOH的装置如图所示。

b电极名称是___________ (填“正极”或“负极”);阴极的电极反应式为___________ 。
II.乙酸作化工原料可以制备氢气。
①热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ΔH1=+213.7kJ∙mol-1
②脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ΔH2=-33.5kJ∙mol-1
(4)已知:键能E(C—H)=416kJ∙mol-1,E(H—H)=436kJ∙mol-1,E(C=O)=745kJ∙mol-1,根据2CO(g)+2H2(g)=CH4(g)+CO2(g)计算C≡O的键能为___________ kJ∙mol-1 (提示:CO、CO2的结构式依次为C≡O、O=C=O。)
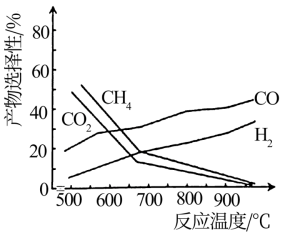
(5)向密闭容器中充入乙酸气体制备氢气,测得温度与产物的选择性关系如图所示。
(提示:H2的选择性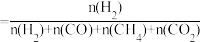 ×100%)
×100%)
①650℃之前,脱羧基反应速率大于热裂解反应,导致H2的选择性低于CH4.由此推知,脱羧基反应的正反应活化能___________ (填“大于”或“小于”)热裂解反应的正反应活化能;650℃时达到平衡状态,此后,H2的选择性高于CH4,主要原因是___________ (从平衡移动角度分析)。
②根据化学方程式,CH4和CO2的选择性相等,CO和H2的选择性相等,而实际情况CO和H2选择性不同,可能的主要原因是___________ 。(用化学方程式表示)。
I.乙酸是一种弱酸,结构式如图所示。

(1)若按照共用电子对是否偏移对共价键分类,乙酸中共价键类型是
(2)常温下,Ka(CH3COOH)=Kb(NH3·H2O)≈2.0×10-5。
①0.1mol∙L-1 CH3COONH4溶液中离子浓度大小关系式为
②0.2mol·L-1 CH3COONH4溶液和0.1mol·L-1 NaOH溶液等体积混合,所得混合溶液pH
(3)利用电催化还原CO2制备CH3COOH的装置如图所示。

b电极名称是
II.乙酸作化工原料可以制备氢气。
①热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ΔH1=+213.7kJ∙mol-1
②脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ΔH2=-33.5kJ∙mol-1
(4)已知:键能E(C—H)=416kJ∙mol-1,E(H—H)=436kJ∙mol-1,E(C=O)=745kJ∙mol-1,根据2CO(g)+2H2(g)=CH4(g)+CO2(g)计算C≡O的键能为
(5)向密闭容器中充入乙酸气体制备氢气,测得温度与产物的选择性关系如图所示。

(提示:H2的选择性
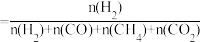 ×100%)
×100%)①650℃之前,脱羧基反应速率大于热裂解反应,导致H2的选择性低于CH4.由此推知,脱羧基反应的正反应活化能
②根据化学方程式,CH4和CO2的选择性相等,CO和H2的选择性相等,而实际情况CO和H2选择性不同,可能的主要原因是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.常温下,浓度均为0.1 mol/L的7种溶液pH如下:
请由上表数据回答:
(1)上述表中pH=12的Na2CO3溶液中水电离出的氢氧根离子浓度为:____________ mol/L
(2)pH=6.0的NaHSO3溶液中微粒浓度大小比较:_________________________
(3)NaHSO4溶液的电离方程式为:__________________________
(4)根据表中的数据分析,物质的量浓度均为0.1mol/L的Na2CO3、Na2SiO3、NaHCO3溶液中水的电离程度最大的是:_____________________________ (填化学式)
(5)用离子方程式说明Na2SO3溶液pH>7的原因______________________ 。
II.用含有CuO、SiO2和少量FeO·xFe2O3的废料制备无水CuCl2固体,工艺流程如下(部分操作和条件略):
a.向废料中加入过量稀盐酸,过滤:
b.向滤液中通入过量的氯气,再加入适当的物质调节溶液的pH约为3.2—4.7;过滤。
c.将滤液加热、浓缩、冷却、结晶、过滤,得到产品。
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
回答下列问题:
(6)步骤a过滤时用到的玻璃仪器是:________________________________
(7)步骤b中,通入过量氯气时的离子方程式:______________________
(8)步骤b中加入适当的物质可以是
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaHSO4 | NaClO |
| pH | 12 | 9.7 | 12.3 | 10.0 | 6.0 | 1.0 | 10.3 |
(1)上述表中pH=12的Na2CO3溶液中水电离出的氢氧根离子浓度为:
(2)pH=6.0的NaHSO3溶液中微粒浓度大小比较:
(3)NaHSO4溶液的电离方程式为:
(4)根据表中的数据分析,物质的量浓度均为0.1mol/L的Na2CO3、Na2SiO3、NaHCO3溶液中水的电离程度最大的是:
(5)用离子方程式说明Na2SO3溶液pH>7的原因
II.用含有CuO、SiO2和少量FeO·xFe2O3的废料制备无水CuCl2固体,工艺流程如下(部分操作和条件略):
a.向废料中加入过量稀盐酸,过滤:
b.向滤液中通入过量的氯气,再加入适当的物质调节溶液的pH约为3.2—4.7;过滤。
c.将滤液加热、浓缩、冷却、结晶、过滤,得到产品。
已知:生成氢氧化物沉淀的pH
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
回答下列问题:
(6)步骤a过滤时用到的玻璃仪器是:
(7)步骤b中,通入过量氯气时的离子方程式:
(8)步骤b中加入适当的物质可以是
| A.NaOH | B.Cu | C.CuO | D.Cu(OH)2 |
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】镁是最轻的结构金属材料之一,又具有比强度和比刚度高、阻尼性和切削性好、易于回收等优点。国内外将镁合金应用于汽车行业,以减重、节能、降低污染,改善环境。但金属镁性质活泼,能与空气中的O2、N2、CO2等反应,也能与沸水反应。其中,Mg与N2反应的产物Mg3N2与水反应:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。请回答下列问题:
(1)甲组学生研究Mg能在CO2气体中燃烧,并研究其产物。将镁条在空气中加热点燃后迅速插入盛放CO2气体的集气瓶中,观察到的现象是_________________________ ;化学反应方程式是________________ ;
(2)乙组学生根据上述甲组实验,认为Mg能在NO2中燃烧,可能产物为MgO、N2和Mg3N2。通过如下实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。
已知:NO2气体能被NaOH吸收。NH3·H2O的电离常数与CH3COOH电离常数相等,均为1.75×10-5。
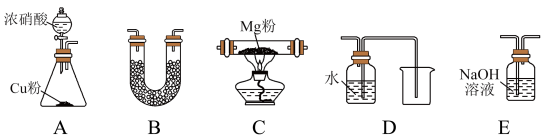
①乙组同学的装置中,依次连接的顺序为A____________ (填字母序号);装置B中的作用是_________ ;
②确定产物中有N2生成的实验现象为____________________________________ ;
(3)设计实验证明:
①产物中存在Mg3N2:________________________________ ;
②MgO和Mg(OH)2溶于铵盐溶液是与 直接反应,不是与
直接反应,不是与 水解出来的H+反应:
水解出来的H+反应:___________ 。
(1)甲组学生研究Mg能在CO2气体中燃烧,并研究其产物。将镁条在空气中加热点燃后迅速插入盛放CO2气体的集气瓶中,观察到的现象是
(2)乙组学生根据上述甲组实验,认为Mg能在NO2中燃烧,可能产物为MgO、N2和Mg3N2。通过如下实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。
已知:NO2气体能被NaOH吸收。NH3·H2O的电离常数与CH3COOH电离常数相等,均为1.75×10-5。

①乙组同学的装置中,依次连接的顺序为A
②确定产物中有N2生成的实验现象为
(3)设计实验证明:
①产物中存在Mg3N2:
②MgO和Mg(OH)2溶于铵盐溶液是与
 直接反应,不是与
直接反应,不是与 水解出来的H+反应:
水解出来的H+反应:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】将过量的 溶液滴入到一定量
溶液滴入到一定量 溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
(一)猜想与假设
猜想一:固体为 。
。
猜想二:固体为 ,理由:
,理由: 溶液呈
溶液呈_______ (填“酸性”或“碱性”)。
猜想三:固体为 和
和 的混合物。
的混合物。
(二)查阅资料
① 和
和 晶体均不带结晶水;
晶体均不带结晶水;
② 、
、 受热易分解分别生成两种氧化物。
受热易分解分别生成两种氧化物。
(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经_______ 、洗涤、低温烘干得蓝色固体。
Ⅱ.用如图所示装置,探究固体的成分。
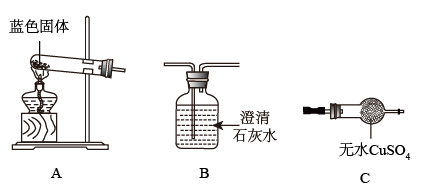
(1)若用装置A、B组合进行实验,B中无现象,则猜想_______ 正确。
(2)若用装置A、C组合进行实验,C中无现象,则猜想_______ 正确。
(3)小组同学将装置按A、_______ 、_______ (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的。实验中:B中的现象为_______ ,C中的现象为_______ 。
(四)实验结论:固体为 和
和 的混合物。
的混合物。
经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的 溶液和一定量
溶液和一定量 反应的离子方程式
反应的离子方程式_______ 。
 溶液滴入到一定量
溶液滴入到一定量 溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。(一)猜想与假设
猜想一:固体为
 。
。猜想二:固体为
 ,理由:
,理由: 溶液呈
溶液呈猜想三:固体为
 和
和 的混合物。
的混合物。(二)查阅资料
①
 和
和 晶体均不带结晶水;
晶体均不带结晶水;②
 、
、 受热易分解分别生成两种氧化物。
受热易分解分别生成两种氧化物。(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经
Ⅱ.用如图所示装置,探究固体的成分。

(1)若用装置A、B组合进行实验,B中无现象,则猜想
(2)若用装置A、C组合进行实验,C中无现象,则猜想
(3)小组同学将装置按A、
(四)实验结论:固体为
 和
和 的混合物。
的混合物。经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的
 溶液和一定量
溶液和一定量 反应的离子方程式
反应的离子方程式
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1mol•L-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___ ,在该溶液中各种离子浓度由大到小的顺序为___ 。
(2)B为0.1mol•L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__ (用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__ ,目的是___ ;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___ 。
(1)A为0.1mol•L-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:
(2)B为0.1mol•L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________ (填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___________________________________________ 。
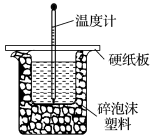
(2)实验室用50mL0.50mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为___________________________ ;实验室提供了0.50mol·L-1和0.55mol·L-1两种浓度的NaOH溶液,应选择___________ mol·L-1的NaOH溶液进行实验。
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
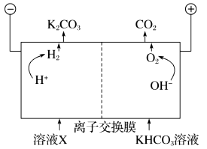
①在阳极区发生的反应包括__________________________________ 和H++HCO ===H2O+CO2↑。
===H2O+CO2↑。
②简述CO 在阴极区再生的原理:
在阴极区再生的原理:____________________________________ 。
(4)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,试计算溶液中 =
=_______ 。(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)实验室用50mL0.50mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为

(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括
 ===H2O+CO2↑。
===H2O+CO2↑。②简述CO
 在阴极区再生的原理:
在阴极区再生的原理:(4)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,试计算溶液中
 =
=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】现对0.1 mol/L的纯碱溶液进行相关研究。
(1)用pH试纸测定该溶液的pH,其正确的操作______________________________ 。
(2)由上测得纯碱溶液呈碱性,请用离子方程式表示其原因:_________________ 。
(3)某同学根据所学知识对溶液进行分析,写出了以下四个关系式。请你判断:在正确的关系式后面打“√”,在错误的后面写出正确的关系式。
①c(Na+)=2c( )+2c(
)+2c( )
)________________________________________ ;
②c(Na+)+ c(H+)=2 c( )+ c(
)+ c( )+ c(OH-)
)+ c(OH-)____________________________ ;
③c(OH-)=c( )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)_________________________________ ;
④c(Na+)>c( )> c(OH-)> c(
)> c(OH-)> c( )
) __________________________________ 。
(1)用pH试纸测定该溶液的pH,其正确的操作
(2)由上测得纯碱溶液呈碱性,请用离子方程式表示其原因:
(3)某同学根据所学知识对溶液进行分析,写出了以下四个关系式。请你判断:在正确的关系式后面打“√”,在错误的后面写出正确的关系式。
①c(Na+)=2c(
 )+2c(
)+2c( )
)②c(Na+)+ c(H+)=2 c(
 )+ c(
)+ c( )+ c(OH-)
)+ c(OH-)③c(OH-)=c(
 )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)④c(Na+)>c(
 )> c(OH-)> c(
)> c(OH-)> c( )
)
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含 P4和少量CaO、Fe2O3、A12O3、CaC12等)为原料制备 NaH2PO2·H2O的工艺流程如下:
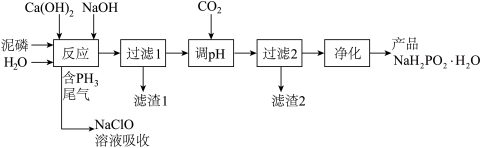
已知P4与两种碱的反应主要有:
I.2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
II.4NaOH+P4+8H2O= 4NaH2PO2·H2O+2H2↑
III.4NaOH+P4+2H2O=2Na2HPO3+2PH3↑
IV.NaH2PO2+NaOH = Na2HPO3+H2↑
(1)已知 H3PO2是一元中强酸,则 NaH2PO2是__________________ (填“正盐”或“酸式盐”)。
(2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为________________ 过滤、洗涤和干燥。
(3)用NiC12、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为_______________________________________________ 。
(4)“反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比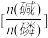 与NaH2PO2产率的关系如图所示。当
与NaH2PO2产率的关系如图所示。当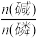 >2.6 时,NaH2PO2的产率随
>2.6 时,NaH2PO2的产率随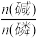 的增大而降低的可能原因
的增大而降低的可能原因_____________________________________________________________ 。

(5)滤渣2主要成分为_______________________ (填化学式)
(6)“过滤2”的滤液须用 Ag2SO4、Ba(OH)2及 Na2S溶液除去其中C1-及Fe2+ 等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是________________________________________________________________________________ 。
(7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式_____________________________ 。

已知P4与两种碱的反应主要有:
I.2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
II.4NaOH+P4+8H2O= 4NaH2PO2·H2O+2H2↑
III.4NaOH+P4+2H2O=2Na2HPO3+2PH3↑
IV.NaH2PO2+NaOH = Na2HPO3+H2↑
(1)已知 H3PO2是一元中强酸,则 NaH2PO2是
(2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为
(3)用NiC12、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为
(4)“反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比
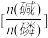 与NaH2PO2产率的关系如图所示。当
与NaH2PO2产率的关系如图所示。当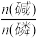 >2.6 时,NaH2PO2的产率随
>2.6 时,NaH2PO2的产率随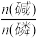 的增大而降低的可能原因
的增大而降低的可能原因
(5)滤渣2主要成分为
(6)“过滤2”的滤液须用 Ag2SO4、Ba(OH)2及 Na2S溶液除去其中C1-及Fe2+ 等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是
(7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】“翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
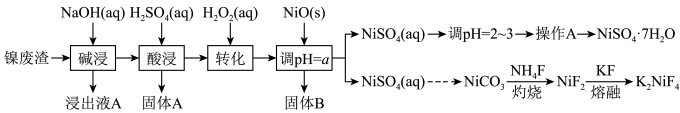
几种金属离子的氢氧化物沉淀pH如表:
请回答下列问题:
(1)“碱浸”过程中,为提高浸出率,可采取的措施是___________ (写一种即可)。
(2)“转化”过程中加入H2O2的目的是_________ (用离子方程式表示),经实验测定该过程温度高于40℃,转化率急速降低的原因可能是________ 。
(3)调节pH=a,其中a的取值范围是________ 。
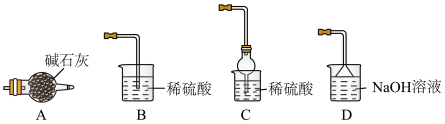
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:______ ,为避免污染环境,选择下列装置吸收尾气,最宜选择______ (填选项)。
(5)准确称取ωg翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250mL溶液,取25.00mL所配溶液于锥形瓶中,用cmol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02mL、19.98mL、19.50mL,则翠矾的纯度为______ %(只列计算式,不考虑杂质反应)。

几种金属离子的氢氧化物沉淀pH如表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 5.2 |
Fe2+ | 7.6 | 9.7 |
Ni2+ | 7.1 | 9.2 |
(1)“碱浸”过程中,为提高浸出率,可采取的措施是
(2)“转化”过程中加入H2O2的目的是
(3)调节pH=a,其中a的取值范围是
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:

(5)准确称取ωg翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250mL溶液,取25.00mL所配溶液于锥形瓶中,用cmol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02mL、19.98mL、19.50mL,则翠矾的纯度为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】CoCl2是一种性能优越的电池前驱材料,可用于电镀。含钴矿中Co元素主要以Co2O3、CoO形式存在,还含有Fe3O4、SiO2、CuO、ZnO、NiO、MgCO3等杂质,制取氯化钴晶体的一种工艺流程如下:

滤液3经过多次萃取与反萃取制备CoCl2晶体。
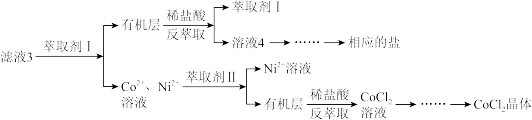
已知:
①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
请回答:
(1)实验室中进行操作①时所需的玻璃仪器有___________ 。滤渣1的主要成分是___________ 。
(2)取时加入Na2S2O5发生的氧化还原反应的离子方程式为___________ 。
(3)滤液1中加入NaClO3的作用为___________ 。加入Na2CO3溶液发生反应的离子方程式为___________ 。
(4)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是___________ 。
(5)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是___________ 。
(6)某学习小组同学为测定产品中CoCl2·6H2O晶体的纯度,将一定量的样品溶于水,再向其中加入足量AgNO3溶液,过滤洗涤,并将沉淀烘干后称量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是___________ 。(写一条即可)。

滤液3经过多次萃取与反萃取制备CoCl2晶体。

已知:
①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mg2+ | |
| 开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 9.6 |
| 完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 11.1 |
(1)实验室中进行操作①时所需的玻璃仪器有
(2)取时加入Na2S2O5发生的氧化还原反应的离子方程式为
(3)滤液1中加入NaClO3的作用为
(4)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是
(5)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是
(6)某学习小组同学为测定产品中CoCl2·6H2O晶体的纯度,将一定量的样品溶于水,再向其中加入足量AgNO3溶液,过滤洗涤,并将沉淀烘干后称量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近半年使用:0次



