1 . 甲烷水蒸气催化重整是制备高纯氢的方法之一。
甲烷水蒸气催化重整发生如下反应:
反应i.
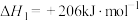
反应ⅱ.

(1)已知反应ⅱ中相关的化学键键能数据如下:
由此计算
______  。
。
(2)为了提高反应中甲烷的平衡转化率,理论上可采取的措施是______。
(3)把甲烷和水蒸气按物质的量之比1∶3通入反应器中,其他条件不变,在不同温度下探究CaO对平衡时干燥出口气中 物质的量分数的影响,结果如下:
物质的量分数的影响,结果如下:______ K(700℃)(填“大于”、“等于”或“小于”)。
②在400~600℃范围内,反应器中有CaO能大幅提高 物质的量分数,原因是
物质的量分数,原因是______ (用化学方程式表示)。
(4)某温度下,在体积为1L的容器中加入1mol 、3mol水蒸气进行催化重整反应,达到平衡时
、3mol水蒸气进行催化重整反应,达到平衡时 的总转化率为80%,CO的浓度为
的总转化率为80%,CO的浓度为 。
。 的平衡浓度为
的平衡浓度为______  ,反应i的平衡常数为
,反应i的平衡常数为______  (保留一位小数)。
(保留一位小数)。
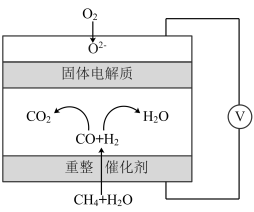
(5)一种高性能甲烷燃料电池的工作原理如图所示。理论上当正极消耗气体的体积为44.8L(标准状况)时,电路中转移的电子数为______  。
。
甲烷水蒸气催化重整发生如下反应:
反应i.

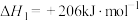
反应ⅱ.


(1)已知反应ⅱ中相关的化学键键能数据如下:
化学键 | H―H | H―O | C―H | C=O |
E/( | 436 | 465 | 413 | 745 |

 。
。(2)为了提高反应中甲烷的平衡转化率,理论上可采取的措施是______。
| A.恒容时通入氮气 | B.升高温度 | C.及时分离氢气 | D.选择合适的催化剂 |
(3)把甲烷和水蒸气按物质的量之比1∶3通入反应器中,其他条件不变,在不同温度下探究CaO对平衡时干燥出口气中
 物质的量分数的影响,结果如下:
物质的量分数的影响,结果如下: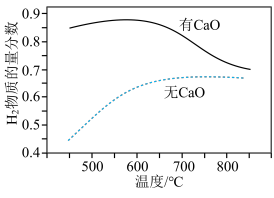
②在400~600℃范围内,反应器中有CaO能大幅提高
 物质的量分数,原因是
物质的量分数,原因是(4)某温度下,在体积为1L的容器中加入1mol
 、3mol水蒸气进行催化重整反应,达到平衡时
、3mol水蒸气进行催化重整反应,达到平衡时 的总转化率为80%,CO的浓度为
的总转化率为80%,CO的浓度为 。
。 的平衡浓度为
的平衡浓度为 ,反应i的平衡常数为
,反应i的平衡常数为 (保留一位小数)。
(保留一位小数)。(5)一种高性能甲烷燃料电池的工作原理如图所示。理论上当正极消耗气体的体积为44.8L(标准状况)时,电路中转移的电子数为
 。
。
您最近半年使用:0次
2 . 烯丙醇是生产甘油、医药、农药、香料和化妆品的中间体。已知烯丙醇与水在一定条件下发生加成反应的原理如下:
Ⅰ:CH2=CHCH2OH(g)+H2O(g) HOCH2CH2CH2OH(g) △H1 △S1
HOCH2CH2CH2OH(g) △H1 △S1
Ⅱ:CH2=CHCH2OH(g)+H2O(g) CH3CH(OH)CH2OH(g) △H2
CH3CH(OH)CH2OH(g) △H2
已知:相关物质在298K时的标准摩尔生成焓(101kPa时,该温度下由最稳定单质生成1 mol某纯物质的焓变)如下表所示:
(1)△H2=_______ kJ/mol;反应CH2=CHCH2OH(g)+H2O(g) HOCH2CH2CH2OH(l)的熵变为△S1',则△S1
HOCH2CH2CH2OH(l)的熵变为△S1',则△S1_______ △S1' (填“>”“=”或“<”)。
(2)若向绝热恒容容器中加入CH2=CHCH2OH(g)和H2O(g),发生反应Ⅰ和Ⅱ,下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
(3)已知:反应的压强平衡常数(K)满足方程Kp=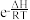 +C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为
+C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为_______ 和_______ 。
①该温度下,反应Ⅱ的压强平衡常数K=_______ 。
②若其他条件不变,初始时不充入He(g),而是按1:1的体积比充入CH2=CHCH2OH(g)和H2O(g),达到新平衡时,H2O(g)的转化率将_______ (填“增大”“减小”或“不变”),解释其原因为_______ 。
(5)烯丙醇的电氧化过程有重要应用。其在阳极放电时,同时存在三种电极反应(烯丙醇→丙烯酸、烯丙醇→丙烯醛、烯丙醇→丙二酸),各反应决速步骤的活化能如下表所示。
①该条件下,相同时间内,阳极产物中含量最多的为_______ 。
②碱性条件下,烯丙醇在电极上生成丙烯醛(CH2=CHCHO)的电极反应式为_______ 。
Ⅰ:CH2=CHCH2OH(g)+H2O(g)
 HOCH2CH2CH2OH(g) △H1 △S1
HOCH2CH2CH2OH(g) △H1 △S1Ⅱ:CH2=CHCH2OH(g)+H2O(g)
 CH3CH(OH)CH2OH(g) △H2
CH3CH(OH)CH2OH(g) △H2 已知:相关物质在298K时的标准摩尔生成焓(101kPa时,该温度下由最稳定单质生成1 mol某纯物质的焓变)如下表所示:
| 物质 | CH2=CHCH2OH(g) | H2O(g) | HOCH2CH2CH2OH(g) | CH3CH(OH)CH2OH(g) |
| 标准摩尔生成焓/(kJ/mol) | -171.8 | -241.8 | -464.9 | -485.7 |
(1)△H2=
 HOCH2CH2CH2OH(l)的熵变为△S1',则△S1
HOCH2CH2CH2OH(l)的熵变为△S1',则△S1(2)若向绝热恒容容器中加入CH2=CHCH2OH(g)和H2O(g),发生反应Ⅰ和Ⅱ,下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
| A.容器内气体的压强不变 | B.容器内温度不变 |
| C.容器内气体的密度不变 | D.容器内气体的平均相对分子质量不变 |
(3)已知:反应的压强平衡常数(K)满足方程Kp=
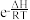 +C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为
+C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为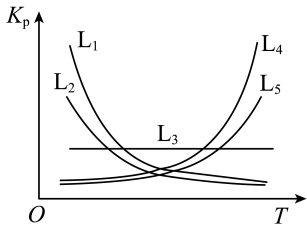
①该温度下,反应Ⅱ的压强平衡常数K=
②若其他条件不变,初始时不充入He(g),而是按1:1的体积比充入CH2=CHCH2OH(g)和H2O(g),达到新平衡时,H2O(g)的转化率将
(5)烯丙醇的电氧化过程有重要应用。其在阳极放电时,同时存在三种电极反应(烯丙醇→丙烯酸、烯丙醇→丙烯醛、烯丙醇→丙二酸),各反应决速步骤的活化能如下表所示。
| 反应 | 烯丙醇→丙烯酸 | 烯丙醇→丙烯醛 | 烯丙醇→丙二酸 |
| 活化能(单位:eV) | 8.6a | 2.5 a | 13.7a |
②碱性条件下,烯丙醇在电极上生成丙烯醛(CH2=CHCHO)的电极反应式为
您最近半年使用:0次
名校
解题方法
3 . NH3是一种重要的化工原料。
(1)液氨是重要的非水溶剂。和水类似,液氨的电离平衡为 。
。
①写出(NH4)2SO4与KNH2在液氨中恰好完全中和时的化学方程式:__________ 。
②以KNH2的液氨溶液为电解液,通过电解可得高纯氢气(原理如图所示)。阴极反应式为___________ 。理论上生成1molN2的同时,电解液减少的质量为____________ g。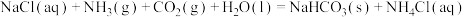 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是___________ 。
(3)现有两个容积相等的恒容容器实验室合成氨气:
a.向恒温(320℃)的容器1中通入一定量的H2和N2,NH3的产率随时间变化关系如图所示。 时刻达到平衡。此后保持体系恒温(320℃),在
时刻达到平衡。此后保持体系恒温(320℃),在 时刻重新达到平衡。
时刻重新达到平衡。
请在图中补充画出容器2从投料后到 时刻的NH3的产率随时间变化关系曲线
时刻的NH3的产率随时间变化关系曲线___________ 。
(4)NH3热分解也可制得H2: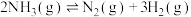
 ,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。
,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②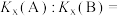
____________ [对于反应 ,
,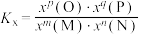 ,x为物质的量分数]。
,x为物质的量分数]。
③NH3热分解反应速率方程为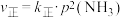 ,式中
,式中 为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为
为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为__________ (填字母)。
a.逐渐减小直至不变 b.逐渐增大直至不变
c.先减小,后逐渐增大直至不变 d.先增大,后逐渐减小直至不变
(1)液氨是重要的非水溶剂。和水类似,液氨的电离平衡为
 。
。①写出(NH4)2SO4与KNH2在液氨中恰好完全中和时的化学方程式:
②以KNH2的液氨溶液为电解液,通过电解可得高纯氢气(原理如图所示)。阴极反应式为
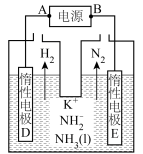
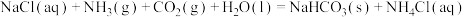 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是(3)现有两个容积相等的恒容容器实验室合成氨气:
a.向恒温(320℃)的容器1中通入一定量的H2和N2,NH3的产率随时间变化关系如图所示。
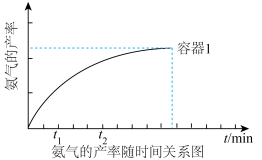
 时刻达到平衡。此后保持体系恒温(320℃),在
时刻达到平衡。此后保持体系恒温(320℃),在 时刻重新达到平衡。
时刻重新达到平衡。请在图中补充画出容器2从投料后到
 时刻的NH3的产率随时间变化关系曲线
时刻的NH3的产率随时间变化关系曲线(4)NH3热分解也可制得H2:
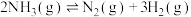
 ,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。
,将一定量NH3(g)置于恒压密闭容器中,不同温度(T)下平衡混合物中N2物质的量分数随压强的变化曲线如图所示。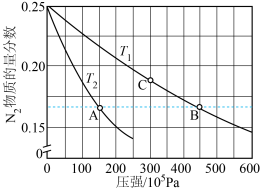

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
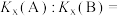
 ,
,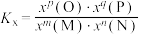 ,x为物质的量分数]。
,x为物质的量分数]。③NH3热分解反应速率方程为
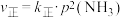 ,式中
,式中 为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为
为正反应的速率常数(只与温度有关)。将C点增大压强后,平衡发生移动,直至达到新的平衡,正反应速率的变化情况为a.逐渐减小直至不变 b.逐渐增大直至不变
c.先减小,后逐渐增大直至不变 d.先增大,后逐渐减小直至不变
您最近半年使用:0次
2024-04-13更新
|
270次组卷
|
2卷引用:2024届河北省部分示范性高中2023-2024学年高三下学期一模化学试题
4 . 合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)如图所示为利用 和空气中的
和空气中的 以
以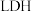 超薄纳米为催化剂在光催化作用下合成氨的原理。
超薄纳米为催化剂在光催化作用下合成氨的原理。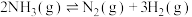

Ⅱ.
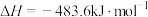
则上述合成氨的热化学方程式为___________ 。
(2)合成尿素 的反应为
的反应为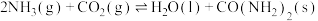
 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示。
的转化率随时间的变化情况如图所示。 的浓度变化表示反应速率,则
的浓度变化表示反应速率,则 点的逆反应速率
点的逆反应速率___________ B点的正反应速率(填“>”“<”或“=”)。
②下列叙述中不能说明该反应达到平衡状态的是___________ (填序号)。
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C. 的消耗速率和
的消耗速率和 的消耗速率之比为
的消耗速率之比为
D.固体质量不再发生变化
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量 。实验发现,
。实验发现, 易发生二聚反应
易发生二聚反应 并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为
并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为 和
和 时NO的转化率随时间变化的结果如图所示。
时NO的转化率随时间变化的结果如图所示。 时,达到平衡时体系的总压强为
时,达到平衡时体系的总压强为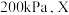 点
点 的物质的量分数为
的物质的量分数为___________ (保留三位有效数字), 点对应的平衡常数
点对应的平衡常数
___________  (用分压表示,保留小数点后三位);提高NO平衡转化率的条件为
(用分压表示,保留小数点后三位);提高NO平衡转化率的条件为___________ (任写两点)。
②如图所示,利用电解原理,可将废气中的 转化为
转化为 ,阳极的电极反应式为
,阳极的电极反应式为___________ ,通入 的目的是
的目的是___________ 。
(1)如图所示为利用
 和空气中的
和空气中的 以
以 超薄纳米为催化剂在光催化作用下合成氨的原理。
超薄纳米为催化剂在光催化作用下合成氨的原理。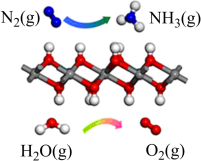
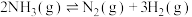

Ⅱ.

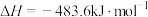
则上述合成氨的热化学方程式为
(2)合成尿素
 的反应为
的反应为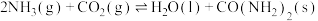
 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示。
的转化率随时间的变化情况如图所示。
 的浓度变化表示反应速率,则
的浓度变化表示反应速率,则 点的逆反应速率
点的逆反应速率②下列叙述中不能说明该反应达到平衡状态的是
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C.
 的消耗速率和
的消耗速率和 的消耗速率之比为
的消耗速率之比为
D.固体质量不再发生变化
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量
 。实验发现,
。实验发现, 易发生二聚反应
易发生二聚反应 并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为
并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为 和
和 时NO的转化率随时间变化的结果如图所示。
时NO的转化率随时间变化的结果如图所示。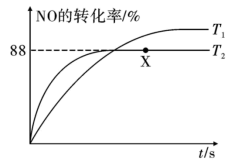
 时,达到平衡时体系的总压强为
时,达到平衡时体系的总压强为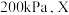 点
点 的物质的量分数为
的物质的量分数为 点对应的平衡常数
点对应的平衡常数
 (用分压表示,保留小数点后三位);提高NO平衡转化率的条件为
(用分压表示,保留小数点后三位);提高NO平衡转化率的条件为②如图所示,利用电解原理,可将废气中的
 转化为
转化为 ,阳极的电极反应式为
,阳极的电极反应式为 的目的是
的目的是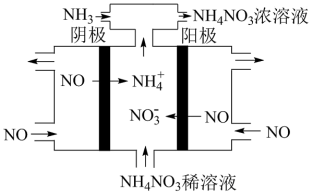
您最近半年使用:0次
解题方法
5 . 利用工业废气中的二氧化碳合成甲醇有利于减少二氧化碳的排放,又可为甲醇的合成提供一条绿色的合成路线,意义重大。
Ⅰ.在某恒容密闭容器中充入 和
和 发生反应合成甲醇:
发生反应合成甲醇: ,不同催化剂作用下,相同时间内
,不同催化剂作用下,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示: 时,为了提高生产效率,应选用的催化剂是
时,为了提高生产效率,应选用的催化剂是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2) 点的正反应速率
点的正反应速率_______ (填“>”“<”或“=”,下同)逆反应速率; 两点对应容器内压强:
两点对应容器内压强:
_______  。
。
(3)下列叙述能说明该反应达到平衡状态的是_______(填标号)。
(4)若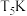 下,反应达到平衡时,容器内压强为
下,反应达到平衡时,容器内压强为 ,则该温度下的平衡常数
,则该温度下的平衡常数
_______  。(用平衡分压代替平衡浓度计算,物质的分压
。(用平衡分压代替平衡浓度计算,物质的分压 总压
总压 物质的量分数)
物质的量分数)
Ⅱ.制备的甲醇可用于燃料电池,甲醇一空气燃料电池电解 溶液的装置如图所示,闭合开关
溶液的装置如图所示,闭合开关 时,电极
时,电极 增重了
增重了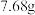 。
。 为
为_______ 极,物质 为
为_______ (写化学式)。
(6) 时,甲池中消耗的
时,甲池中消耗的 的物质的量为
的物质的量为_______ mol。
Ⅰ.在某恒容密闭容器中充入
 和
和 发生反应合成甲醇:
发生反应合成甲醇: ,不同催化剂作用下,相同时间内
,不同催化剂作用下,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示: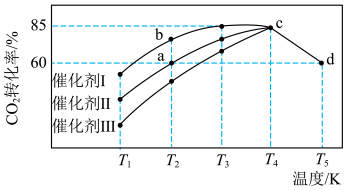
 时,为了提高生产效率,应选用的催化剂是
时,为了提高生产效率,应选用的催化剂是(2)
 点的正反应速率
点的正反应速率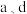 两点对应容器内压强:
两点对应容器内压强: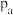
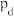 。
。(3)下列叙述能说明该反应达到平衡状态的是_______(填标号)。
A. |
| B.容器内压强不再发生改变 |
C. 的体积分数不再发生改变 的体积分数不再发生改变 |
D.每断裂 键的同时断裂 键的同时断裂 键 键 |
(4)若
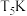 下,反应达到平衡时,容器内压强为
下,反应达到平衡时,容器内压强为 ,则该温度下的平衡常数
,则该温度下的平衡常数
 。(用平衡分压代替平衡浓度计算,物质的分压
。(用平衡分压代替平衡浓度计算,物质的分压 总压
总压 物质的量分数)
物质的量分数) Ⅱ.制备的甲醇可用于燃料电池,甲醇一空气燃料电池电解
 溶液的装置如图所示,闭合开关
溶液的装置如图所示,闭合开关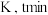 时,电极
时,电极 增重了
增重了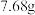 。
。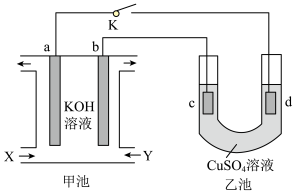
 为
为 为
为(6)
 时,甲池中消耗的
时,甲池中消耗的 的物质的量为
的物质的量为
您最近半年使用:0次
6 .  资源化利用和转化已成为当今科学研究的热点。将
资源化利用和转化已成为当今科学研究的热点。将 转化为甲醇燃料是减排、环保的一种科学方法,其原理为:
转化为甲醇燃料是减排、环保的一种科学方法,其原理为:
(1) 时,在体积为
时,在体积为 的固定容积密闭容器中充入
的固定容积密闭容器中充入 、
、 ,测得
,测得 浓度与甲醇浓度随时间变化如图所示。
浓度与甲醇浓度随时间变化如图所示。 浓度变化的是
浓度变化的是___________ 。
②从反应开始至10min达到平衡, 的反应速率
的反应速率
___________  ;
;
③平衡时 的转化率为
的转化率为___________ ;
④该反应的平衡常数
___________ 。
(2)制甲醇的总反应可表示为: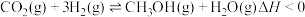 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:
Ⅰ.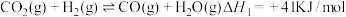
Ⅱ.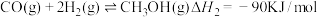
①总反应的
___________ 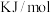 ;
;
___________ 0(填“大于”或“小于”);
②反应Ⅰ与反应Ⅱ比较,Ⅰ为慢反应,请在体系能量与反应进程的示意图中画出Ⅰ、Ⅱ反应的能量变化;___________  和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示,阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示,阴极上的反应式为___________ 。
 资源化利用和转化已成为当今科学研究的热点。将
资源化利用和转化已成为当今科学研究的热点。将 转化为甲醇燃料是减排、环保的一种科学方法,其原理为:
转化为甲醇燃料是减排、环保的一种科学方法,其原理为:
(1)
 时,在体积为
时,在体积为 的固定容积密闭容器中充入
的固定容积密闭容器中充入 、
、 ,测得
,测得 浓度与甲醇浓度随时间变化如图所示。
浓度与甲醇浓度随时间变化如图所示。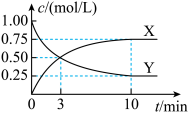
 浓度变化的是
浓度变化的是②从反应开始至10min达到平衡,
 的反应速率
的反应速率
 ;
;③平衡时
 的转化率为
的转化率为④该反应的平衡常数

(2)制甲醇的总反应可表示为:
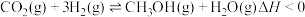 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:Ⅰ.
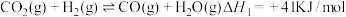
Ⅱ.
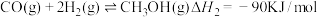
①总反应的

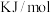 ;
;
②反应Ⅰ与反应Ⅱ比较,Ⅰ为慢反应,请在体系能量与反应进程的示意图中画出Ⅰ、Ⅱ反应的能量变化;

 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示,阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示,阴极上的反应式为
您最近半年使用:0次
7 . 工业上先将金红石 (TiO2)转化为 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
(1)已知在一定条件下如下反应的热化学方程式及平衡常数:
i.
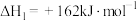

ii.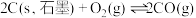
 K2
K2
iii.
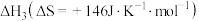

①
___________ 。
②反应iii自发进行的条件为___________ (填“低温”“高温”或“任意温度”)。
___________ (用含 的代数式表示)。
的代数式表示)。
(2)在 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应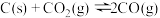 的平衡常数的值
的平衡常数的值
___________ (用含n、V的代数式表示)。
(3)用如图所示装置电解 可制硼氢化钠(
可制硼氢化钠( ,强还原性,硼为
,强还原性,硼为 价),为了防止NaBH4被氧化,则交换膜的种类为
价),为了防止NaBH4被氧化,则交换膜的种类为___________ 交换膜(填“阳离子”或者“阴离子”),写出阴极室的电极反应式:___________ 。
 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。(1)已知在一定条件下如下反应的热化学方程式及平衡常数:
i.

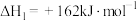

ii.
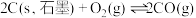
 K2
K2iii.

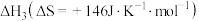

①

②反应iii自发进行的条件为

 的代数式表示)。
的代数式表示)。(2)在
 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。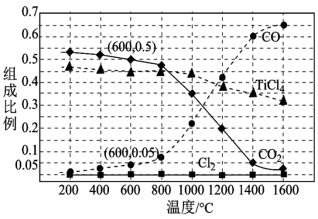
 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应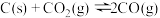 的平衡常数的值
的平衡常数的值
(3)用如图所示装置电解
 可制硼氢化钠(
可制硼氢化钠( ,强还原性,硼为
,强还原性,硼为 价),为了防止NaBH4被氧化,则交换膜的种类为
价),为了防止NaBH4被氧化,则交换膜的种类为
您最近半年使用:0次
2024-04-11更新
|
41次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高二下学期第一次月考化学试题
8 . 碳中和的目标是减少含碳气体的排放。CH4与CO2都能引起温室效应,将二者联合处理不仅可以减缓温室气体排放,还可以转化为CH3OH、CH3COOH、H2等高附加值产品。
(1)CH4与CO2在一定条件下能发生如下两个反应:
Ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247kJ/mol
2CO(g)+2H2(g) ΔH1=+247kJ/mol
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol
若CH4与CO2按物质的量之比1∶3投料在某恒容密闭容器中发生上述反应,一定时间内CH4与CO2的转化率随温度的变化如图所示,其中CO2在1000℃时的平衡转化率为60%,CH4在1000℃时的平衡转化率几乎为100%。_______ 下能自发进行(填“高温”或“低温”)。
②温度高于700℃ 时,随温度升高,平衡产物中H2O的体积分数_______ (填“增大”“减小”或“不变”)。
③1000℃时反应Ⅱ 的平衡常数K=_______ (保留3位有效数字,下同),平衡时CO的体积分数为_______ 。
(2)CH4与CO2在催化剂作用下反应可生成CH3COOH,其反应机理如图所示。_______ 。
②转化过程中经历了i→ii的变化,该变化过程_______ (填“吸热”或“放热”)。产物CH3COOH中碳原子的杂化方式为_______ 。
③甲醇(CH3OH)与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,KOH溶液为电解质溶液,该电池放电时,负极反应式为_______ 。
(1)CH4与CO2在一定条件下能发生如下两个反应:
Ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247kJ/mol
2CO(g)+2H2(g) ΔH1=+247kJ/molⅡ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol若CH4与CO2按物质的量之比1∶3投料在某恒容密闭容器中发生上述反应,一定时间内CH4与CO2的转化率随温度的变化如图所示,其中CO2在1000℃时的平衡转化率为60%,CH4在1000℃时的平衡转化率几乎为100%。
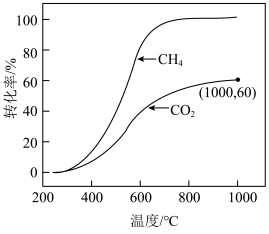
②温度高于700℃ 时,随温度升高,平衡产物中H2O的体积分数
③1000℃时反应Ⅱ 的平衡常数K=
(2)CH4与CO2在催化剂作用下反应可生成CH3COOH,其反应机理如图所示。
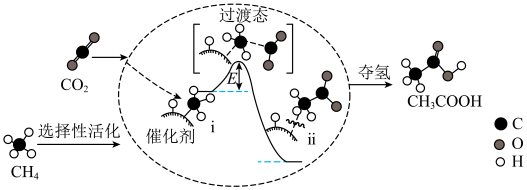
②转化过程中经历了i→ii的变化,该变化过程
③甲醇(CH3OH)与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,KOH溶液为电解质溶液,该电池放电时,负极反应式为
您最近半年使用:0次
9 . 氮及其化合物在生产生活中有广泛的应用,按要求回答下列问题:
(1)工业合成氨的反应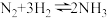 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂 相应化学键需要的能量如下。若反应生成
相应化学键需要的能量如下。若反应生成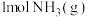 ,可
,可_____ (填“吸收”或“放出”)热量_____  。
。
(2)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应。若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为_____ mol/(L·min),5min时反应过程体系总压强与初始时的总压强之比为_____
(3)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,在恒容密闭容中充入4molCO和4molNO发生2CO(g)+2NO(g)⇌N2(g)+2CO2(g)反应。为提高此反应的速率,下列措施可行的是_____(填字母)。
(4)汽车尾气中含有的 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 含量,其工作原理如图所示:
含量,其工作原理如图所示:
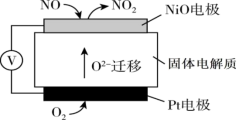
 电极为
电极为_____ (填“正极”或“负极”), 电极上发生的电极反应式为
电极上发生的电极反应式为_____ 。
(1)工业合成氨的反应
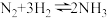 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂 相应化学键需要的能量如下。若反应生成
相应化学键需要的能量如下。若反应生成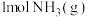 ,可
,可 。
。| 化学键 |  |  |  |
| 能量 | 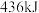 | 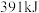 |  |
(2)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应。若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为
(3)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,在恒容密闭容中充入4molCO和4molNO发生2CO(g)+2NO(g)⇌N2(g)+2CO2(g)反应。为提高此反应的速率,下列措施可行的是_____(填字母)。
| A.充入氦气 | B.降低温度 | C.使用适合催化剂 | D.移出CO2 |
(4)汽车尾气中含有的
 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 含量,其工作原理如图所示:
含量,其工作原理如图所示:
 电极为
电极为 电极上发生的电极反应式为
电极上发生的电极反应式为
您最近半年使用:0次
解题方法
10 . 与氮气相关的化学变化是氮循环和转化的重要一环,对生产、生活有重要的价值。
(1)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:
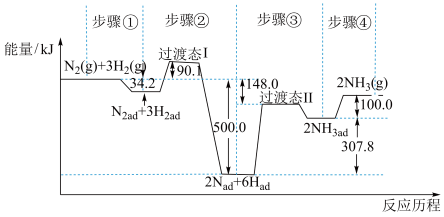
①由图可知合成氨反应 的
的 =
=___________  对总反应速率影响较大的是步骤
对总反应速率影响较大的是步骤___________ 。(填写编号)
②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(2)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用 的燃烧反应(
的燃烧反应(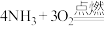
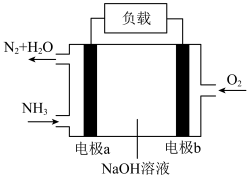
 )能设计成燃料电池其工作原理如图所示。电极b为
)能设计成燃料电池其工作原理如图所示。电极b为___________ (选填“正”或“负”)极;电极a的电极反应式为___________ ,当正负极共消耗3.136L(标准状况)气体时,通过负载的电子数为___________ 个。
(3)合成氨厂的 可用于合成重要化工原料
可用于合成重要化工原料 ,主要反应为:
,主要反应为: 。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的
。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的 和
和 气体,
气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。

①若 时,向容器中充入
时,向容器中充入 mol气体(3mol
mol气体(3mol  和1mol
和1mol  ),反应至5min时达到平衡,则0~5min内
),反应至5min时达到平衡,则0~5min内 的平均反应速率
的平均反应速率
___________ 。
②由上图可判断该反应是___________ (选填“吸热”或“放热”)反应,在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
(1)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:

①由图可知合成氨反应
 的
的 =
= 对总反应速率影响较大的是步骤
对总反应速率影响较大的是步骤②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(2)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用
 的燃烧反应(
的燃烧反应(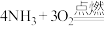
 )能设计成燃料电池其工作原理如图所示。电极b为
)能设计成燃料电池其工作原理如图所示。电极b为
(3)合成氨厂的
 可用于合成重要化工原料
可用于合成重要化工原料 ,主要反应为:
,主要反应为: 。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的
。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的 和
和 气体,
气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
①若
 时,向容器中充入
时,向容器中充入 mol气体(3mol
mol气体(3mol  和1mol
和1mol  ),反应至5min时达到平衡,则0~5min内
),反应至5min时达到平衡,则0~5min内 的平均反应速率
的平均反应速率
②由上图可判断该反应是
您最近半年使用:0次



