1 . 锗是一种战略性金属,广泛应用于光学及电子工业领域。一种用锌浸渣(主要含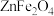 、
、 ,另含少量ZnS、
,另含少量ZnS、 以及
以及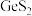 )提取Ge和
)提取Ge和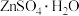 的工艺流程如下:
的工艺流程如下: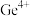 ,
, 时主要为
时主要为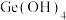 。
。
②常温下, ,
, 。
。
请回答下列问题:
(1)Ge是第四周期第ⅣA族元素,其基态原子的价层电子排布式为___________ 。
(2)“氧化酸浸”工序中,溶液 ,浸渣的主要成分为
,浸渣的主要成分为 、S和
、S和___________ (填化学式);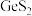 被双氧水氧化的离子方程式为
被双氧水氧化的离子方程式为___________ 。
(3)“中和沉淀”工序中,所加化合物A为___________ (填一种物质的化学式);调节溶液 ,Ge和Fe共沉淀,此时滤液中
,Ge和Fe共沉淀,此时滤液中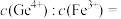
___________ 。
(4)①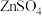 在水溶液中的溶解度曲线如图所示,则从滤液中回收
在水溶液中的溶解度曲线如图所示,则从滤液中回收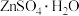 的操作为蒸发浓缩、
的操作为蒸发浓缩、___________ 、洗涤、干燥。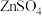 溶液可制取金属锌,电解后的溶液可在上述流程中
溶液可制取金属锌,电解后的溶液可在上述流程中___________ 工序循环使用。
(5)“水解”工序中, 水解生成
水解生成 的化学方程式为
的化学方程式为___________ ; 的沸点(1200℃)远高于
的沸点(1200℃)远高于 的沸点(84℃),其原因为
的沸点(84℃),其原因为___________ 。
(6)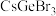 是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为
是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为___________ (填“体心”“面心”或“顶角”);晶体中一个Cs周围与其距离最近的Br的个数为___________ 。
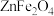 、
、 ,另含少量ZnS、
,另含少量ZnS、 以及
以及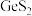 )提取Ge和
)提取Ge和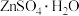 的工艺流程如下:
的工艺流程如下: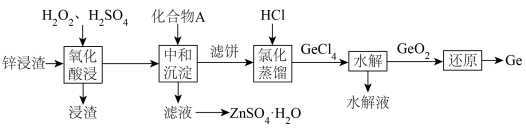
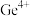 ,
, 时主要为
时主要为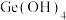 。
。②常温下,
 ,
, 。
。请回答下列问题:
(1)Ge是第四周期第ⅣA族元素,其基态原子的价层电子排布式为
(2)“氧化酸浸”工序中,溶液
 ,浸渣的主要成分为
,浸渣的主要成分为 、S和
、S和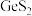 被双氧水氧化的离子方程式为
被双氧水氧化的离子方程式为(3)“中和沉淀”工序中,所加化合物A为
 ,Ge和Fe共沉淀,此时滤液中
,Ge和Fe共沉淀,此时滤液中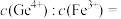
(4)①
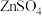 在水溶液中的溶解度曲线如图所示,则从滤液中回收
在水溶液中的溶解度曲线如图所示,则从滤液中回收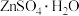 的操作为蒸发浓缩、
的操作为蒸发浓缩、
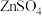 溶液可制取金属锌,电解后的溶液可在上述流程中
溶液可制取金属锌,电解后的溶液可在上述流程中(5)“水解”工序中,
 水解生成
水解生成 的化学方程式为
的化学方程式为 的沸点(1200℃)远高于
的沸点(1200℃)远高于 的沸点(84℃),其原因为
的沸点(84℃),其原因为(6)
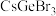 是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为
是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为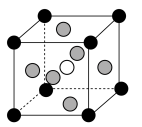
您最近一年使用:0次
2 . 氨是最基本的化工原料,常用于制液氮、氨水、硝酸、铵盐和胺类等。
(1)工业合成氨是人类科学技术的一项重大突破,其反应如下: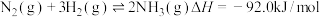
根据下列键能数据,结合上述反应数据,计算 的键能是
的键能是___________  。
。
(2)合成氨工业中,原料气(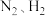 及少量
及少量 的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中
的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中 ,其反应为:
,其反应为: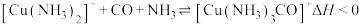 。
。
①配离子 的中心离子是
的中心离子是___________ ,配位数是___________ 。
②铜氨溶液吸收 适宜的生产条件:
适宜的生产条件:___________ 温、___________ 压。(填“高”“低”)
(3)恒温恒压条件下,向容器中通入 和
和 ,合成氨反应用摩尔分数表示的平衡常数
,合成氨反应用摩尔分数表示的平衡常数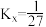 ,达到平衡时
,达到平衡时 的转化率为
的转化率为___________ (保留3位有效数字)。(已知反应的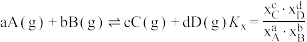 ,物质ⅰ的摩尔分数
,物质ⅰ的摩尔分数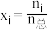 ,
,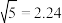 )。
)。
(4)制备 时所需的
时所需的 可以通过反应合成,但缺
可以通过反应合成,但缺 。有学者倡议:常温下,把石膏矿中
。有学者倡议:常温下,把石膏矿中 (Ⅱ)转化为难溶的
(Ⅱ)转化为难溶的 ,留下的
,留下的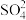 和
和 形成
形成 ,反应方程式如下:
,反应方程式如下:  ,化学平衡常数为
,化学平衡常数为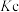 ,用下列相关
,用下列相关 的符号来表示
的符号来表示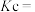
___________ 。通过计算反应的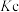 判断以上倡议
判断以上倡议___________ (填“可行”或“不可行”)。
(已知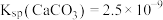 、
、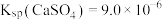 、
、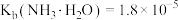 、
、 的
的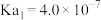 、
、 、
、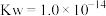 )
)
(5) 与镓
与镓 在高温下生成
在高温下生成 ,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被
,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被 原子代替,顶点和面心的碳原子被
原子代替,顶点和面心的碳原子被 原子代替。
原子代替。 原子坐标为
原子坐标为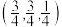 ,则
,则 原子坐标为
原子坐标为___________ 。
②若 为阿伏伽德罗常数的值,
为阿伏伽德罗常数的值, 晶胞中
晶胞中 原子与
原子与 原子之间最短的核间距离是
原子之间最短的核间距离是 ,则
,则 晶体的密度为
晶体的密度为___________  (只列计算式)。
(只列计算式)。
(1)工业合成氨是人类科学技术的一项重大突破,其反应如下:
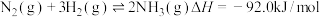
根据下列键能数据,结合上述反应数据,计算
 的键能是
的键能是 。
。| 化学键 |  |  |
键能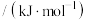 | 946 | 436 |
(2)合成氨工业中,原料气(
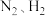 及少量
及少量 的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中
的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中 ,其反应为:
,其反应为: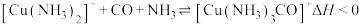 。
。①配离子
 的中心离子是
的中心离子是②铜氨溶液吸收
 适宜的生产条件:
适宜的生产条件:(3)恒温恒压条件下,向容器中通入
 和
和 ,合成氨反应用摩尔分数表示的平衡常数
,合成氨反应用摩尔分数表示的平衡常数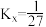 ,达到平衡时
,达到平衡时 的转化率为
的转化率为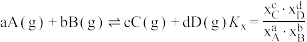 ,物质ⅰ的摩尔分数
,物质ⅰ的摩尔分数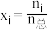 ,
,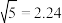 )。
)。(4)制备
 时所需的
时所需的 可以通过反应合成,但缺
可以通过反应合成,但缺 。有学者倡议:常温下,把石膏矿中
。有学者倡议:常温下,把石膏矿中 (Ⅱ)转化为难溶的
(Ⅱ)转化为难溶的 ,留下的
,留下的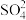 和
和 形成
形成 ,反应方程式如下:
,反应方程式如下:  ,化学平衡常数为
,化学平衡常数为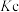 ,用下列相关
,用下列相关 的符号来表示
的符号来表示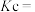
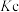 判断以上倡议
判断以上倡议(已知
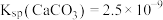 、
、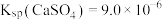 、
、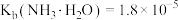 、
、 的
的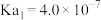 、
、 、
、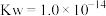 )
)(5)
 与镓
与镓 在高温下生成
在高温下生成 ,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被
,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被 原子代替,顶点和面心的碳原子被
原子代替,顶点和面心的碳原子被 原子代替。
原子代替。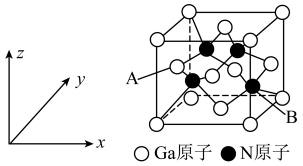
 原子坐标为
原子坐标为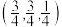 ,则
,则 原子坐标为
原子坐标为②若
 为阿伏伽德罗常数的值,
为阿伏伽德罗常数的值, 晶胞中
晶胞中 原子与
原子与 原子之间最短的核间距离是
原子之间最短的核间距离是 ,则
,则 晶体的密度为
晶体的密度为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
名校
解题方法
3 . 没有对物质结构的认识,同学们对化学的学习将是无源之水、无本之木,以下高中化学课程中关于物质结构的说法,正确的是
| A.金刚石的熔点低于金刚砂 |
B.Al和O的电负性差为2.0,因此 应该当做离子晶体来处理 应该当做离子晶体来处理 |
| C.由离子形成的物质在常温常压下可能不是固体 |
| D.液晶可表现各向异性,没有固定熔点,这是它不属于晶体的本质原因 |
您最近一年使用:0次
解题方法
4 . 镓( )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
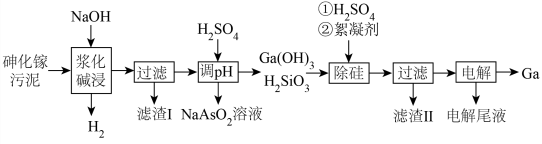
已知:Ⅰ.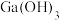 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;
Ⅱ.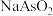 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。
回答下列问题:
(1)“浆化碱浸”过程中 反应的离子方程式为
反应的离子方程式为________ ;“滤渣Ⅰ”的成分为______ (填化学式)。
(2)中和“调 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是_______ 。
(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的 调节至
调节至______ 范围内,沉淀效果最好;此过程中,加入絮凝剂的目的是_______ 。
(4)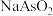 溶液经
溶液经_________ 、______ 、抽滤、洗涤、干燥得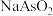 晶体。
晶体。
(5)用惰性电极电解得到电解尾液和 ,电解尾液可在
,电解尾液可在______ (填操作单元名称)过程中循环使用,提高经济效益。
(6) 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
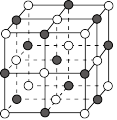
①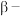 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为_____ 。
②距离最近的两个 原子之间的距离为
原子之间的距离为_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.
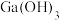 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;Ⅱ.
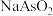 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。回答下列问题:
(1)“浆化碱浸”过程中
 反应的离子方程式为
反应的离子方程式为(2)中和“调
 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的
 调节至
调节至 |  |  |
| 0.0 | 2500 | 1345 |
| 0.5 | 2456 | 1267 |
| 1.0 | 2438 | 81 |
| 1.5 | 2420 | 103 |
| 2.0 | 2200 | 804 |
| 2.5 | 1879 | 952 |
(4)
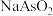 溶液经
溶液经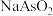 晶体。
晶体。(5)用惰性电极电解得到电解尾液和
 ,电解尾液可在
,电解尾液可在(6)
 可生成
可生成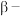 氮化镓等半导体材料,
氮化镓等半导体材料,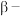 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
①
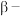 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为②距离最近的两个
 原子之间的距离为
原子之间的距离为 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
5 . 我国将镓列为战略储备金属,我国的镓储量占世界储量的80%以上。请回答:
(1)基态镓原子最外层的电子排布图为________ ,最高能级的电子云形状为_________ 。
(2)镓可与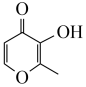 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga(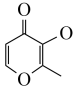 )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是___________ (填名称);每个甲基麦芽酚分子中含有___________ 个σ键。
(3)镓的卤化物熔点如表所示:
①氯化镓中镓的杂化方式与下列微粒的中心原子的杂化方式相同且氯化镓的空间结构也与其微粒相同的是___________ (填序号)。
A. B.
B. C.
C.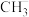 D.
D.
②各物质的熔点从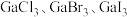 到
到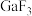 依次升高,原因是
依次升高,原因是___________ 。
(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以___________ 键结合。
(1)基态镓原子最外层的电子排布图为
(2)镓可与
 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是(3)镓的卤化物熔点如表所示:
| 物质 | 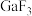 |  | 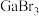 |  |
| 熔点/℃ | 1000 | 78 | 124 | 213 |
A.
 B.
B. C.
C.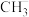 D.
D.
②各物质的熔点从
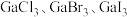 到
到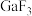 依次升高,原因是
依次升高,原因是(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
解题方法
6 . 华为Mate 60 Pro手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国的芯片技术的飞速发展。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
(1)硅元素的相对原子量为___________ (保留两位小数),12 g SiO2中29Si的质量为___________ (保留两位小数)。
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由___________ 。
(3)下列能说明碳的非金属大于硅的是___________。
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为___________ 。
(5)下列关于石墨烯的说法错误的是___________。
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼( )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。
已知:水合肼是一种二元弱碱,其电离常数为: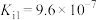 ,
, 。
。
(6)溶液A中含量最高的阳离子的化学式为___________ ,写出水合肼与溶液A反应的离子方程式___________ 。
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点___________ 。
(8)写出水合肼一级电离的方程式___________ 。
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度: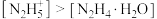 ,需调节的pH范围为
,需调节的pH范围为___________ 。
Ⅰ.硅在自然界中有三种稳定的核素,相关信息如下:
| 核素符号 | 相对原子量 | 丰度(%) |
| 28Si | 27.977 | 92.23 |
| 29Si | 28.976 | 4.67 |
| 30Si | 29.974 | 3.10 |
(2)硅与碳化硅(SiC)均可以作为芯片的材料,比较硅与碳化硅的熔点高低,并说明理由
(3)下列能说明碳的非金属大于硅的是___________。
| A.甲烷的分解温度高于SiH4 | B.碳与SiO2高温下置换出硅 |
| C.二氧化碳通入硅酸钠溶液得到白色沉淀 | D.CH4中氢为+1价,SiH4中氢为-1价 |
Ⅱ.华为Mate 60 Pro手机利用石墨烯薄片液冷散热系统,是全球最强散热手机系统。石墨烯可以看成单层的石墨,它的结构如下:

(4)在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为
(5)下列关于石墨烯的说法错误的是___________。
| A.石墨烯是一种多烯烃 |
| B.石墨烯中碳原子与苯环中碳原子杂化类型相同 |
| C.石墨烯与金刚石互为同分异构体 |
| D.石墨烯只存在非极性键 |
Ⅲ.废弃的手机主板中可以提取出Au、Ag等贵金属。主板中的Ag用硝酸溶解后,过滤得到AgNO3溶液,加入NaCl溶液,过滤,向得到固体的加入氨水,得到无色溶液A,A用水合肼(
 )还原得到银单质,同时生成一种空气中常见的单质。
)还原得到银单质,同时生成一种空气中常见的单质。已知:水合肼是一种二元弱碱,其电离常数为:
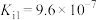 ,
, 。
。(6)溶液A中含量最高的阳离子的化学式为
(7)水合肼在工业上常用作还原剂,广泛用于纳米材料的制备,指出无机制备时水合肼作为还原剂的两个优点
(8)写出水合肼一级电离的方程式
(9)常温下,向水合肼溶液中加入盐酸,使溶液中的含氮微粒浓度:
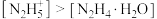 ,需调节的pH范围为
,需调节的pH范围为
您最近一年使用:0次
7 . 氮的化合物丰富多彩,请回答:
(1)HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式_______ , 解释沸点高的原因_______ 。
(2)杂环化合物咪唑结构如图,已知分子中的大π键可用符号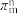 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),眯唑分子中的大π键可表示为
),眯唑分子中的大π键可表示为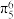 ,则咪唑分子中②号氮的杂化方式为
,则咪唑分子中②号氮的杂化方式为_______ , 结合质子能力更强的氮原子是_______ (填“①”或“②”)。
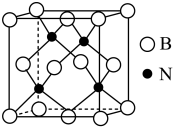
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示,立方氮化硼属于_______ 晶体, 其中硼原子的配位数为_______ 。
(4)SiCl4、NCl3均可发生水解反应,SiCl4水解机理如图:
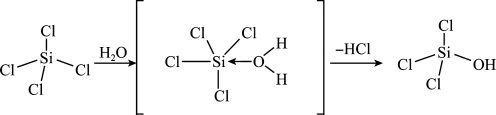
已知中间体SiCl4(H2O)的中心原子Si采取的杂化类型为sp3d,下列关于该中间体VSEPR模型的空间结构推断合理的是_______ (填标号)。
a.正四面体 b.三角双锥 c.正八面体
请画出NCl3水解时生成的中间体_______ 。
(1)HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式
(2)杂环化合物咪唑结构如图,已知分子中的大π键可用符号
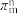 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为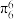 ),眯唑分子中的大π键可表示为
),眯唑分子中的大π键可表示为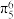 ,则咪唑分子中②号氮的杂化方式为
,则咪唑分子中②号氮的杂化方式为
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示,立方氮化硼属于

(4)SiCl4、NCl3均可发生水解反应,SiCl4水解机理如图:

已知中间体SiCl4(H2O)的中心原子Si采取的杂化类型为sp3d,下列关于该中间体VSEPR模型的空间结构推断合理的是
a.正四面体 b.三角双锥 c.正八面体
请画出NCl3水解时生成的中间体
您最近一年使用:0次
解题方法
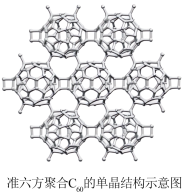
8 . 一种新型碳单晶一单层聚合C60。它是典型的半导体,预示其在光、电半导体器件中具有潜在应用。回答下列问题:
(1)基态碳原子的价电子轨道表示式为_______ 。
(2)下列有关单层聚合C60(准六方聚合C60的结构如图)的说法正确的是_______ (填字母)。
A.与金刚石、石墨烯互为同素异形体
B.与C60是同一种物质
C.所有的碳原子均为sp2杂化
D.它是一种共价化合物,不导电
E.它是由多个C60通过碳碳单键连接起来的
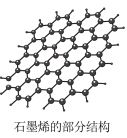
(3)石墨烯如图,分子中碳原子的杂化方式为_______ ,它具有很强的导电性,原因是_______ 。
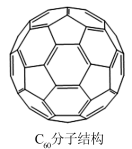
(4)C60的结构如图所示,它能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳双键的数目为_______ 。
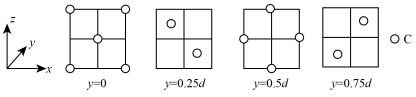
(5)金刚石晶胞的截面图如图所示(假设晶胞边长为dcm),原子1的分数坐标为_______ ,金刚石晶胞的密度为_______ (列出计算式,已知阿伏加德罗常数的值为NA)。
(1)基态碳原子的价电子轨道表示式为
(2)下列有关单层聚合C60(准六方聚合C60的结构如图)的说法正确的是

A.与金刚石、石墨烯互为同素异形体
B.与C60是同一种物质
C.所有的碳原子均为sp2杂化
D.它是一种共价化合物,不导电
E.它是由多个C60通过碳碳单键连接起来的
(3)石墨烯如图,分子中碳原子的杂化方式为

(4)C60的结构如图所示,它能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳双键的数目为

(5)金刚石晶胞的截面图如图所示(假设晶胞边长为dcm),原子1的分数坐标为

您最近一年使用:0次
名校
解题方法
9 . 工程塑料ABS是由丙烯腈(CH2=CH-CN)、1,3-丁二烯和苯乙烯共聚而成,工业上合成ABS的过程如下:
①R X
X A
A
②X+2Y HOCH2-C≡C-CH2OH
HOCH2-C≡C-CH2OH C4H10O2
C4H10O2 B
B
③C8H10 Q
Q S
S
④A+B+S ABS
ABS
(1)R的化学式是______ ;Y的结构简式是______ 。
(2)反应(I)的反应类型是______ ,反应(Ⅱ)的反应条件是______ 。
(3)下列对相关物质的描述,正确的是______ 。
A.固体R属于分子晶体
B.固体X属于共价晶体
C.A是不饱和烃
D.Y和葡萄糖的最简式相同
E.B与X互为同系物
(4)T与芳香烃C8H10互为同系物,分子中比C8H10多一个碳原子,T苯环上的一氯代物只有一种,写出T的结构简式和名称______ 。
(5)在一定条件下,B和S还可以发生加聚反应,生成一种重要的橡胶——丁苯橡胶,写出其化学方程式:______ 。
(6)检验Q分子中是否含有氯原子的方法是_____ 。
①R
 X
X A
A②X+2Y
 HOCH2-C≡C-CH2OH
HOCH2-C≡C-CH2OH C4H10O2
C4H10O2 B
B③C8H10
 Q
Q S
S④A+B+S
 ABS
ABS(1)R的化学式是
(2)反应(I)的反应类型是
(3)下列对相关物质的描述,正确的是
A.固体R属于分子晶体
B.固体X属于共价晶体
C.A是不饱和烃
D.Y和葡萄糖的最简式相同
E.B与X互为同系物
(4)T与芳香烃C8H10互为同系物,分子中比C8H10多一个碳原子,T苯环上的一氯代物只有一种,写出T的结构简式和名称
(5)在一定条件下,B和S还可以发生加聚反应,生成一种重要的橡胶——丁苯橡胶,写出其化学方程式:
(6)检验Q分子中是否含有氯原子的方法是
您最近一年使用:0次
名校
解题方法
10 . 固体有晶体和非晶体之分(实际上还有介于两者之间的晶体),下列对晶体SiO2和非晶体SiO2相关叙述中不正确的是


| A.相同质量的晶体SiO2转变为非晶体SiO2属于熵增过程 |
| B.晶体SiO2具有自范性,非晶体SiO2没有自范性 |
| C.晶体SiO2不具有物理性质各向异性的特点 |
| D.图中 a 表示的是晶态SiO2的衍射图谱 |
您最近一年使用:0次
2023-04-19更新
|
363次组卷
|
2卷引用:浙江省A9协作体2022-2023学年高二下学期期中联考化学试题



