名校
解题方法
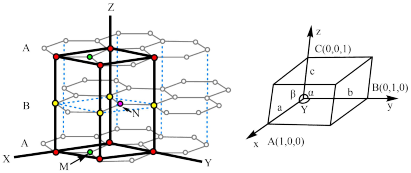
1 . 石墨和金刚石均属于碳的同素异形体,物理性质相差很大,归根结底是晶体结构不同造成的。已知石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如下图所示,图中用虚线标出了石墨的一个六方晶胞。___________ 。
(2)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为___________ (单位:g·cm-3)。
(3)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
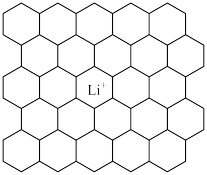
Ⅰ.下图给出了一个Li+沿C轴投影在A层上的位置,试在下图上标出与该离子临近的其他6个Li+的投影位置___________ 。
Ⅱ.在LiC6中,Li+与相邻石墨六元环的作用力属于何种键型___________ ?
Ⅲ.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式___________ 。
(2)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为
(3)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
Ⅰ.下图给出了一个Li+沿C轴投影在A层上的位置,试在下图上标出与该离子临近的其他6个Li+的投影位置
Ⅱ.在LiC6中,Li+与相邻石墨六元环的作用力属于何种键型
Ⅲ.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式
您最近一年使用:0次
名校
2 . 金属Co、Ni的性质相似,在电子工业以及金属材料中应用十分广泛。实验室中采用含钴、镍、铝的废渣(主要成分为Co2O3、Ni,含少量杂质Al2O3)提取钴、镍的具体流程如下:
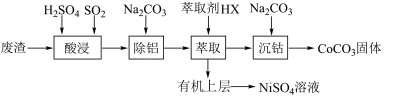
| A.酸浸时SO2的作用是加强反应液的酸性 |
| B.酸浸时Ni发生反应的离子方程式为2Ni+6H+=3H2↑+2Ni3+ |
| C.除铝过程中有白色沉淀碳酸铝产生 |
| D.Ni2+比Co2+更容易与萃取剂HX结合 |
您最近一年使用:0次
2024-03-30更新
|
97次组卷
|
2卷引用:河南省洛阳市宜阳县第一高级中学2023-2024学年高二下学期竞赛选拔赛化学试题
名校
解题方法
3 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为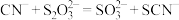 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
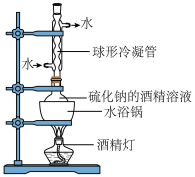
将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是___________ 。
(3)利用下图装置制备 。
。
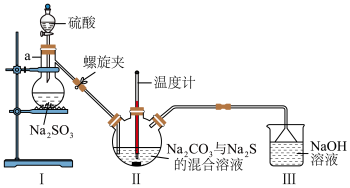
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置Ⅲ的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
(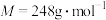 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为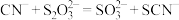 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是
(3)利用下图装置制备
 。
。
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置Ⅲ的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
(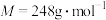 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 我国将镓列为战略储备金属,我国的镓储量占世界储量的80%以上。请回答:
(1)基态镓原子最外层的电子排布图为________ ,最高能级的电子云形状为_________ 。
(2)镓可与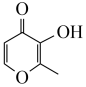 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga(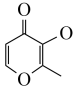 )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是___________ (填名称);每个甲基麦芽酚分子中含有___________ 个σ键。
(3)镓的卤化物熔点如表所示:
①氯化镓中镓的杂化方式与下列微粒的中心原子的杂化方式相同且氯化镓的空间结构也与其微粒相同的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
②各物质的熔点从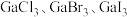 到
到 依次升高,原因是
依次升高,原因是___________ 。
(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以___________ 键结合。
(1)基态镓原子最外层的电子排布图为
(2)镓可与
 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是(3)镓的卤化物熔点如表所示:
| 物质 |  |  |  |  |
| 熔点/℃ | 1000 | 78 | 124 | 213 |
A.
 B.
B. C.
C. D.
D.
②各物质的熔点从
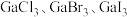 到
到 依次升高,原因是
依次升高,原因是(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以
您最近一年使用:0次
名校
5 . 某有机物的结构简式如图所示,下列有关该有机物的说法正确的是
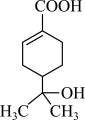
| A.该有机物可以发生取代、加成、氧化、水解反应 |
| B.与钠和氢氧化钠溶液都能发生反应,且得到的有机产物相同 |
| C.分子中含有两种官能团 |
| D.该有机物的分子式为C10H16O3 |
您最近一年使用:0次
2023-12-20更新
|
496次组卷
|
4卷引用:河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷
名校
6 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
Ⅰ.
(1)提高“酸溶”速率的措施有______ (任写一点即可)。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是______ 。
(3)“水解”操作中, 转化为
转化为 的离子方程式是
的离子方程式是______ 。分析化学上,测定 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,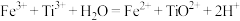 。反应②的滴定实验可选用
。反应②的滴定实验可选用______ (填化学式)溶液作指示剂。
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,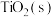 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:
(4) 与C、
与C、 反应的化学方程式为
反应的化学方程式为______ 。
(5)平衡常数表达式
______ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______ 。
A.混合气体的压强保持不变B.
C.混合气体的密度保持不变D. 和CO物质的量相等
和CO物质的量相等
(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则 的平均反应速率为
的平均反应速率为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
Ⅰ.
(1)提高“酸溶”速率的措施有
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(3)“水解”操作中,
 转化为
转化为 的离子方程式是
的离子方程式是 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,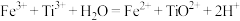 。反应②的滴定实验可选用
。反应②的滴定实验可选用Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为
 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,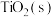 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:| 物质 |  | CO |  |  |
| 分压(MPa) | 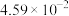 | 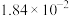 |  |  |
(4)
 与C、
与C、 反应的化学方程式为
反应的化学方程式为(5)平衡常数表达式

A.混合气体的压强保持不变B.

C.混合气体的密度保持不变D.
 和CO物质的量相等
和CO物质的量相等(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则
 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
2023-11-28更新
|
120次组卷
|
2卷引用:河南省洛阳市2023-2024学年高二上期期中考试化学试题
7 . 亚磷酸( )是一种二元弱酸,常温下,向一定浓度的NaOH溶液中逐滴滴加
)是一种二元弱酸,常温下,向一定浓度的NaOH溶液中逐滴滴加 溶液,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与
溶液,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 )是一种二元弱酸,常温下,向一定浓度的NaOH溶液中逐滴滴加
)是一种二元弱酸,常温下,向一定浓度的NaOH溶液中逐滴滴加 溶液,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与
溶液,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是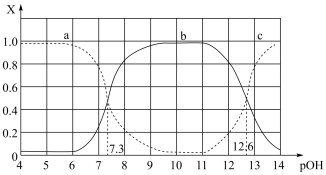
A.曲线b代表 |
B.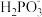 的 的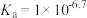 |
C.反应主要产物为 和 和 两种酸式盐 两种酸式盐 |
D.在 溶液中: 溶液中: |
您最近一年使用:0次
名校
解题方法
8 . 钨酸铋(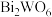 )是一种新型的光催化剂。一种以铜转炉白烟灰(主要成分是
)是一种新型的光催化剂。一种以铜转炉白烟灰(主要成分是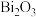 ,还含
,还含 、
、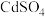 、
、 、
、 及CuO、
及CuO、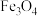 )为原料制备钨酸铋的工艺流程如图所示:
)为原料制备钨酸铋的工艺流程如图所示:
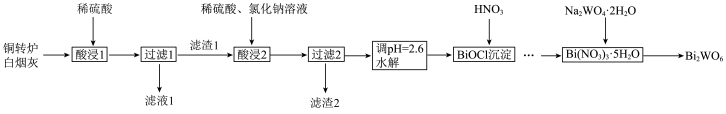
已知: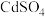 溶于水,
溶于水,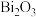 不溶于稀硫酸,溶于稀盐酸。
不溶于稀硫酸,溶于稀盐酸。
请回答下列问题:
(1)“酸浸1”时,铜转炉白烟灰与稀硫酸逆向加入,硫酸以喷雾形式,其目的是___________ 。
(2)滤渣1的成分是___________ (填化学式);在实验室进行“过滤1”需要的玻璃仪器为___________ 。
(3)“酸浸1”中生成 的化学方程式为
的化学方程式为___________ 。
(4)“酸浸2”中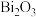 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(5)洗涤BiOCl沉淀的操作方法是___________ 。
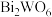 )是一种新型的光催化剂。一种以铜转炉白烟灰(主要成分是
)是一种新型的光催化剂。一种以铜转炉白烟灰(主要成分是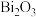 ,还含
,还含 、
、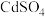 、
、 、
、 及CuO、
及CuO、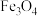 )为原料制备钨酸铋的工艺流程如图所示:
)为原料制备钨酸铋的工艺流程如图所示:
已知:
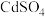 溶于水,
溶于水,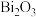 不溶于稀硫酸,溶于稀盐酸。
不溶于稀硫酸,溶于稀盐酸。请回答下列问题:
(1)“酸浸1”时,铜转炉白烟灰与稀硫酸逆向加入,硫酸以喷雾形式,其目的是
(2)滤渣1的成分是
(3)“酸浸1”中生成
 的化学方程式为
的化学方程式为(4)“酸浸2”中
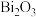 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(5)洗涤BiOCl沉淀的操作方法是
您最近一年使用:0次
2023-10-11更新
|
199次组卷
|
2卷引用:河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
9 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g) 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:

已知:①COC12(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为 (黄色);酸性条件下,H2O2将
(黄色);酸性条件下,H2O2将 (橙色)还原为Cr3+(绿色)。
(橙色)还原为Cr3+(绿色)。
(1)A装置用于干燥N2和观察其流速,A中的试剂是_______ ;无水CaCl2的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是_______ ;
(3)尾气与装置G中过量的NaOH溶液发生反应的离子方程式是_______ 。
(4)测定产品中CrCl3质量分数的实验步骤如下:
Ⅰ.取m g CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是分子指示剂提前变色),使 转化为
转化为 。
。
Ⅲ.在溶液中加入适量浓H2SO4混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗(NH4)2Fe(SO4)2标准溶液V mL(滴定中 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
产品中CrCl3质量分数表达式为_______ 。
 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COC12(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为
 (黄色);酸性条件下,H2O2将
(黄色);酸性条件下,H2O2将 (橙色)还原为Cr3+(绿色)。
(橙色)还原为Cr3+(绿色)。(1)A装置用于干燥N2和观察其流速,A中的试剂是
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是
(3)尾气与装置G中过量的NaOH溶液发生反应的离子方程式是
(4)测定产品中CrCl3质量分数的实验步骤如下:
Ⅰ.取m g CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为
 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是分子指示剂提前变色),使
 转化为
转化为 。
。Ⅲ.在溶液中加入适量浓H2SO4混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗(NH4)2Fe(SO4)2标准溶液V mL(滴定中
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。产品中CrCl3质量分数表达式为
您最近一年使用:0次
10 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:
反应Ⅰ:
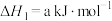
反应Ⅱ: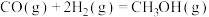
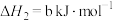
反应Ⅲ: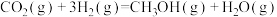

(1)原料 可通过捕获技术从空气或工业尾气中获取,下列物质能作为
可通过捕获技术从空气或工业尾气中获取,下列物质能作为 捕获剂的是___________(填标号)。
捕获剂的是___________(填标号)。
(2)根据盖斯定律,反应Ⅲ的
___________  。
。
(3)为提高单位时间内 的产量,可采取的措施有
的产量,可采取的措施有___________ 。(任填2项)
(4)上述反应平衡常数的自然对数 随
随 (T表示温度)的变化如图所示:
(T表示温度)的变化如图所示:

①反应Ⅰ、Ⅱ、Ⅲ中属于吸热反应的是___________ ,写出推理过程___________ 。
②若图中A点时发生反应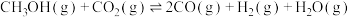 ,则该反应此时的
,则该反应此时的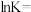
___________ (填数值)。
(5)一定条件下,向体积为VL的恒容密闭容器中通入1mol 和3mol
和3mol  发生反应Ⅰ和Ⅲ,达到平衡时,容器中
发生反应Ⅰ和Ⅲ,达到平衡时,容器中 (g)为a mol,CO为b mol,此时
(g)为a mol,CO为b mol,此时 的浓度为
的浓度为___________  (用含a、b、V的代数式表示)。
(用含a、b、V的代数式表示)。
已知:
反应Ⅰ:

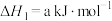
反应Ⅱ:
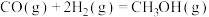
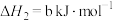
反应Ⅲ:
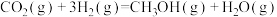

(1)原料
 可通过捕获技术从空气或工业尾气中获取,下列物质能作为
可通过捕获技术从空气或工业尾气中获取,下列物质能作为 捕获剂的是___________(填标号)。
捕获剂的是___________(填标号)。| A.NaOH溶液 | B.浓氨水 | C. | D. 溶液 溶液 |

 。
。(3)为提高单位时间内
 的产量,可采取的措施有
的产量,可采取的措施有(4)上述反应平衡常数的自然对数
 随
随 (T表示温度)的变化如图所示:
(T表示温度)的变化如图所示:
①反应Ⅰ、Ⅱ、Ⅲ中属于吸热反应的是
②若图中A点时发生反应
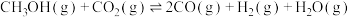 ,则该反应此时的
,则该反应此时的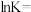
(5)一定条件下,向体积为VL的恒容密闭容器中通入1mol
 和3mol
和3mol  发生反应Ⅰ和Ⅲ,达到平衡时,容器中
发生反应Ⅰ和Ⅲ,达到平衡时,容器中 (g)为a mol,CO为b mol,此时
(g)为a mol,CO为b mol,此时 的浓度为
的浓度为 (用含a、b、V的代数式表示)。
(用含a、b、V的代数式表示)。
您最近一年使用:0次
2023-06-13更新
|
128次组卷
|
2卷引用:河南省洛阳市2022-2023学年高二下学期质量检测化学试题



