名校
解题方法
1 . 一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知 ,用
,用 表示阿伏加德罗常数的值):
表示阿伏加德罗常数的值):
 ,用
,用 表示阿伏加德罗常数的值):
表示阿伏加德罗常数的值):
A.基态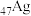 失去4d能级上的一个电子转化为 失去4d能级上的一个电子转化为 |
B.若N点原子分数坐标为(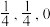 ),则P点原子分数坐标为( ),则P点原子分数坐标为(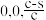 ) ) |
C.M、N之间的距离为 |
D.晶体的密度为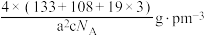 |
您最近一年使用:0次
7日内更新
|
10次组卷
|
6卷引用:河南省信阳高级中学2023-2024学年高三上学期11月一模考试化学试题
名校
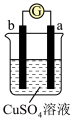
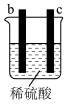
2 . 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是
| 实验装置 |
|
|
| 部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 |
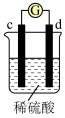
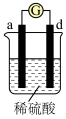
| 实验装置 |
|
|
| 部分实验现象 | d极溶解,c极有气体产生 | 电流计指示在导线中电流从a极流向d极 |
A. | B. |
C. | D. |
您最近一年使用:0次
2024-04-21更新
|
216次组卷
|
7卷引用:河南省信阳高级中学2023-2024学年高一下学期4月月考化学试题
河南省信阳高级中学2023-2024学年高一下学期4月月考化学试题湖南省邵东市第一中学2022-2023学年高一上学期期末测试化学试题宁夏石嘴山市第三中学2023-2024学年高一下学期3月月考化学试题(已下线)专题02 化学反应与能量变化-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)广西来宾市忻城县高级中学2023-2024学年高一下学期期中考试化学试卷云南省下关第一中学2023-2024学年高一下学期5月期中考试化学试题吉林省长春市第五中学、田家炳实验中学2023-2024学年高一下学期第二学程考试化学试题
解题方法
3 . 化学与人类生产、生活密切相关,下列说法中错误的是
| A.亚硝酸钠有毒,不能用作食品添加剂 |
| B.储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料 |
| C.电阻率低、热导率高的石墨烯可用于制作超级导电材料 |
| D.液晶既有液体的流动性,又有类似晶体的各向异性 |
您最近一年使用:0次
名校
解题方法
4 . 铁盐与亚铁盐在工业生产和生活中具有重要应用。硫酸亚铁溶液可用于脱除烟气中的二氧化硫等有害气体。  溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
 溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是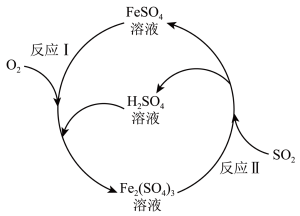
| A.“反应Ⅰ”中氧化剂和还原剂的物质的量之比为4∶1 |
B.“反应Ⅱ”的离子方程式为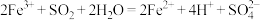 |
C.反应一段时间后,溶液中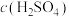 保持不变 保持不变 |
D.反应每脱除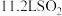 转移电子的物质的量为 转移电子的物质的量为 |
您最近一年使用:0次
2024-04-12更新
|
289次组卷
|
9卷引用:河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题
河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题浙江省杭州市八县区2022-2023学年高一上学期期末检测化学试题浙江省杭州市临平区2022-2023学年高一上学期期末学业水平测试化学试题(已下线)【2023】【高一上】【杭七】【期末考】【高中化学】【廖汨平收集】河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题13-2023新东方高二上期中考化学13河南省名校联盟2023-2024学年高一下学期3月月考化学试题云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期4月月考化学试题湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题
解题方法
5 . 硫代尿素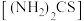 在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
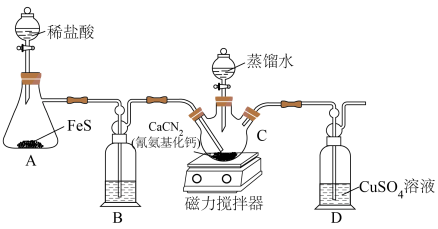
(1)装置A中发生反应的化学方程式___________ 。
(2)装置B中盛放的是___________ (填写试剂名称),其作用是___________ 。
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中___________ (填写实验现象),则证明装置中的空气被排出。
(4)将蒸馏水滴入___________ 中(填写仪器C的名称),同时开启磁力搅拌器, 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。
(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、冷却结晶、过滤、洗涤、低温烘干得到产品。蒸发浓缩时需要在减压条件下进行,其目的是___________ 。
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为___________ %。(已知滴定反应: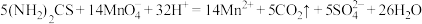 )
)
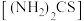 在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
(1)装置A中发生反应的化学方程式
(2)装置B中盛放的是
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中
(4)将蒸馏水滴入
 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、冷却结晶、过滤、洗涤、低温烘干得到产品。蒸发浓缩时需要在减压条件下进行,其目的是
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为
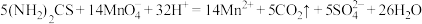 )
)
您最近一年使用:0次
解题方法
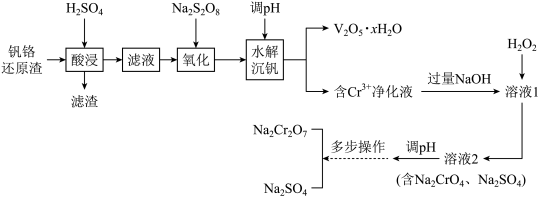
6 . 钒铬还原渣是钠化提钒过程的固体废弃物,其中钒是钒铬还原渣中最有价值的元素,其主要成分为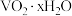 、
、 及少量的
及少量的 。一种初步分离钒铬还原渣中钒铬并获得
。一种初步分离钒铬还原渣中钒铬并获得 的工艺流程如下图。
的工艺流程如下图。
已知:①“酸浸”后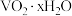 转化为
转化为 ;
;
②常温下, 的
的 近似为
近似为 ;
;
③有关物质的溶解度(
 )如下表所示。
)如下表所示。
回答下列问题:
(1)写出“滤渣”的一种用途___________ ,“氧化”生成 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)常温下,若“含 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5~
,则“水解沉钒”调pH的范围是2.5~___________ 。
(3)“溶液1”中含 ,加入
,加入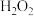 后发生的化学反应方程式为
后发生的化学反应方程式为___________ 。
(4)“溶液2调pH”所发生反应的离子方程式___________ 。
(5)“多步操作”包括蒸发浓缩、___________ 、冷却结晶、过滤、洗涤等步骤。
(6)研究温度对 与
与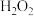 的氧化-水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用
的氧化-水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用 、
、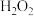 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是___________ 、___________ ,在“氧化”工序中不采用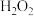 氧化的原因是
氧化的原因是___________ (写出一点即可)。

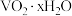 、
、 及少量的
及少量的 。一种初步分离钒铬还原渣中钒铬并获得
。一种初步分离钒铬还原渣中钒铬并获得 的工艺流程如下图。
的工艺流程如下图。
已知:①“酸浸”后
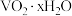 转化为
转化为 ;
;②常温下,
 的
的 近似为
近似为 ;
;③有关物质的溶解度(

 )如下表所示。
)如下表所示。| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)写出“滤渣”的一种用途
 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为(2)常温下,若“含
 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5~
,则“水解沉钒”调pH的范围是2.5~(3)“溶液1”中含
 ,加入
,加入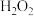 后发生的化学反应方程式为
后发生的化学反应方程式为(4)“溶液2调pH”所发生反应的离子方程式
(5)“多步操作”包括蒸发浓缩、
(6)研究温度对
 与
与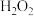 的氧化-水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用
的氧化-水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用 、
、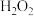 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是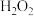 氧化的原因是
氧化的原因是
您最近一年使用:0次
解题方法
7 . 乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
Ⅰ.工业用 和
和 在一定条件下合成乙烯:
在一定条件下合成乙烯: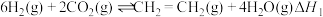
已知:①
②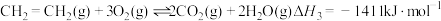
(1)
___________ 
(2)在刚性密闭容器中充入体积比为 的
的 和
和 ,在一定条件下模拟工业合成乙烯,不同温度对
,在一定条件下模拟工业合成乙烯,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,下列说法
的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确 的是___________(填字母)。
Ⅱ.工业用甲烷催化法制取乙烯: ,T℃时,向3L的恒容反应器中充入
,T℃时,向3L的恒容反应器中充入 ,仅发生上述反应,反应过程中的物质的量随时间变化如图所示:
,仅发生上述反应,反应过程中的物质的量随时间变化如图所示: ,
,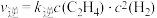 ,
, 、
、 为速率常数,只与温度有关,T℃时,平衡时容器内
为速率常数,只与温度有关,T℃时,平衡时容器内 的物质的量为
的物质的量为 ,则
,则 与
与 的比值为
的比值为___________ (用含a的代数式表示);若将温度降低,速率常数减少的倍数:
___________ (填“>”、“=”或“<”) 。
。
Ⅲ.乙烷裂解制乙烯:
(4)T℃时,将乙烷与氦气体积比 混合后,通入一密闭容器中发生反应。平衡时容器压强为
混合后,通入一密闭容器中发生反应。平衡时容器压强为 ,若乙烷的平衡转化率为80%,反应的平衡常数
,若乙烷的平衡转化率为80%,反应的平衡常数
___________ kPa(用分压表示,分压=总压×物质的量分数)。
Ⅳ.电解法还原二氧化碳制乙烯原理如图所示(AB表示直流电源)。___________ 。
Ⅰ.工业用
 和
和 在一定条件下合成乙烯:
在一定条件下合成乙烯: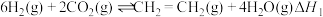
已知:①

②
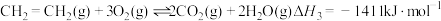
(1)


(2)在刚性密闭容器中充入体积比为
 的
的 和
和 ,在一定条件下模拟工业合成乙烯,不同温度对
,在一定条件下模拟工业合成乙烯,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,下列说法
的平衡转化率和催化剂催化效率的影响如图所示,下列说法
A.平衡常数: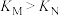 |
B.消耗 的速率: 的速率: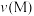 可能小于 可能小于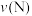 |
C.为了提高 的平衡转化率,选择温度越低越好 的平衡转化率,选择温度越低越好 |
| D.M点时的压强一定小于N点时的压强 |
Ⅱ.工业用甲烷催化法制取乙烯:
 ,T℃时,向3L的恒容反应器中充入
,T℃时,向3L的恒容反应器中充入 ,仅发生上述反应,反应过程中的物质的量随时间变化如图所示:
,仅发生上述反应,反应过程中的物质的量随时间变化如图所示: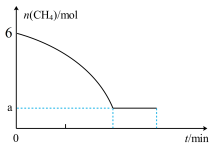
 ,
,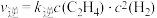 ,
, 、
、 为速率常数,只与温度有关,T℃时,平衡时容器内
为速率常数,只与温度有关,T℃时,平衡时容器内 的物质的量为
的物质的量为 ,则
,则 与
与 的比值为
的比值为
 。
。Ⅲ.乙烷裂解制乙烯:

(4)T℃时,将乙烷与氦气体积比
 混合后,通入一密闭容器中发生反应。平衡时容器压强为
混合后,通入一密闭容器中发生反应。平衡时容器压强为 ,若乙烷的平衡转化率为80%,反应的平衡常数
,若乙烷的平衡转化率为80%,反应的平衡常数
Ⅳ.电解法还原二氧化碳制乙烯原理如图所示(AB表示直流电源)。

您最近一年使用:0次
解题方法
8 . 一种银铟矿主要成分为 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等物质,从该矿获得稀有金属的工艺流程如图所示:
等物质,从该矿获得稀有金属的工艺流程如图所示:

该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
(1)“浸出”过程中金、银、铜分别转化为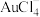 、
、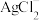 、
、 进入溶液,同时生成硫,写出
进入溶液,同时生成硫,写出 发生反应的离子方程式
发生反应的离子方程式___________ 。
(2)高温水蒸气除铁利用了 易水解的性质,写出该反应的化学方程式
易水解的性质,写出该反应的化学方程式___________ 。
(3)“二次还原”得到的滤渣主要成分___________ (填化学式)。
(4)“二次中和”得到的滤渣除少量 外,主要成分还有
外,主要成分还有___________ (填化学式)。
(5)“分铅锌”步骤中,维持 饱和水溶液的浓度为0.01mol/L,为使
饱和水溶液的浓度为0.01mol/L,为使 沉淀完全(沉淀完全是指离子浓度小于或等于
沉淀完全(沉淀完全是指离子浓度小于或等于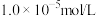 ),需控制溶液的pH不小于
),需控制溶液的pH不小于___________ 。已知 :
: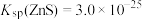 ;
;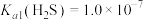 ;
; ;
;
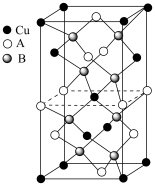
(6)一种铜铟硒晶体(化学式为 )的晶胞结构如图所示,晶胞中
)的晶胞结构如图所示,晶胞中 和
和 未标明,用A或者B代替。推断
未标明,用A或者B代替。推断 是
是___________ (填“A”或“B”),晶体中一个 周围与它最近且等距离的A粒子的个数为
周围与它最近且等距离的A粒子的个数为___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等物质,从该矿获得稀有金属的工艺流程如图所示:
等物质,从该矿获得稀有金属的工艺流程如图所示:
该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 2.2 | 2.1 | 2.6 | 4.6 | 6.24 | 7.1 |
完全沉淀( )的pH )的pH | 3.2 | 3.4 | 4.3 | 6.6 | 8.24 | 9.1 |
(1)“浸出”过程中金、银、铜分别转化为
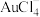 、
、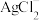 、
、 进入溶液,同时生成硫,写出
进入溶液,同时生成硫,写出 发生反应的离子方程式
发生反应的离子方程式(2)高温水蒸气除铁利用了
 易水解的性质,写出该反应的化学方程式
易水解的性质,写出该反应的化学方程式(3)“二次还原”得到的滤渣主要成分
(4)“二次中和”得到的滤渣除少量
 外,主要成分还有
外,主要成分还有(5)“分铅锌”步骤中,维持
 饱和水溶液的浓度为0.01mol/L,为使
饱和水溶液的浓度为0.01mol/L,为使 沉淀完全(沉淀完全是指离子浓度小于或等于
沉淀完全(沉淀完全是指离子浓度小于或等于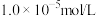 ),需控制溶液的pH不小于
),需控制溶液的pH不小于 :
: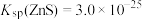 ;
; ;
; ;
;(6)一种铜铟硒晶体(化学式为
 )的晶胞结构如图所示,晶胞中
)的晶胞结构如图所示,晶胞中 和
和 未标明,用A或者B代替。推断
未标明,用A或者B代替。推断 是
是 周围与它最近且等距离的A粒子的个数为
周围与它最近且等距离的A粒子的个数为
您最近一年使用:0次
解题方法
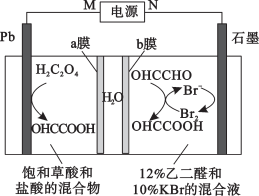
9 . 乙醛酸(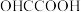 )用作调香剂、香料等,还用作医药、染料、塑料和农药的中间体。利用双极膜(由阴离子交换膜和阳离子交换膜组成,双极膜中间层中的水解离成
)用作调香剂、香料等,还用作医药、染料、塑料和农药的中间体。利用双极膜(由阴离子交换膜和阳离子交换膜组成,双极膜中间层中的水解离成 和
和 ,并在直流电场的作用下,分别向两极迁移)技术电解制备乙醛酸的装置如图所示。下列说法错误的是
,并在直流电场的作用下,分别向两极迁移)技术电解制备乙醛酸的装置如图所示。下列说法错误的是
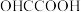 )用作调香剂、香料等,还用作医药、染料、塑料和农药的中间体。利用双极膜(由阴离子交换膜和阳离子交换膜组成,双极膜中间层中的水解离成
)用作调香剂、香料等,还用作医药、染料、塑料和农药的中间体。利用双极膜(由阴离子交换膜和阳离子交换膜组成,双极膜中间层中的水解离成 和
和 ,并在直流电场的作用下,分别向两极迁移)技术电解制备乙醛酸的装置如图所示。下列说法错误的是
,并在直流电场的作用下,分别向两极迁移)技术电解制备乙醛酸的装置如图所示。下列说法错误的是
| A.Pb电极上发生还原反应 |
B. 通过b膜向石墨电极迁移 通过b膜向石墨电极迁移 |
C.石墨电极反应式为: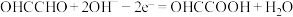 |
D.电路中转移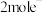 ,理论上可得到 ,理论上可得到 |
您最近一年使用:0次
10 . 一定条件下,银催化剂表面上存在反应: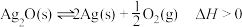 ,起始状态Ⅰ中有
,起始状态Ⅰ中有 、
、 和
和 ,经下列过程达到各平衡状态(已知状态Ⅰ和Ⅲ的固体质量相等),下列叙述正确的是
,经下列过程达到各平衡状态(已知状态Ⅰ和Ⅲ的固体质量相等),下列叙述正确的是

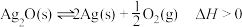 ,起始状态Ⅰ中有
,起始状态Ⅰ中有 、
、 和
和 ,经下列过程达到各平衡状态(已知状态Ⅰ和Ⅲ的固体质量相等),下列叙述正确的是
,经下列过程达到各平衡状态(已知状态Ⅰ和Ⅲ的固体质量相等),下列叙述正确的是
A.从Ⅰ到Ⅱ的过程 |
B.反应的平衡压强: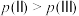 |
C.平衡常数: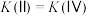 |
D.若体积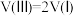 ,则 ,则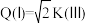 |
您最近一年使用:0次