1 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
解题方法
2 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误 的是
| 性质差异 | 结构因素 | |
| A | 溶解度: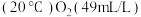 大于 大于 | 分子间作用力 |
| B | 键角: | 杂化类型 |
| C | 酸性: 远强于 远强于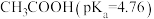 | 羟基极性 |
| D | 气态氢化物稳定性:HF强于HCl | 氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 硫酸四氨合铜(Ⅱ)晶体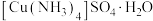 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。
I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入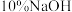 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。
步骤②:___________ ,调pH为3.5的目的是___________ 。
(2)写出操作①中发生的离子反应方程式___________ 。
(3)操作③中洗涤步骤中可选用的洗涤液是___________ 。
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你___________ (填“是”或“否”)同意他的观点,并说明理由___________ 。
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。
步骤②:量取上述试液 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)
步骤③:用 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入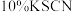 溶液
溶液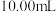 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。
已知:①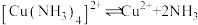 ,
,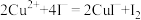 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。
② 比
比 更难溶。③
更难溶。③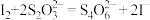 。
。
(5)硫酸四氨合铜晶体纯度是___________ (写出用m、V表示的计算表达式。)。
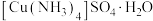 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取
 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入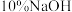 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。步骤②:

(2)写出操作①中发生的离子反应方程式
(3)操作③中洗涤步骤中可选用的洗涤液是
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取
 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。步骤②:量取上述试液
 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)步骤③:用
 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入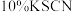 溶液
溶液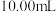 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。已知:①
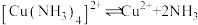 ,
,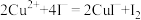 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。②
 比
比 更难溶。③
更难溶。③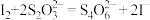 。
。(5)硫酸四氨合铜晶体纯度是
您最近一年使用:0次
4 . 实验是探究物质性质的重要方法,下列操作中,实验现象与得出的结论相一致的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较HClO和CH3COOH的酸性强弱 | 用pH计测定NaClO和CH3COONa的pH值,测得pH(NaClO)>pH(CH3COONa) | 酸性:HClO>CH3COOH |
| B | 验证反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 | 向2mL 0.1mol/L FeCl3溶液加入几滴0.1mol/L KI溶液,充分反应。取反应后试样,滴加淀粉溶液,溶液变为蓝色;另取反应后试样,加入KSCN溶液,溶液变成血红色 | 反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 |
| C | 判断 (AgCl)与 (AgCl)与 (AgI)的大小 (AgI)的大小 | 向等浓度的NaCl、NaI的混合溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
| D | 判断某 溶液样品中是否含有 溶液样品中是否含有 | 向某 溶液样品中加入硫酸酸化的 溶液样品中加入硫酸酸化的 溶液,紫色褪去 溶液,紫色褪去 | 该样品中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
(1)最活泼的金属元素是___________ (填元素符号),最高价氧化物对应水化物酸性最强的是___________ (填氧化物对应水化物的化学式)。
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程___________ 。
(3)①②⑦的原子半径由大到小的顺序为___________ (填元素符号)。
(4)①和⑧非金属性比较①___________ ⑧(填>、<或=),请设计实验证明___________ (用一个化学方程式表示)。
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式___________ 。
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程
(3)①②⑦的原子半径由大到小的顺序为
(4)①和⑧非金属性比较①
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| A.①③ | B.③② | C.③① | D.①② |
您最近一年使用:0次
解题方法
6 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:3C1O-+2Fe3++10OH-=2 +3Cl-+5H2O。下列说法正确的是
+3Cl-+5H2O。下列说法正确的是
 +3Cl-+5H2O。下列说法正确的是
+3Cl-+5H2O。下列说法正确的是| A.该反应中氧化剂与还原剂物质的量之比为3∶2 |
B.该反应中 是氧化剂,Cl-是还原剂 是氧化剂,Cl-是还原剂 |
| C.当生成1mol Na2FeO4时,转移6mol e- |
| D.在酸性溶液中,反应方程式不会发生变化 |
您最近一年使用:0次
7 . 研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
②2H2(g)+CO(g) CH3OH(g) ΔH2=-128.3kJ·mol−1
CH3OH(g) ΔH2=-128.3kJ·mol−1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol−1
若某反应的平衡常数表达式为:K=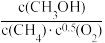 ,则此反应ΔH=
,则此反应ΔH=___________ kJ·mol−1。
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。催化重整反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。
2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。___________ 。
②压强为P4时,在Y点:v正___________ v逆(填“>”、“<”或“=”)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为___________ 。
(3)CO2加氢制备甲酸(HCOOH)可回收利用CO2,温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当HCOOH的体积分数为25%时,CO2的转化率为___________ 。
②温度为T1,反应达到平衡时,k逆=___________ (用k正表示)。改变温度至T2,若k逆=0.9k正,则T1___________ T2(填“>”、“<”或“=”)。
(4)采用电还原法也可将CO2转化为甲酸,在碳酸氢盐的水溶液中,CO2被还原成甲酸的原理如图所示。阴极的电极反应式是___________ 。
(1)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1②2H2(g)+CO(g)
 CH3OH(g) ΔH2=-128.3kJ·mol−1
CH3OH(g) ΔH2=-128.3kJ·mol−1③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol−1
若某反应的平衡常数表达式为:K=
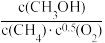 ,则此反应ΔH=
,则此反应ΔH=(2)CH4-CO2催化重整对温室气体的减排具有重要意义。催化重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。
2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。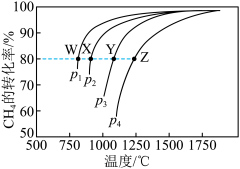
②压强为P4时,在Y点:v正
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为
(3)CO2加氢制备甲酸(HCOOH)可回收利用CO2,温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。①当HCOOH的体积分数为25%时,CO2的转化率为
②温度为T1,反应达到平衡时,k逆=
(4)采用电还原法也可将CO2转化为甲酸,在碳酸氢盐的水溶液中,CO2被还原成甲酸的原理如图所示。阴极的电极反应式是
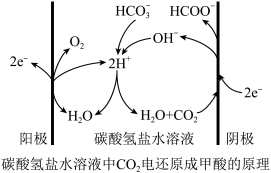
您最近一年使用:0次
解题方法
8 . 大多有机反应的速率较慢,实际反应中都需要加入一定量的催化剂,其中铜离子、冠醚都是有机反应中的催化剂。回答下列问题:
(1)基态 的价电子排布图为
的价电子排布图为_______ ;与基态 相比,失去1个电子所需能量较大的是
相比,失去1个电子所需能量较大的是_______ (填“ ”或“
”或“ ”),原因为
”),原因为_______ 。
(2)若将 转化为螯合物,会降低其催化效果。某
转化为螯合物,会降低其催化效果。某 螯合物的结构简式如图所示,其中
螯合物的结构简式如图所示,其中 的配位数为
的配位数为_______ ,碳原子的杂化方式为_______ 。 和
和 的混合溶液中将
的混合溶液中将 筛出(结构简式如图所示),其原理为
筛出(结构简式如图所示),其原理为_______ 。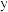 轴投影图如图所示,已知晶胞参数为
轴投影图如图所示,已知晶胞参数为 ,铜原子半径为
,铜原子半径为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。_______ 。
②该晶体的空间利用率为_______ (用含a、b的代数式表示);密度为_______ (用含 的代数式表示)
的代数式表示) 。
。
(1)基态
 的价电子排布图为
的价电子排布图为 相比,失去1个电子所需能量较大的是
相比,失去1个电子所需能量较大的是 ”或“
”或“ ”),原因为
”),原因为(2)若将
 转化为螯合物,会降低其催化效果。某
转化为螯合物,会降低其催化效果。某 螯合物的结构简式如图所示,其中
螯合物的结构简式如图所示,其中 的配位数为
的配位数为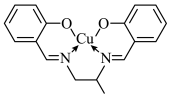
 和
和 的混合溶液中将
的混合溶液中将 筛出(结构简式如图所示),其原理为
筛出(结构简式如图所示),其原理为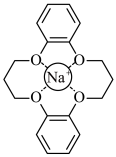
 轴投影图如图所示,已知晶胞参数为
轴投影图如图所示,已知晶胞参数为 ,铜原子半径为
,铜原子半径为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。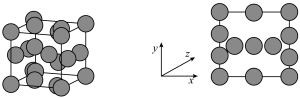
②该晶体的空间利用率为
 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
2024-04-16更新
|
138次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
解题方法
9 . 短周期元素R、X、T、Z、Q中含有两种金属元素且原子半径依次增大,其中X和T同主族,R的最高正价与最低负价的绝对值相等,X、T的核电荷数之和等于Z、Q的核电荷数之和。下列说法错误的是
| A.非金属性:R<T<X |
| B.简单离子半径:Z<Q<X |
| C.常温下,T的最高价氧化物对应水化物的浓溶液与Z不反应 |
| D.Q、T分别与X形成的二元化合物的熔点:T<Q |
您最近一年使用:0次
2024-04-16更新
|
245次组卷
|
2卷引用:四川省雅安市天全中学2024届高三下学期模拟预测化学试题5
10 . 缓冲溶液是指加少量水稀释或外加少量酸、碱,自身pH不发生显著变化的溶液。1L含1mol乳酸(HLac)和1mol乳酸钠(NaLac)的溶液就是一种缓冲溶液,该溶液的pH为3.85。下图是此缓冲溶液的pH随通入HCl(g)或加入NaOH(s)的物质的量变化的示意图(溶液体积保持1L),已知lg3=0.48。下列说法错误的是
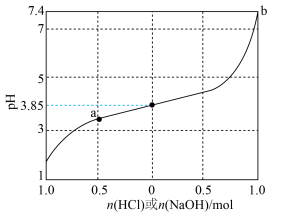
A.此缓冲溶液中(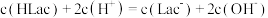 |
| B.通过计算可得出,a点溶液的pH约为3.37 |
| C.根据图像可以判断,b点溶液已失去缓冲能力 |
D.当加入NaOH,且横坐标为0.5时,对应溶液中(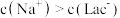 |
您最近一年使用:0次
2024-04-16更新
|
274次组卷
|
4卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题



