名校
解题方法
1 . 钪是一种重要的稀土元素,其氧化物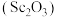 是一种重要的无机化工原料,广泛应用于电子、陶瓷、光学、化工等领域。工业上利用固体废料“赤泥”(含
是一种重要的无机化工原料,广泛应用于电子、陶瓷、光学、化工等领域。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)生产高纯氧化钪,同时回收
等)生产高纯氧化钪,同时回收 。工艺流程如图:
。工艺流程如图: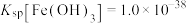 ;ⅲ.草酸沉淀实验结果
;ⅲ.草酸沉淀实验结果
回答下列问题:
(1)基态 原子的简化电子排布式为
原子的简化电子排布式为___________ 。
(2)为提高“酸浸”速率,可采取的措施是___________ (答出一条即可)。
(3)滤渣1的成分___________ 。
(4)“氧化”后溶液中 浓度为
浓度为 ,常温下“调
,常温下“调 ”时,若控制
”时,若控制 ,则
,则 的去除率为
的去除率为___________ %(忽略掉 前后溶液的体积变化)。
前后溶液的体积变化)。
(5)过程中 生成
生成 的离子方程式为
的离子方程式为___________ 。
(6)研究人员对“沉钪”过程的定量条件进行了对比实验,条件最适合的是已知ⅲ中的第1组,原因是:不仅沉淀率>99.0%、节约草酸用量,且___________ 。
(7)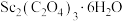 在空气中加热分解时,
在空气中加热分解时, 随温度变化如图所示。已知:
随温度变化如图所示。已知: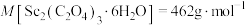 。250℃时固体的主要成分是
。250℃时固体的主要成分是___________ (填化学式)。
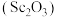 是一种重要的无机化工原料,广泛应用于电子、陶瓷、光学、化工等领域。工业上利用固体废料“赤泥”(含
是一种重要的无机化工原料,广泛应用于电子、陶瓷、光学、化工等领域。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)生产高纯氧化钪,同时回收
等)生产高纯氧化钪,同时回收 。工艺流程如图:
。工艺流程如图:
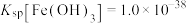 ;ⅲ.草酸沉淀实验结果
;ⅲ.草酸沉淀实验结果| 实验 | 溶液酸度(pH) |  与草酸物质的量之比 与草酸物质的量之比 | 沉淀颗粒 | 草酸钪沉率% |
| 1 | 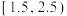 |  | 较粗 | 99.2 |
| 2 | 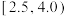 |  | 粗 | 97.2 |
| 3 |  | 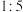 | 细 | 90.1 |
| 4 |  | 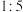 | 很细 | 93.3 |
(1)基态
 原子的简化电子排布式为
原子的简化电子排布式为(2)为提高“酸浸”速率,可采取的措施是
(3)滤渣1的成分
(4)“氧化”后溶液中
 浓度为
浓度为 ,常温下“调
,常温下“调 ”时,若控制
”时,若控制 ,则
,则 的去除率为
的去除率为 前后溶液的体积变化)。
前后溶液的体积变化)。(5)过程中
 生成
生成 的离子方程式为
的离子方程式为(6)研究人员对“沉钪”过程的定量条件进行了对比实验,条件最适合的是已知ⅲ中的第1组,原因是:不仅沉淀率>99.0%、节约草酸用量,且
(7)
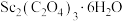 在空气中加热分解时,
在空气中加热分解时, 随温度变化如图所示。已知:
随温度变化如图所示。已知: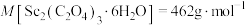 。250℃时固体的主要成分是
。250℃时固体的主要成分是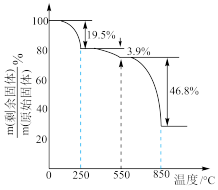
您最近一年使用:0次
名校
解题方法
2 . 抗血栓药物氯吡格雷的重要中间体之一“2-噻吩乙醇”(Mr=128)的制备步骤如下: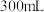 液体X和
液体X和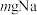 ,加热至
,加热至 熔化后盖紧塞子,振荡至大量微小
熔化后盖紧塞子,振荡至大量微小 珠出现。降温至10℃,加入
珠出现。降温至10℃,加入 噻吩,反应至
噻吩,反应至 珠消失。
珠消失。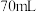 水,搅拌30min;②加盐酸调
水,搅拌30min;②加盐酸调 至4~6,继续反应2h;③分液,用水洗涤有机相,再二次分液;④向有机相中加入无水
至4~6,继续反应2h;③分液,用水洗涤有机相,再二次分液;④向有机相中加入无水 ,静置过滤;⑤进行___________,分离出四氢呋喃、噻吩和液体X等杂质;⑥得到
,静置过滤;⑤进行___________,分离出四氢呋喃、噻吩和液体X等杂质;⑥得到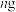 产品
产品
(1)步骤ⅰ中液体X可以选择___________ (填字母)。
a.水 b.甲苯 c.乙醇 d.苯酚
(2)写出步骤ⅰ制2-噻吩钠的化学方程式为___________ 。
(3)写出步骤ⅲ中加入无水 的作用为
的作用为___________ 。
(4)步骤ⅲ中⑤的操作的名称为______ ;写出选择此分离提纯方法的理由是________ 。
(5)产品“2-噻吩乙醇”(Mr=128)的产率为___________ (用含m、n的代数式表示)。
(6)某次平行实验所得产品质量比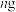 低些,写出其中一种可能的原因
低些,写出其中一种可能的原因___________ 。

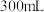 液体X和
液体X和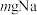 ,加热至
,加热至 熔化后盖紧塞子,振荡至大量微小
熔化后盖紧塞子,振荡至大量微小 珠出现。降温至10℃,加入
珠出现。降温至10℃,加入 噻吩,反应至
噻吩,反应至 珠消失。
珠消失。ⅱ.制噻吩乙醇钠:降温至-10℃,加入稍过量的 的四氢呋喃溶液,反应30min(四氢呋喃
的四氢呋喃溶液,反应30min(四氢呋喃 是有机溶剂,沸点66℃,可防止因反应放热而导致温度过高引发副反应)
是有机溶剂,沸点66℃,可防止因反应放热而导致温度过高引发副反应)
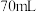 水,搅拌30min;②加盐酸调
水,搅拌30min;②加盐酸调 至4~6,继续反应2h;③分液,用水洗涤有机相,再二次分液;④向有机相中加入无水
至4~6,继续反应2h;③分液,用水洗涤有机相,再二次分液;④向有机相中加入无水 ,静置过滤;⑤进行___________,分离出四氢呋喃、噻吩和液体X等杂质;⑥得到
,静置过滤;⑤进行___________,分离出四氢呋喃、噻吩和液体X等杂质;⑥得到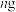 产品
产品(1)步骤ⅰ中液体X可以选择
a.水 b.甲苯 c.乙醇 d.苯酚
(2)写出步骤ⅰ制2-噻吩钠的化学方程式为
(3)写出步骤ⅲ中加入无水
 的作用为
的作用为(4)步骤ⅲ中⑤的操作的名称为
(5)产品“2-噻吩乙醇”(Mr=128)的产率为
(6)某次平行实验所得产品质量比
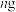 低些,写出其中一种可能的原因
低些,写出其中一种可能的原因
您最近一年使用:0次
名校
解题方法
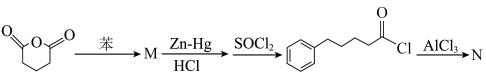
3 . 化合物K常用作医药中间体、材料中间体,其合成路线如图所示。
(1)检验苯中含有A的化学试剂为______ 。
(2)C→D的反应类型为______ ;G的结构简式为______ 。
(3)H→I的化学方程式为______ 。
(4)D的同分异构体中,仅含有-OOCCH3,-CH3和苯环结构的有______ 种(不考虑立体异构)。
(5)根据上述信息,写出合成路线中M和N结构简式:M______ N______ 。
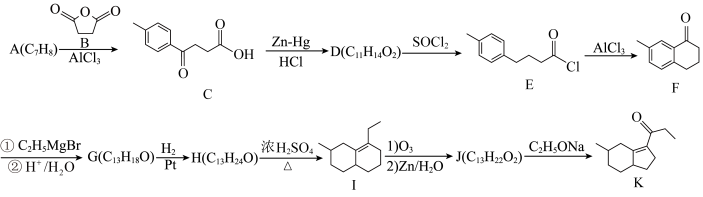
(1)检验苯中含有A的化学试剂为
(2)C→D的反应类型为
(3)H→I的化学方程式为
(4)D的同分异构体中,仅含有-OOCCH3,-CH3和苯环结构的有
(5)根据上述信息,写出合成路线中M和N结构简式:M
您最近一年使用:0次
名校
解题方法
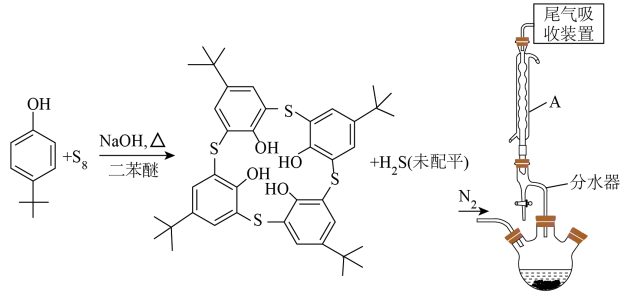
4 . 自分子识别兴起以来,冠醚、杯酚烃等的合成引起了研究者的广泛关注。硫代杯[4]芳烃已被应用于许多方面,如监测和分离一些阴阳离子等。
I.向500mL三颈烧瓶(加热、搅拌、夹持等装置省略)中加入60.00g对叔丁基苯酚、25.60gS8、8g氢氧化钠和40mL二苯醚。
II.在N2气氛下磁力加热搅拌,逐步升温到230℃,温度保持在230℃反应4小时。
III.停止加热并冷却至100℃以下后,加入40mL6mol/L的盐酸和400mL乙醇的混合溶液,搅拌,抽滤,用乙醇和蒸馏水交替洗涤固体,得到粗产物。
IV.将粗产物在氯仿/乙醇中重结晶,得到30.24g纯化的对叔丁基硫代杯[4]芳烃。
回答下列问题:
(1)仪器A的名称是______ ,其作用是______ 。
(2)对叔丁基邻苯二酚(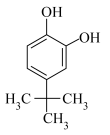 )的沸点
)的沸点______ 2—叔丁基对苯二酚( )(填“低于”、“高于”或“等于”),原因是
)(填“低于”、“高于”或“等于”),原因是______ 。
(3)停止加热后,向反应器中加入盐酸和乙醇混合溶液的目的是______ 。
(4)实验过程中会产生一种有毒气体,尾气吸收装置中应用______ (填试剂名称)。
(5)本实验的产率为______ (计算结果精确到0.1%)。
I.向500mL三颈烧瓶(加热、搅拌、夹持等装置省略)中加入60.00g对叔丁基苯酚、25.60gS8、8g氢氧化钠和40mL二苯醚。
II.在N2气氛下磁力加热搅拌,逐步升温到230℃,温度保持在230℃反应4小时。
III.停止加热并冷却至100℃以下后,加入40mL6mol/L的盐酸和400mL乙醇的混合溶液,搅拌,抽滤,用乙醇和蒸馏水交替洗涤固体,得到粗产物。
IV.将粗产物在氯仿/乙醇中重结晶,得到30.24g纯化的对叔丁基硫代杯[4]芳烃。
回答下列问题:
(1)仪器A的名称是
(2)对叔丁基邻苯二酚(
 )的沸点
)的沸点 )(填“低于”、“高于”或“等于”),原因是
)(填“低于”、“高于”或“等于”),原因是(3)停止加热后,向反应器中加入盐酸和乙醇混合溶液的目的是
(4)实验过程中会产生一种有毒气体,尾气吸收装置中应用
(5)本实验的产率为
您最近一年使用:0次
名校
解题方法
5 . 反应I可用于在国际空间站中处理二氧化碳,同时伴有副反应II发生。
主反应I.

副反应Ⅱ.

(1)几种化学键的键能如表所示:
则 =
=______ kJ·mol-1。
(2)为了进一步研究上述两个反应,某小组在三个容积相同的刚性容器中,分别充入1molCO2和4molH2,在三种不同实验条件(见表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
______ T2(填“>”“<”或“=”),曲线III对应的实验编号是_____ 。
②若在曲线II的条件下,10min达到平衡时生成1.4molH2O,则10min内反应的平均速率v(H2O)=_____ kPa·min-1,反应II的平衡常数Kp=_____ 。
(3)一定条件下反应1中存在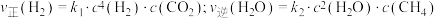 相应的速率与温度关系如图所示。反应I的平衡常数K=
相应的速率与温度关系如图所示。反应I的平衡常数K=______ (用含k1,k2的代数式表示);图中A、B、C、D四个点中,能表示反应已达到平衡状态的是______ 。
主反应I.


副反应Ⅱ.


(1)几种化学键的键能如表所示:
化学键 | C—H | H—H | H—O | C=O |
键能/kJ·mol-1 | 413 | 436 | 463 | 745 |
 =
=(2)为了进一步研究上述两个反应,某小组在三个容积相同的刚性容器中,分别充入1molCO2和4molH2,在三种不同实验条件(见表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
实验编号 | a | b | c |
温度/K | T1 | T2 | T2 |
催化剂的比表面积/(m²/g) | 80 | 80 | 40 |

②若在曲线II的条件下,10min达到平衡时生成1.4molH2O,则10min内反应的平均速率v(H2O)=
(3)一定条件下反应1中存在
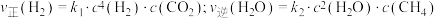 相应的速率与温度关系如图所示。反应I的平衡常数K=
相应的速率与温度关系如图所示。反应I的平衡常数K=
您最近一年使用:0次
解题方法
6 . 芳基亚胺酯是重要的有机反应中间体,受热易分解,可由腈在酸催化下与醇发生Pinner反应制备,原理如下图所示。
Ⅱ.向容器中持续通入HCl气体4小时,密封容器。
Ⅲ.室温下在HCl氛围中继续搅拌反应液24小时,冷却至0℃,抽滤得白色固体,用乙腈洗涤。
Ⅳ.将洗涤后的白色固体加入饱和Na2CO3溶液中,在15℃低温下反应,用有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水硫酸钠,抽滤,蒸去溶剂得产品19.50g。
回答下列问题:
(1)实验室中可用浓盐酸和浓硫酸制备干燥HCl气体,下列仪器中一定需要的为_______ (填仪器名称)。_______ (填标号)。_______ ;实验中选择低温的原因为_______ 。
(4)第Ⅳ步萃取时可选用的有机溶剂为_______(填标号)。
(5)第Ⅳ将洗涤后的白色固体加入饱和Na2CO3溶液中,饱和Na2CO3的作用是_______ 。
(6)抽滤装置如下图所示,其相对于普通过滤的优点是_______ 。
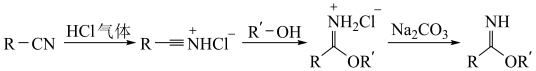
某实验小组以苯甲腈(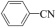 )和三氟乙醇(CF3CH2OH)为原料合成苯甲亚胺三氟乙酯。步骤如下:
)和三氟乙醇(CF3CH2OH)为原料合成苯甲亚胺三氟乙酯。步骤如下:
Ⅱ.向容器中持续通入HCl气体4小时,密封容器。
Ⅲ.室温下在HCl氛围中继续搅拌反应液24小时,冷却至0℃,抽滤得白色固体,用乙腈洗涤。
Ⅳ.将洗涤后的白色固体加入饱和Na2CO3溶液中,在15℃低温下反应,用有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水硫酸钠,抽滤,蒸去溶剂得产品19.50g。
回答下列问题:
(1)实验室中可用浓盐酸和浓硫酸制备干燥HCl气体,下列仪器中一定需要的为

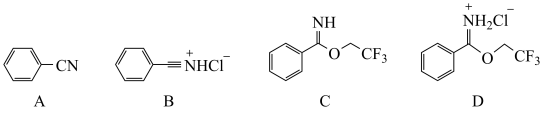
(4)第Ⅳ步萃取时可选用的有机溶剂为_______(填标号)。
| A.甲醇 | B.乙酸 | C.丙酮 | D.乙酸乙酯 |
(5)第Ⅳ将洗涤后的白色固体加入饱和Na2CO3溶液中,饱和Na2CO3的作用是
(6)抽滤装置如下图所示,其相对于普通过滤的优点是
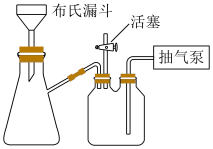
您最近一年使用:0次
7 . 化合物 是合成抗病毒药物普拉那韦的原料,其合成路线如下。
是合成抗病毒药物普拉那韦的原料,其合成路线如下。_______ 。
(2)D的化学名称为_______ 。
(3)E→F的反应类型为_______ 。
(4)J的结构简式为_______ 。
(5)M分子中含有两个六元环,则 →M的反应方程式为
→M的反应方程式为_______ 。
(6)在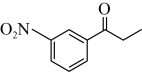 的同分异构体中,满足下列条件的结构有
的同分异构体中,满足下列条件的结构有_______ 种(不考虑立体异构)。
①核磁共振氢谱有5组峰
②遇FeCl3溶液显色
③1mol该物质与银氨溶液反应,最多可生成4molAg
写出其中一种结构简式:_______ 。
 是合成抗病毒药物普拉那韦的原料,其合成路线如下。
是合成抗病毒药物普拉那韦的原料,其合成路线如下。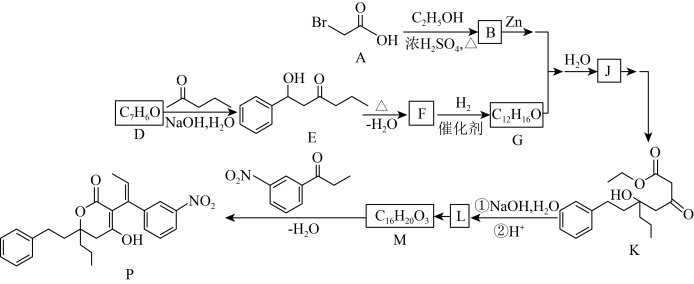
已知: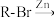
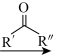

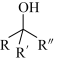
(2)D的化学名称为
(3)E→F的反应类型为
(4)J的结构简式为
(5)M分子中含有两个六元环,则
 →M的反应方程式为
→M的反应方程式为(6)在
 的同分异构体中,满足下列条件的结构有
的同分异构体中,满足下列条件的结构有①核磁共振氢谱有5组峰
②遇FeCl3溶液显色
③1mol该物质与银氨溶液反应,最多可生成4molAg
写出其中一种结构简式:
您最近一年使用:0次
8 . 黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4.黏土钒矿采用以下工艺流程可制备偏钒酸铵(NH4VO3)。
②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数δ与pH的关系如图所示,
(1)NH4+的VSEPR模型是___________ 形。
(2)“酸浸氧化”时,VO+、VO2+被氧化为VO2+,增大“酸浸氧化”速率的措施是___________ (任写一种)。
(3)“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及___________ 。
(4)“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及___________ 。
(5)①“沉钒”时pH最好约为7且NH4Cl应过量,原因为___________ 。
②温度高于80℃时,沉钒率下降的原因是___________ (任写一种)。
(6)加热偏钒酸铵制备V2O5的化学方程式为___________ 。

| 金属离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 开始沉淀pH | 1.9 | 3.0 | 8.1 | 8.9 |
| 完全沉淀pH | 3.0 | 4.7 | 10.1 | 10.9 |

(1)NH4+的VSEPR模型是
(2)“酸浸氧化”时,VO+、VO2+被氧化为VO2+,增大“酸浸氧化”速率的措施是
(3)“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及
(4)“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及
(5)①“沉钒”时pH最好约为7且NH4Cl应过量,原因为
②温度高于80℃时,沉钒率下降的原因是
(6)加热偏钒酸铵制备V2O5的化学方程式为
您最近一年使用:0次
解题方法
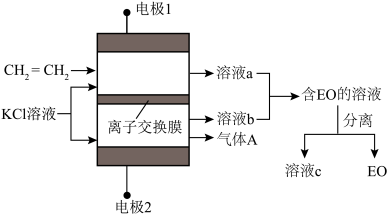
9 . 环氧乙烷( ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如图,一定条件下,反应物按一定流速通过该装置。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如图,一定条件下,反应物按一定流速通过该装置。
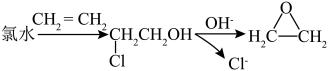
已知:电解效率η(B)= ×100%;
×100%;
下列说法正确的是
 ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如图,一定条件下,反应物按一定流速通过该装置。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如图,一定条件下,反应物按一定流速通过该装置。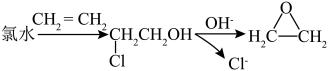

已知:电解效率η(B)=
 ×100%;
×100%;下列说法正确的是
| A.电极1应与电源正极相连,离子交换膜应为阴离子交换膜 |
| B.若η(EO)=100%,则溶液c的溶质为KCl |
| C.不考虑各项损失,理论上生成2g气体A,可得到产品EO88g |
| D.每生成1molEO,理论上电路中转移电子数为NA |
您最近一年使用:0次
10 . 四碘化锡(SnI4)为橙红色晶体,广泛应用于黑磷烯材料的制备。实验室常以锡粒为原料通过反应 制备SnI4,实验装置如图(加热及夹持装置略,物质部分性质如下表)。
制备SnI4,实验装置如图(加热及夹持装置略,物质部分性质如下表)。
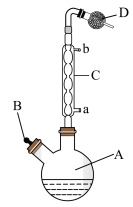
(1)SnI4粗品的制备:将10.0g锡粒、25.4g碘单质、35.00mLCS2加入装置A中,组装好装置后,快速打开冷却水,加热,控制反应温度400℃左右,直至反应完成。停止加热,趁热过滤除去固体杂质,用CS2多次洗涤装置A及残渣,合并滤液和洗涤液,浓缩溶液,经一系列操作得到SnI4粗品。
①装置C的名称为___________ ,装置C的作用是___________ 。
②装置D中盛放的药品可以是___________ (填标号)。
a.无水硫酸铜b.碱石灰c.无水氯化钙
③检查装置气密性后向A中加入少量无水乙醚,加热A至乙醚完全挥发,其目的是___________ 。
④用CS2多次洗涤装置A及残渣,合并滤液和洗涤液后,“浓缩溶液”所采用的实验操作名称是___________ 。
(2)SnI4质量分数测定:称取10.0g粗品,加入足量的水,使粗品充分水解。将上层清液全部定容于250mL容量瓶中,移取25.00mL于锥形瓶中,加入少量CCl4和几滴KSCN溶液,用0.20mol·L−1的FeCl3标准溶液滴定至终点时,消耗FeCl3标准溶液28.80mL。(已知:2Fe3++2I- 2Fe2++I2)
2Fe2++I2)
①写出SnI4水解生成SnO2·xH2O的化学方程式___________ 。
②根据实验数据计算,样品中SnI4的质量分数为___________ (保留三位有效数字)
 制备SnI4,实验装置如图(加热及夹持装置略,物质部分性质如下表)。
制备SnI4,实验装置如图(加热及夹持装置略,物质部分性质如下表)。| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 性质 |
| SnI4 | 145.8 | 364.5 | 易溶于乙醚、可溶于CS2、CCl4等非极性有机溶剂 | 在空气中易吸潮而水解 |
| CS2 | −112.0 | 46.2 | 难溶于水 | 有毒,易挥发 |

(1)SnI4粗品的制备:将10.0g锡粒、25.4g碘单质、35.00mLCS2加入装置A中,组装好装置后,快速打开冷却水,加热,控制反应温度400℃左右,直至反应完成。停止加热,趁热过滤除去固体杂质,用CS2多次洗涤装置A及残渣,合并滤液和洗涤液,浓缩溶液,经一系列操作得到SnI4粗品。
①装置C的名称为
②装置D中盛放的药品可以是
a.无水硫酸铜b.碱石灰c.无水氯化钙
③检查装置气密性后向A中加入少量无水乙醚,加热A至乙醚完全挥发,其目的是
④用CS2多次洗涤装置A及残渣,合并滤液和洗涤液后,“浓缩溶液”所采用的实验操作名称是
(2)SnI4质量分数测定:称取10.0g粗品,加入足量的水,使粗品充分水解。将上层清液全部定容于250mL容量瓶中,移取25.00mL于锥形瓶中,加入少量CCl4和几滴KSCN溶液,用0.20mol·L−1的FeCl3标准溶液滴定至终点时,消耗FeCl3标准溶液28.80mL。(已知:2Fe3++2I-
 2Fe2++I2)
2Fe2++I2)①写出SnI4水解生成SnO2·xH2O的化学方程式
②根据实验数据计算,样品中SnI4的质量分数为
您最近一年使用:0次



