名校
解题方法
1 . 电子工业中,可用 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
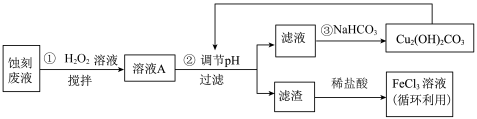
回答下列问题:
(1)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填写化学式)
(2) 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是___________ 。
(3)步骤①中加入 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)___________ 。
(4)已知:生成氢氧化物沉淀的 如下表。
如下表。
根据表中数据推测调节 的范围是
的范围是___________ 。
(5)上述流程路线中,除 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是___________ 。
(6)在 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为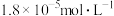 时溶液的
时溶液的 为
为___________ 。(已知 时
时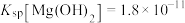 )。
)。
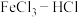 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
回答下列问题:
(1)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)
 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是(3)步骤①中加入
 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)(4)已知:生成氢氧化物沉淀的
 如下表。
如下表。| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
 的范围是
的范围是(5)上述流程路线中,除
 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是(6)在
 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为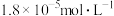 时溶液的
时溶液的 为
为 时
时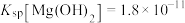 )。
)。
您最近一年使用:0次
2 .  和
和 在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
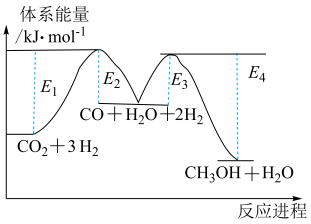
(1)25℃、100kPa二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示(25℃、100kPa)。总反应的焓变
___________  (用
(用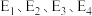 表示),写出决速步骤反应的热化学方程式
表示),写出决速步骤反应的热化学方程式___________ 。
(2)
合成总反应在起始物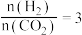 时发生反应
时发生反应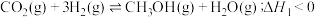 ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
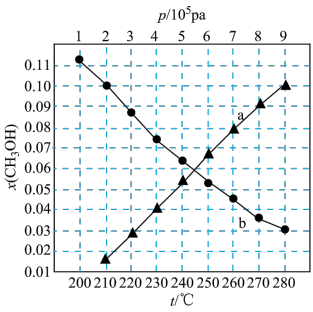
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在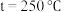 条件下的
条件下的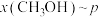 、在
、在 条件下的
条件下的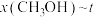 (温度)如图所示。图中对应等温过程的曲线是
(温度)如图所示。图中对应等温过程的曲线是___________ ,原因是___________ 。
(3)
在刚性容器压强为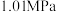 时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应:
时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应: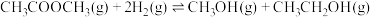 。一定温度下,以
。一定温度下,以
 的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
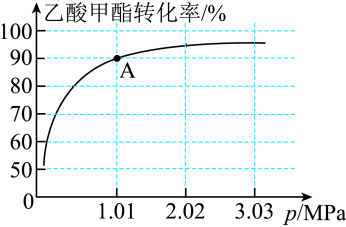
①A点时,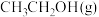 的体积分数为
的体积分数为___________ %(保留一位小数)。
②此温度下,该反应的化学平衡常数
___________  (Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 和
和 在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:(1)25℃、100kPa二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示(25℃、100kPa)。总反应的焓变

 (用
(用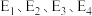 表示),写出决速步骤反应的热化学方程式
表示),写出决速步骤反应的热化学方程式(2)

合成总反应在起始物
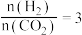 时发生反应
时发生反应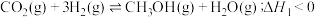 ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在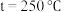 条件下的
条件下的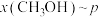 、在
、在 条件下的
条件下的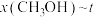 (温度)如图所示。图中对应等温过程的曲线是
(温度)如图所示。图中对应等温过程的曲线是(3)

在刚性容器压强为
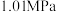 时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应:
时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应: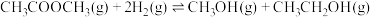 。一定温度下,以
。一定温度下,以
 的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
①A点时,
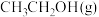 的体积分数为
的体积分数为②此温度下,该反应的化学平衡常数

 (Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
您最近一年使用:0次
名校
解题方法
3 . 电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为___________ 。
②下列方法中,可以使醋酸稀溶液中 电离程度减小的是
电离程度减小的是___________ (填字母序号)。
a.滴加浓盐酸 b.微热溶液 c.加水稀释 d.加入醋酸钠晶体 e.加入冰醋酸
(2)用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
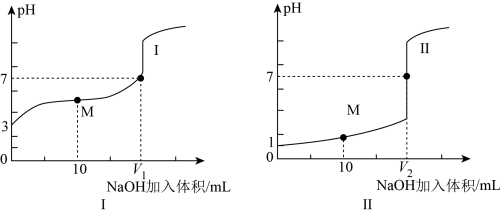
①滴定开始前,三种溶液中由水电离出的 最大的是
最大的是___________ 。
②已知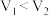 ,则滴定醋酸的曲线是
,则滴定醋酸的曲线是___________ (填“I”或“II”)。
(3)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用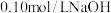 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的标志是___________ 。
②根据上述数据,可计算出该盐酸的浓度约为___________  (保留两位有效数字)。
(保留两位有效数字)。
③在上述实验中,下列操作会造成测定结果偏高的有___________ 。(填字母序号)。
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸稀溶液中
 电离程度减小的是
电离程度减小的是a.滴加浓盐酸 b.微热溶液 c.加水稀释 d.加入醋酸钠晶体 e.加入冰醋酸
(2)用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
①滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是②已知
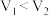 ,则滴定醋酸的曲线是
,则滴定醋酸的曲线是(3)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取
 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用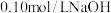 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mo1·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 25.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
 (保留两位有效数字)。
(保留两位有效数字)。③在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
名校
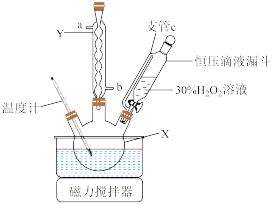
4 . 一种具有漂白、去污、杀菌、除异味等多种功能的氧系清洁产品深受人们喜爱,该氧系清洁产品的主要成分为过碳酸钠 。某兴趣小组设计实验,以工业
。某兴趣小组设计实验,以工业 (含杂质
(含杂质 )为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。
)为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。
实验步骤:
I.制备过碳酸钠。
已知:① ;
;
② 时,
时, 开始分解。
开始分解。
i.将工业碳酸钠精制除杂。
ii.向仪器X中依次加入水、 的乙醇、无水碳酸钠、鳌合剂,控制温度在
的乙醇、无水碳酸钠、鳌合剂,控制温度在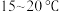 ,边搅拌边向仪器
,边搅拌边向仪器 中滴加
中滴加 的
的 溶液。
溶液。
iii.加入复合稳定剂(氯化镁和硅酸钠),搅拌一段时间。
iv.真空抽滤、干燥得纯产品,冷却称重。
(1)仪器X的名称为___________ 。
(2)支管c的作用为___________ 。仪器Y中冷凝水的出口为___________ (填“a”或“b”)。
(3)实验过程中向仪器X中滴加 的
的 溶液时不能过快,其原因是
溶液时不能过快,其原因是___________ 。
(4)加入的复合稳定剂不能过多,可能的原因是___________ (写一条)。
Ⅱ.活性氧含量测定。
i.称量 于
于 锥形瓶中,用
锥形瓶中,用 完全溶解。
完全溶解。
ii.取一支洁净的___________滴定管,润洗,装液并排气泡。
iii.用 溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗
溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗 溶液的体积)。
溶液的体积)。
iv.平行3次实验,消耗 溶液的平均体积为
溶液的平均体积为 。
。
(5)将ii和iii空白处补充完整。
ii:___________ ;
iii:___________ 。
(6)上述实验测得该样品的活性氧含量为___________ (活性氧含量即杀菌消毒时 分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量
分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量___________ (填“偏高”、“偏低”或“无影响”)。
 。某兴趣小组设计实验,以工业
。某兴趣小组设计实验,以工业 (含杂质
(含杂质 )为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。
)为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。实验步骤:
I.制备过碳酸钠。
已知:①
 ;
;②
 时,
时, 开始分解。
开始分解。i.将工业碳酸钠精制除杂。
ii.向仪器X中依次加入水、
 的乙醇、无水碳酸钠、鳌合剂,控制温度在
的乙醇、无水碳酸钠、鳌合剂,控制温度在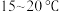 ,边搅拌边向仪器
,边搅拌边向仪器 中滴加
中滴加 的
的 溶液。
溶液。iii.加入复合稳定剂(氯化镁和硅酸钠),搅拌一段时间。

iv.真空抽滤、干燥得纯产品,冷却称重。
(1)仪器X的名称为
(2)支管c的作用为
(3)实验过程中向仪器X中滴加
 的
的 溶液时不能过快,其原因是
溶液时不能过快,其原因是(4)加入的复合稳定剂不能过多,可能的原因是
Ⅱ.活性氧含量测定。
i.称量
 于
于 锥形瓶中,用
锥形瓶中,用 完全溶解。
完全溶解。ii.取一支洁净的___________滴定管,润洗,装液并排气泡。
iii.用
 溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗
溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗 溶液的体积)。
溶液的体积)。iv.平行3次实验,消耗
 溶液的平均体积为
溶液的平均体积为 。
。(5)将ii和iii空白处补充完整。
ii:
iii:
(6)上述实验测得该样品的活性氧含量为
 分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量
分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量
您最近一年使用:0次
5 . 已知: 为短周期主族元素。常温下,它们的原子半径、原子序数、pH[元素最高价氧化物对应水化物的溶液(浓度均为
为短周期主族元素。常温下,它们的原子半径、原子序数、pH[元素最高价氧化物对应水化物的溶液(浓度均为 )的pH]的关系如图所示。下列说法正确的是
)的pH]的关系如图所示。下列说法正确的是
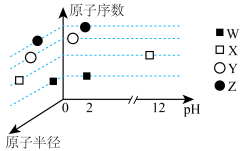
 为短周期主族元素。常温下,它们的原子半径、原子序数、pH[元素最高价氧化物对应水化物的溶液(浓度均为
为短周期主族元素。常温下,它们的原子半径、原子序数、pH[元素最高价氧化物对应水化物的溶液(浓度均为 )的pH]的关系如图所示。下列说法正确的是
)的pH]的关系如图所示。下列说法正确的是
A. 晶体的晶胞中 晶体的晶胞中 原子的配位数为6 原子的配位数为6 |
B.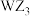 分子的中心原子为 分子的中心原子为 杂化 杂化 |
C.第一电离能: |
D.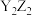 分子为含有极性共价键的平面结构分子 分子为含有极性共价键的平面结构分子 |
您最近一年使用:0次
名校
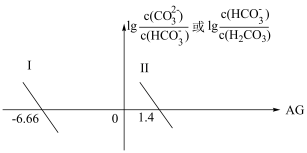
6 . 室温下,向一定浓度的Na2CO3溶液中滴加盐酸,溶液中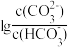 、
、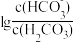 随溶液酸度AG[AG=
随溶液酸度AG[AG= ]的变化如图所示。下列说法正确的是
]的变化如图所示。下列说法正确的是
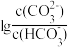 、
、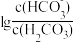 随溶液酸度AG[AG=
随溶液酸度AG[AG= ]的变化如图所示。下列说法正确的是
]的变化如图所示。下列说法正确的是
A.Ⅱ表示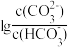 随AG的变化 随AG的变化 |
B.AG=0时,溶液中c(Na+)=2c( )+c( )+c( ) ) |
C.随着AG的增大, 的值保持不变 的值保持不变 |
| D.H2CO3的Ka1=10-10.33 |
您最近一年使用:0次
2023-11-14更新
|
864次组卷
|
5卷引用:吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷
吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷河北省石家庄精英中学2023-2024学年高三上学期第二次调研(期中)考试化学试题(已下线)选择题21-23(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)选择题11-14
名校
解题方法
7 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Ni、Fe 等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 。
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。___________ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为___________ 。
③立方相氮化硼晶胞边长为apm, NA代表阿伏加德罗常数的值,则该晶体的密度为___________ g·cm-3。
(4)FeSO4·7H2O的结构如图所示,FeSO4·7H2O中∠1、∠2、∠3由大到小的顺序是___________ 。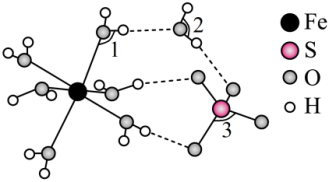
(5)镍的某种氧化物常用作催化剂,其晶胞有如图结构特征:镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。
①从该晶胞中能分割出来的结构图有___________ (填标号)。___________ 个,该距离为___________ pm(用含ρ和NA的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A. B.
B.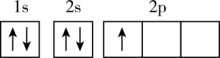 C.
C.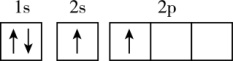 D.
D.
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
③立方相氮化硼晶胞边长为apm, NA代表阿伏加德罗常数的值,则该晶体的密度为
(4)FeSO4·7H2O的结构如图所示,FeSO4·7H2O中∠1、∠2、∠3由大到小的顺序是

(5)镍的某种氧化物常用作催化剂,其晶胞有如图结构特征:镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。
①从该晶胞中能分割出来的结构图有
a.  b.
b.  c.
c. d.
d. 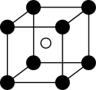 e.
e.
您最近一年使用:0次
2023-07-21更新
|
348次组卷
|
3卷引用:吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
8 . 不同价态含硫物质的转化如图所示,某些反应条件及产物已经省略,下列说法正确的是

| A.图中B能一步转化成D,A也能一步转化成D |
| B.图中A、C反应能生成B,反应中C表现还原性 |
| C.工业上制备E,常用H2O吸收D,D转化为E的反应不是氧化还原反应 |
| D.图中A一在定条件下与E的浓溶液反应,可能生成B,也可能生成C |
您最近一年使用:0次
2023-06-03更新
|
621次组卷
|
3卷引用:吉林省四平市第一高级中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
9 . 某补铁剂的主要成分是硫酸亚铁( ),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的 溶液(pH略大于3)进行下列实验。
溶液(pH略大于3)进行下列实验。
资料:维生素C( )又称抗坏血酸,将溶于水,其溶液呈酸性
)又称抗坏血酸,将溶于水,其溶液呈酸性
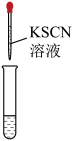
Ⅰ.检验铁元素的价态
(1)ⅰ中观察到_____________ ,说明溶液中存在 。由ⅱ中溶液近乎无色可以推测维生素C与
。由ⅱ中溶液近乎无色可以推测维生素C与 发生了反应:
发生了反应: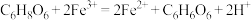 ,该反应的还原剂是
,该反应的还原剂是_____________ 。
(2)ⅰ中与 溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为
溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为__________ 。
(3)经分析ⅱ中检验方案不严谨,应考虑pH对反应的影响,依据是_______________ 。
Ⅱ.探究pH对ⅱ中反应的影响
补充实验如下,继续探究pH对ⅱ中反应的影响。
(4)试剂a为_____________ ,由实验现象可得结论:pH对 与SCN的显色反应有影响。
与SCN的显色反应有影响。
(5)分析实验ⅰ~ⅲ,下列说法合理的是_____________ (填序号)。
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中 被氧化
被氧化
c.使用KSCN检验 时,宜先将溶液酸化
时,宜先将溶液酸化
 ),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的 溶液(pH略大于3)进行下列实验。
溶液(pH略大于3)进行下列实验。资料:维生素C(
 )又称抗坏血酸,将溶于水,其溶液呈酸性
)又称抗坏血酸,将溶于水,其溶液呈酸性Ⅰ.检验铁元素的价态
| 实验序号 | 试管中的试剂 | 实验操作及现象 |
ⅰ | 2mL放置后的 | 滴加5滴KSCN溶液后,溶液变为浅红色 | |
ⅱ | 2mL放置后的 溶液,0.1g维生素C 溶液,0.1g维生素C | 维生素C溶解,溶液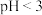 ,滴加5滴KSCN溶液后,溶液近乎无色 ,滴加5滴KSCN溶液后,溶液近乎无色 |
 。由ⅱ中溶液近乎无色可以推测维生素C与
。由ⅱ中溶液近乎无色可以推测维生素C与 发生了反应:
发生了反应: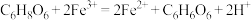 ,该反应的还原剂是
,该反应的还原剂是(2)ⅰ中与
 溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为
溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为(3)经分析ⅱ中检验方案不严谨,应考虑pH对反应的影响,依据是
Ⅱ.探究pH对ⅱ中反应的影响
补充实验如下,继续探究pH对ⅱ中反应的影响。
实验序号 | 试剂 | 实验操作及现象 |
ⅲ |
| 滴加5滴KSCN溶液后,溶液变为浅红色,浅红色比ⅰ中加深 |
 与SCN的显色反应有影响。
与SCN的显色反应有影响。(5)分析实验ⅰ~ⅲ,下列说法合理的是
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中
 被氧化
被氧化c.使用KSCN检验
 时,宜先将溶液酸化
时,宜先将溶液酸化
您最近一年使用:0次
2023-04-27更新
|
307次组卷
|
2卷引用:吉林省四平市第一高级中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
10 . 冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与 形成的螯合离子结构如图所示。下列说法错误的是
形成的螯合离子结构如图所示。下列说法错误的是
 形成的螯合离子结构如图所示。下列说法错误的是
形成的螯合离子结构如图所示。下列说法错误的是
| A.该鳌合离子中碳与氧原子具有相同的杂化类型 |
| B.该螯合离子中所有非氢原子可以位于同一平面 |
| C.该螯合离子中极性键与非极性键的个数比为7∶1 |
| D.该螯合离子形成的晶体类型为离子晶体 |
您最近一年使用:0次
2023-04-21更新
|
254次组卷
|
2卷引用:吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题