名校
解题方法
1 . 物质之间的转化关系如图,部分生成物省略。A是由四种元素组成的化合物。C、D是由元素X、Y、Z中两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用。
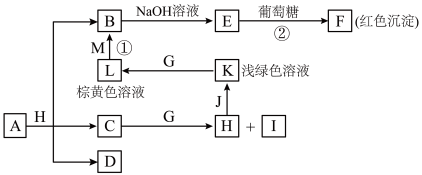
请回答下列问题:
(1)C的电子式____ 。
(2)写出反应①的离子反应方程式____ ,反应②中体现葡萄糖的____ 性。
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。____
(4)写出A的化学式____ 。
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式____ 。
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式____ ,N的一种同素异形体的名称为____ 。

请回答下列问题:
(1)C的电子式
(2)写出反应①的离子反应方程式
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。
(4)写出A的化学式
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式
您最近一年使用:0次
2022-09-20更新
|
351次组卷
|
5卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
名校
解题方法
2 . 下图是一种综合处理的工艺流程图。下列说法不正确的是


| A.溶液酸性:B>C |
| B.向溶液B中滴加KSCN溶液,溶液一定变为红色 |
| C.溶液C的主要成分为H2SO4和Fe2(SO4)3 |
D.溶液A转化为溶液B的离子方程式: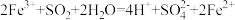 |
您最近一年使用:0次
2022-04-15更新
|
750次组卷
|
6卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
宁夏固原市第一中学2023届高三上学期第二次月考化学试题河南省洛阳市2021-2022学年高一下学期期中考试化学试题(已下线)第07练 铁及其化合物-2023年高考化学一轮复习小题多维练(全国通用)河南省顶级名校2023届高三上学期10月月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高三上学期期中考试化学试题江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷
名校
3 . 硫化钼(MoS2,其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
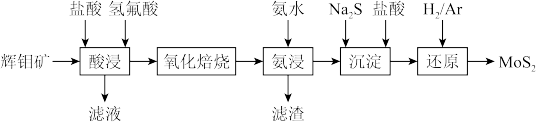
回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为____ 。
(2)在“氧化焙烧”过程中主要是O2将MoS2转化为MoO3、SO2,在该反应中氧化剂与还原剂的物质的量之比为____ 。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是___ ,“氨浸”后生成(NH4)2MoO4反应的化学方程式为____ 。
(4)钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备,在制备过程中需加入Ba(OH)2固体除去SO 。[忽略溶液体积变化。已知:259℃,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。
。[忽略溶液体积变化。已知:259℃,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。
①若向等浓度的Na2MoO4和Na2SO4的混合液中逐滴加入Ba(OH)2溶液,先析出的沉淀是____ 。
②若现溶液中c(MoO )=0.4mol•L-1,c(SO
)=0.4mol•L-1,c(SO )=0.05mol•L-1,常温下,当BaMoO4即将开始沉淀时,SO
)=0.05mol•L-1,常温下,当BaMoO4即将开始沉淀时,SO 的去除率为
的去除率为____ 。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则该杂质中Mo4+所占Mo元素的物质的量分数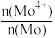 为
为___ 。

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为
(2)在“氧化焙烧”过程中主要是O2将MoS2转化为MoO3、SO2,在该反应中氧化剂与还原剂的物质的量之比为
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是
(4)钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备,在制备过程中需加入Ba(OH)2固体除去SO
 。[忽略溶液体积变化。已知:259℃,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。
。[忽略溶液体积变化。已知:259℃,Ksp(BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。①若向等浓度的Na2MoO4和Na2SO4的混合液中逐滴加入Ba(OH)2溶液,先析出的沉淀是
②若现溶液中c(MoO
 )=0.4mol•L-1,c(SO
)=0.4mol•L-1,c(SO )=0.05mol•L-1,常温下,当BaMoO4即将开始沉淀时,SO
)=0.05mol•L-1,常温下,当BaMoO4即将开始沉淀时,SO 的去除率为
的去除率为(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则该杂质中Mo4+所占Mo元素的物质的量分数
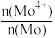 为
为
您最近一年使用:0次
4 . 随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打);用于填充汽车安全气囊的叠氮化钠(NaN3)。某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):_______ ,然后加入试剂。仪器a的名称是_______ :装置E中的试剂是_______ (填标号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_______ (填操作名称)、过滤、洗涤、干燥,得到产品。
(3)装置B和D的作用是_______ 。
(4)Na2S2O3在空气中易被氧化而变质,请设计实验检验Na2S2O3晶体中是否含有Na2SO4_______ 。
II.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。
已知:2NaNH2+N2O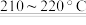 NaN3+NaOH+NH3
NaN3+NaOH+NH3_______ 。
(2)实验中使用油浴加热的优点是_______ 。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_______ 。
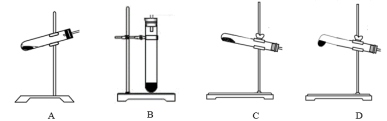
(4)N2O可由NH4NO3(熔点为169.6℃)在240℃下分解制得,应选择的气体发生装置是_______ 。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
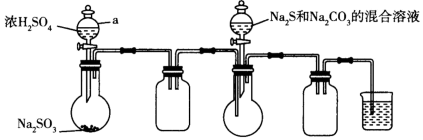
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经
(3)装置B和D的作用是
(4)Na2S2O3在空气中易被氧化而变质,请设计实验检验Na2S2O3晶体中是否含有Na2SO4
II.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。
已知:2NaNH2+N2O
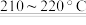 NaN3+NaOH+NH3
NaN3+NaOH+NH3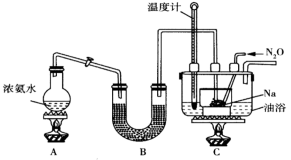
(2)实验中使用油浴加热的优点是
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为
(4)N2O可由NH4NO3(熔点为169.6℃)在240℃下分解制得,应选择的气体发生装置是
您最近一年使用:0次
2021-03-22更新
|
1044次组卷
|
6卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
宁夏固原市第一中学2023届高三上学期第二次月考化学试题云南省红河哈尼族彝族自治州2021届高三第二次统一测试理综化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)四川省雅安中学2022-2023学年高一下学期3月月考化学试题江西省南昌市第十九中学2021-2022学年高一下学期第一次月考化学试卷 四川省江油市太白中学2023-2024学年高一下学期4月月考化学试题
名校
5 . 某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为_______ ;
(2)乙同学认为有Cu(OH)2生成的理论依据是_______ 用离子方程式表示);
(3)两同学利用下图所示装置进行测定:
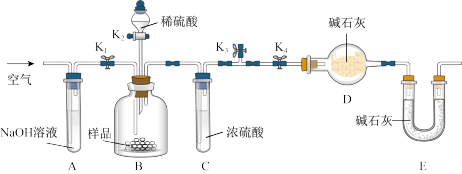
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_______ 、洗涤、干燥;
②装置E中碱石灰的作用是_______
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是_______ (填选项序号,下同);若未进行步骤_______ ,将使测量结果偏低;
④若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuCO3的质量分数为_______ 。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)乙同学认为有Cu(OH)2生成的理论依据是
(3)两同学利用下图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为
②装置E中碱石灰的作用是
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是
④若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuCO3的质量分数为
您最近一年使用:0次
名校
解题方法
6 . SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4和S的燃烧热分别为akJ/mol和bkJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态水。反应的热化学方程式为_______ (ΔH用含a、b的代数式表示)
(2)用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示:

①分析可知X为_______ (写化学式),0~t1时间段的反应温度为_______ ,0~t1时间段用SO2表示的化学反应速率为_______ ;
②总反应的化学方程式为_______ ;
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)⇌S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图丙所示。
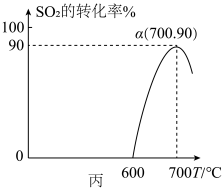
①该反应的ΔH_______ 0(填“>”或“<”);
②700℃的平衡常数为_______ ;
(4)工业上可用Na2SO3溶液吸收SO2,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为_______ 。(已知:H2SO3的电离常数 )。
)。
(1)已知CH4和S的燃烧热分别为akJ/mol和bkJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态水。反应的热化学方程式为
(2)用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示:

①分析可知X为
②总反应的化学方程式为
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)⇌S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图丙所示。

①该反应的ΔH
②700℃的平衡常数为
(4)工业上可用Na2SO3溶液吸收SO2,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为
 )。
)。
您最近一年使用:0次
名校
7 . 高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下:
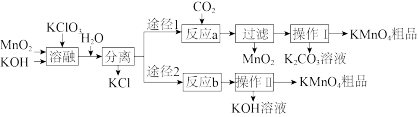
(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择哪一种仪器_______
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:_______
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在_______ (填性质)上的差异,采用浓缩结晶、趁热过滤得到KMnO4。趁热过滤的原因是_______
(4)KMnO4常用在实验室制取氧气,其产物常做电池材料,其中碱性电池锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。电池工作时,锌做_______ 极,电池正极的电极反应式为_______ 外电路中每通过0.2mol电子,锌的质量理论上减小_______ g
(5)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的_______ (填标号)
a.双氧水 b.84消液(NaClO溶液) c.75%酒精

(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择哪一种仪器
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在
(4)KMnO4常用在实验室制取氧气,其产物常做电池材料,其中碱性电池锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。电池工作时,锌做
(5)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的
a.双氧水 b.84消液(NaClO溶液) c.75%酒精
您最近一年使用:0次
2021-03-19更新
|
287次组卷
|
2卷引用:宁夏固原市第一中学2020-2021学年高三下学期第一次模拟考试理综化学试题
解题方法
8 . 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(1)写出H2O分子的电子式:___ 。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是________ 。
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)写出铜原子价电子层的电子排布式:___ ,与铜同一周期副族元素的基态原子中最外层电子数与铜原子相同的元素有___ (填元素符号)。
(4)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有___ 。
(5)实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4•H2O晶体。实验中所加C2H5OH的作用是___ 。
(1)写出H2O分子的电子式:
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)写出铜原子价电子层的电子排布式:
(4)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有
(5)实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4•H2O晶体。实验中所加C2H5OH的作用是
您最近一年使用:0次
名校
9 . 下列离子方程式正确的是
A.向Na2SiO3溶液中通入过量CO2气体:Na2SiO3+2CO2+2H2O==H2SiO3↓+2 +2Na+ +2Na+ |
B.酸性介质中KMnO4氧化H2O2:2 +5H2O2+6H+==2Mn2++5O2↑+8H2O +5H2O2+6H+==2Mn2++5O2↑+8H2O |
C.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3==2 +3Cl−+4H++H2O +3Cl−+4H++H2O |
D.用热的NaOH溶液溶解S:3S+4OH- 2S2-+SO2↑+2H2O 2S2-+SO2↑+2H2O |
您最近一年使用:0次
名校
解题方法
10 . 2020年2月19日下午,国家卫生健康委办公厅、国家中医药管理局办公室联合发出《关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知》。此次诊疗方案抗病毒治疗中增加了磷酸氯喹和阿比多尔两个药物。阿比朵尔中间体I的合成路线如图:
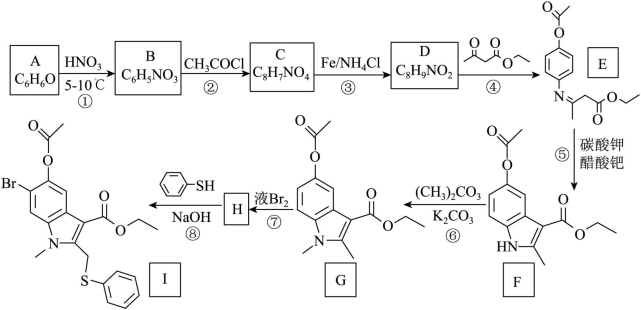
(1)A的化学名称是___ 。
(2)C的结构简式为___ 。
(3)D中官能团名称是___ 。
(4)⑥的反应类型是___ 。
(5)⑦的化学方程式为___ 。
(6)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。含苯环的氨基酸X是D的同分异构体,写出X的结构简式,用星号(*)标出手性碳原子:___ 。
(7)已知:①当苯环有RCOO-、烃基时,新导入的基团进入原有基团的邻位或对位;原有基团为-COOH时,新导入的基团进入原有基团的邻位。②苯酚、苯胺(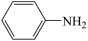 )易氧化。设计以
)易氧化。设计以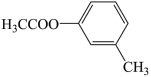 为原料制备
为原料制备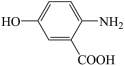 的合成路线
的合成路线___ (无机试剂任用)。

(1)A的化学名称是
(2)C的结构简式为
(3)D中官能团名称是
(4)⑥的反应类型是
(5)⑦的化学方程式为
(6)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。含苯环的氨基酸X是D的同分异构体,写出X的结构简式,用星号(*)标出手性碳原子:
(7)已知:①当苯环有RCOO-、烃基时,新导入的基团进入原有基团的邻位或对位;原有基团为-COOH时,新导入的基团进入原有基团的邻位。②苯酚、苯胺(
 )易氧化。设计以
)易氧化。设计以 为原料制备
为原料制备 的合成路线
的合成路线
您最近一年使用:0次
2020-03-28更新
|
303次组卷
|
2卷引用:宁夏固原市第一中学2020-2021学年高三下学期第一次模拟考试理综化学试题



