名校
解题方法
1 . 随着小型电子设备以及新能源汽车产业的蓬勃发展,退役锂离子电池数量逐年递增,废旧锂离子电池的回收成为目前新能源产业重要的发展方向,科研人员通过对大量废旧钴酸锂( )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
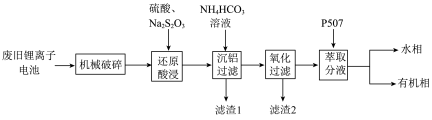
表1 粉料金属成分质量分数%
表2 部分阳离子以氢氧化物形式沉淀时溶液的
已知:Co(III)有较强氧化性, 有较强还原性。
有较强还原性。
(1)机械破碎的目的是_______
(2)还原酸浸的主要反应中 和
和 的物质的量之比为
的物质的量之比为_______
(3)沉铝操作中,加入 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分_______ 、_______ 。
(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:① 氧化成
氧化成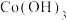 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②_______
(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为_______ 左右。

(6)该工艺中,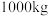 废料生产得到
废料生产得到 的质量为
的质量为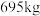 ,则该工艺的产率为
,则该工艺的产率为_______ (保留2位有效数字)。
 )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
表1 粉料金属成分质量分数%
| Co | Li | Al | Cu | Fe | Mn | Ni |
| 23.6 | 3.4 | 3.2 | 0.84 | 2.8 | 1.1 | 0.34 |

| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 | 4.7 |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 | 6.7 |
 有较强还原性。
有较强还原性。(1)机械破碎的目的是
(2)还原酸浸的主要反应中
 和
和 的物质的量之比为
的物质的量之比为(3)沉铝操作中,加入
 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的
 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式 氧化成
氧化成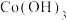 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相
 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为
(6)该工艺中,
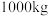 废料生产得到
废料生产得到 的质量为
的质量为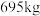 ,则该工艺的产率为
,则该工艺的产率为
您最近一年使用:0次
2023-12-05更新
|
869次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷
2 . 阿佐塞米(化合物Ⅰ)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。Ⅰ的一种合成路线如下(部分试剂和条件略去)。
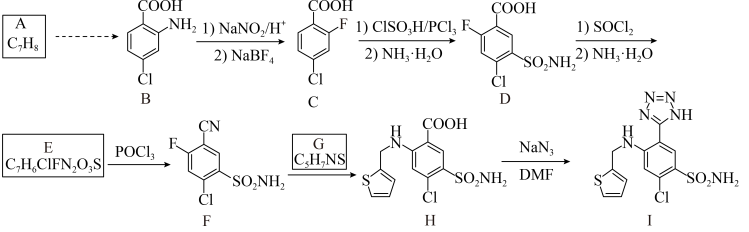
已知:①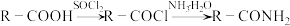
②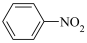
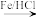
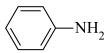
回答下列问题:
(1)C中含氧官能团名称是___________ 。
(2)下列说法正确的是___________。
(3)写出化合物 的结构简式
的结构简式___________ 。
(4)写出D生成 的第一步反应的化学方程式
的第一步反应的化学方程式___________ 。
(5)利用以上合成线路中的相关信息,设计由 到
到 的合成路线
的合成路线___________ (用流程图表示,无机试剂任选)。
(6)写出同时符合下列条件的化合物B的同分异构体的结构简式___________ 。
①分子中含有苯环;
② 谱和
谱和 谱检测表明:分子中共有4种不同化学环境的氢原子,含有
谱检测表明:分子中共有4种不同化学环境的氢原子,含有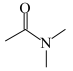 基团,没有
基团,没有 键、
键、 键。
键。

已知:①
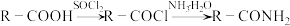
②

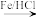

回答下列问题:
(1)C中含氧官能团名称是
(2)下列说法正确的是___________。
A.化合物 中 中 的杂化方式有 的杂化方式有 和 和 |
B.化合物I的分子式为: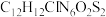 |
C.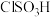 具有酸性,与水作用生成两种酸 具有酸性,与水作用生成两种酸 |
D. 到 到 和 和 到 到 的反应类型都是取代反应 的反应类型都是取代反应 |
(3)写出化合物
 的结构简式
的结构简式(4)写出D生成
 的第一步反应的化学方程式
的第一步反应的化学方程式(5)利用以上合成线路中的相关信息,设计由
 到
到 的合成路线
的合成路线(6)写出同时符合下列条件的化合物B的同分异构体的结构简式
①分子中含有苯环;
②
 谱和
谱和 谱检测表明:分子中共有4种不同化学环境的氢原子,含有
谱检测表明:分子中共有4种不同化学环境的氢原子,含有 基团,没有
基团,没有 键、
键、 键。
键。
您最近一年使用:0次
2023-10-09更新
|
481次组卷
|
5卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷
宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期第四次月考理综试题浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题11 有机推断综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
解题方法
3 . 某溶液中可能含有Na+、NH 、SO
、SO 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液中加入足量的NaOH溶液,有沉淀产生,微热,有气体产生
下列说法正确的是
 、SO
、SO 、SO
、SO 、Cl-、Fe2+、Fe3+、CO
、Cl-、Fe2+、Fe3+、CO 中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:
中的若干种,且各离子浓度相同,为确定其组成现进行如下实验:①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液中加入足量的NaOH溶液,有沉淀产生,微热,有气体产生
下列说法正确的是
A.无法确定原溶液中是否存在SO |
| B.是否存在Na+需要通过焰色反应来确定 |
C.CO 肯定不存在,Fe2+、Fe3+至少有一种 肯定不存在,Fe2+、Fe3+至少有一种 |
D.溶液中存在NH 、SO 、SO 、Cl-、Fe2+ 、Cl-、Fe2+ |
您最近一年使用:0次
2021-02-04更新
|
2513次组卷
|
5卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(尖子班)
19-20高二·浙江·期末
名校
解题方法
4 . 某无色溶液由K+、Fe3+、Ag+、Al3+、 、
、 、
、 、
、 、
、 、
、 中的若干种组成。取适量该溶液进行如下实验:
中的若干种组成。取适量该溶液进行如下实验:
①加入过量HBr,生成无色气体甲和淡黄色沉淀甲;
②取①所得的溶液,加入过量 溶液,生成无色气体乙和白色沉淀乙;
溶液,生成无色气体乙和白色沉淀乙;
③取②所得的溶液,加入过量 ,生成无色气体丙和白色沉淀丙,下列说法正确的是
,生成无色气体丙和白色沉淀丙,下列说法正确的是
 、
、 、
、 、
、 、
、 、
、 中的若干种组成。取适量该溶液进行如下实验:
中的若干种组成。取适量该溶液进行如下实验:①加入过量HBr,生成无色气体甲和淡黄色沉淀甲;
②取①所得的溶液,加入过量
 溶液,生成无色气体乙和白色沉淀乙;
溶液,生成无色气体乙和白色沉淀乙;③取②所得的溶液,加入过量
 ,生成无色气体丙和白色沉淀丙,下列说法正确的是
,生成无色气体丙和白色沉淀丙,下列说法正确的是| A.气体甲的成分有三种可能性 |
B.生成沉淀甲的离子方程式为: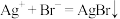 |
C.该溶液中可能存在 和 和 一定不存在Fe3+、 一定不存在Fe3+、 和Al3+ 和Al3+ |
D.为了确定该溶液中是否存在 ,可以直接用盐酸和 ,可以直接用盐酸和 溶液来检验 溶液来检验 |
您最近一年使用:0次
名校
5 . 现有一混合物的水溶液,可能含有以下离子中的几种: 、
、 、
、 、
、 、
、 、
、 、
、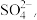 现取三份各100mL溶液进行如下实验: 第一份加入
现取三份各100mL溶液进行如下实验: 第一份加入 溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到
溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到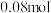 气体;第三份加足量
气体;第三份加足量 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀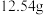 ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为 。你认为以下结论正确的是
。你认为以下结论正确的是
 、
、 、
、 、
、 、
、 、
、 、
、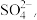 现取三份各100mL溶液进行如下实验: 第一份加入
现取三份各100mL溶液进行如下实验: 第一份加入 溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到
溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到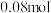 气体;第三份加足量
气体;第三份加足量 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀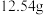 ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为 。你认为以下结论正确的是
。你认为以下结论正确的是A.该混合液中一定含有: 、 、 、 、 、 、 ,可能含 ,可能含 ,且 ,且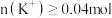 |
B.该混合液中一定含有: 、 、 、 、 ,可能含 ,可能含 、 、 |
C.该混合液中一定含有: 、 、 、 、 ,可能含 ,可能含 、 、 、 、 |
D.该混合液中一定含有: 、 、 ,可能含 ,可能含 、 、 、Cl- 、Cl- |
您最近一年使用:0次
2019-06-19更新
|
1652次组卷
|
7卷引用:宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题
名校
解题方法
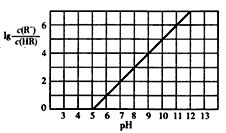
6 . 已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与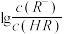 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
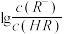 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
| A.由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10 |
| B.当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+) |
| C.pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+) |
| D.pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O) |
您最近一年使用:0次
2018-05-05更新
|
2288次组卷
|
7卷引用:宁夏石嘴山市2022届高三适应性测试理科综合化学试题
名校
7 . 若定义pAg=-lgc(Ag+),pCl=-1gc(C1-),根据不同温度下氯化银饱和溶液的PAg和pCl可绘制图象如右图所示,且已知氯化银的溶解度随温度的升高而增大,根据该图象,下列表述正确的是
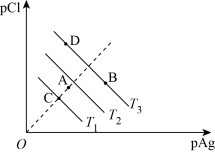

| A.T3>T2>T1 |
| B.将A点的溶液降温,可能得到C点的饱和溶液 |
| C.向B点所表示的溶液中加入氯化钠溶液,溶液可能改变至D点 |
| D.A点表示的是T1温度下的不饱和溶液 |
您最近一年使用:0次
2018-02-23更新
|
1229次组卷
|
6卷引用:宁夏石嘴山第三中学2021-2022学年高二下学期期末考试化学试题
解题方法
8 . 有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:
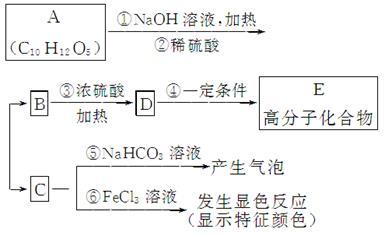
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为

请回答下列问题:
(1)根据系统命名法,B的名称为__________ 。
(2)官能团—X的名称为____________ ,高聚物E的链节为________ 。
(3)A的结构简式为______________ 。
(4)反应⑤的化学方程式为________________________________________________ 。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式_______________ 。
Ⅰ.含有苯环 Ⅱ.能发生银镜反应 Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是_________________ (填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基

已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为

请回答下列问题:
(1)根据系统命名法,B的名称为
(2)官能团—X的名称为
(3)A的结构简式为
(4)反应⑤的化学方程式为
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式
Ⅰ.含有苯环 Ⅱ.能发生银镜反应 Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是
a.含有苯环 b.含有羰基 c.含有酚羟基
您最近一年使用:0次
12-13高三上·北京西城·期末
9 . 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)⇌ 2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a =_____ kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K =_____ ,温度升高后,K值____ (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
① 甲容器中CO的平衡转化率为_____ 。
② 下列说法正确的是_____ (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是_____ (填字母)。
②若用d装置保护铁,X极的电极材料应是_____ (填名称)。

Fe2O3(s)+3CO(g)⇌ 2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a =
(2)冶炼铁反应的平衡常数表达式K =
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2[ | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为
② 下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是
②若用d装置保护铁,X极的电极材料应是

您最近一年使用:0次
2016-12-09更新
|
1475次组卷
|
5卷引用:2017届宁夏石嘴山三中高三上期中化学试卷
2017届宁夏石嘴山三中高三上期中化学试卷(已下线)2012届北京市西城区高三上学期期末考试化学试卷(已下线)2014届甘肃省武威市第六中学高三上学期第五次月考化学试卷2015-2016学年山西省重点中学协作体高二下学期第一次联考化学试卷2015-2016学年湖南省娄底市重点中学高二下学期期末化学试卷
名校
10 . 原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________ 。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______ (填化学式),呈现如此递变规律的原因是________________________________ 。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___ ,另一种的晶胞如图二所示,该晶胞的空间利用率为________________ (保留两位有效数字)。(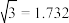 )
)
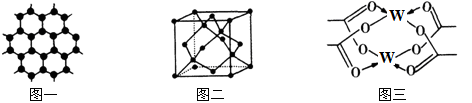
(4)W元素形成的单质,其晶体的堆积模型为___________ ,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________ 。请写出上述过程的离子方程式___________________________ ,___________________________________ 。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
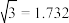 )
)
(4)W元素形成的单质,其晶体的堆积模型为
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是
您最近一年使用:0次
2016-12-08更新
|
1337次组卷
|
4卷引用:【全国百强校】宁夏石嘴山市第三中学2018届高三下学期第四次模拟考试理综-化学试题



