1 . 丙烯是一种重要的有机化工原料,丙烷直接脱氢制丙烯的反应如下:
反应Ⅰ:

反应Ⅱ:
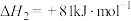
回答下列问题:
(1)已知相关化学键键能数据如下:
则
_______  。
。
(2)在密闭容器中充入一定量的 ,保持压强不变,分别在
,保持压强不变,分别在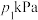 、
、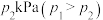 时发生上述反应,测得
时发生上述反应,测得 和
和 平衡时的物质的量分数随温度变化如图所示。
平衡时的物质的量分数随温度变化如图所示。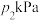 时,
时, 平衡时的物质的量分数随温度变化的曲线是
平衡时的物质的量分数随温度变化的曲线是_______ (填“a”、“b”、“c”或“d”),理由是_______ 。
②M点对应温度和压强下,反应Ⅰ的平衡常数
_______ kPa(以分压表示,分压=总压×物质的量分数);此时 的平衡转化率为
的平衡转化率为_______ (保留三位有效数字)。
(3) ℃时,将
℃时,将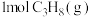 充入某刚性密闭容器中,在催化剂作用下只发生反应Ⅰ:
充入某刚性密闭容器中,在催化剂作用下只发生反应Ⅰ: 。测得容器内压强随时间的变化关系如下表所示。
。测得容器内压强随时间的变化关系如下表所示。
① 内,用
内,用 的分压变化表示的平均反应速率为
的分压变化表示的平均反应速率为_______  。
。
②平衡时, 的物质的量分数为
的物质的量分数为_______ 。
反应Ⅰ:


反应Ⅱ:

回答下列问题:
(1)已知相关化学键键能数据如下:
| 化学键 | H—H | C—C | C=C | C—H |
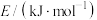 | 436 | 348 | 615 | 413 |

 。
。(2)在密闭容器中充入一定量的
 ,保持压强不变,分别在
,保持压强不变,分别在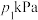 、
、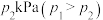 时发生上述反应,测得
时发生上述反应,测得 和
和 平衡时的物质的量分数随温度变化如图所示。
平衡时的物质的量分数随温度变化如图所示。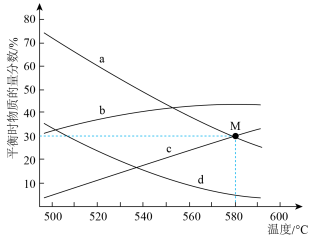
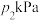 时,
时, 平衡时的物质的量分数随温度变化的曲线是
平衡时的物质的量分数随温度变化的曲线是②M点对应温度和压强下,反应Ⅰ的平衡常数

 的平衡转化率为
的平衡转化率为(3)
 ℃时,将
℃时,将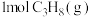 充入某刚性密闭容器中,在催化剂作用下只发生反应Ⅰ:
充入某刚性密闭容器中,在催化剂作用下只发生反应Ⅰ: 。测得容器内压强随时间的变化关系如下表所示。
。测得容器内压强随时间的变化关系如下表所示。| 时间/min | 0 | 30 | 60 | 90 | 120 | 150 | 180 |
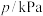 | 100 | 118 | 133 | 143 | 148 | 150 | 150 |
 内,用
内,用 的分压变化表示的平均反应速率为
的分压变化表示的平均反应速率为 。
。②平衡时,
 的物质的量分数为
的物质的量分数为
您最近一年使用:0次
解题方法
2 . 二氯异氰尿酸钠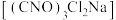 是常用的杀菌消毒剂。在10℃时,用
是常用的杀菌消毒剂。在10℃时,用 和氰尿酸
和氰尿酸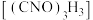 制备二氯异氰尿酸钠的装置如图所示(夹持装置路)。
制备二氯异氰尿酸钠的装置如图所示(夹持装置路)。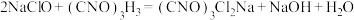
回答下列问题:
(1)仪器a的名称为_______ ;装置A中制备 的化学方程式为
的化学方程式为_______ 。
(2)装置B中的试剂为_______ ,选择此试剂的理由是_______ (从平衡移动的角度解释);实验过程中,向装置C中不断通入 ,其作用是
,其作用是_______ 。
(3)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:

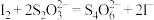
实验步骤:准确称取m g样品,配成 溶液;取
溶液;取 上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,加入淀粉指示剂,用
上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,加入淀粉指示剂,用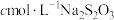 标准溶液漓定,消耗
标准溶液漓定,消耗 ,溶液V mL。
,溶液V mL。
①滴定终点的判断方法是_______ 。
②该样品有效氯含量的表达式为_______ (用含m、c、V的代数式表示)。
(该样品的有效氯含量=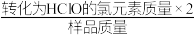 ×100%)
×100%)
③下列操作导致有效氯含量测定值偏低的是_______ (填标号)。
a.加入稀硫酸的量过少
b.滴定前滴定管未排气泡,滴定后气泡消失
c.滴定管使用前,未用 标准溶液润洗
标准溶液润洗
d.读数时,滴定前平视,滴定后俯视
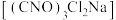 是常用的杀菌消毒剂。在10℃时,用
是常用的杀菌消毒剂。在10℃时,用 和氰尿酸
和氰尿酸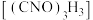 制备二氯异氰尿酸钠的装置如图所示(夹持装置路)。
制备二氯异氰尿酸钠的装置如图所示(夹持装置路)。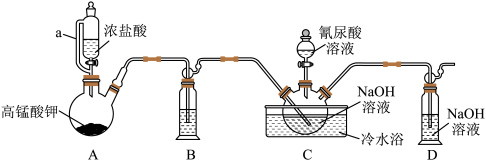
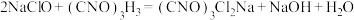
回答下列问题:
(1)仪器a的名称为
 的化学方程式为
的化学方程式为(2)装置B中的试剂为
 ,其作用是
,其作用是(3)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:


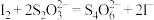
实验步骤:准确称取m g样品,配成
 溶液;取
溶液;取 上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,加入淀粉指示剂,用
上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,加入淀粉指示剂,用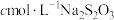 标准溶液漓定,消耗
标准溶液漓定,消耗 ,溶液V mL。
,溶液V mL。①滴定终点的判断方法是
②该样品有效氯含量的表达式为
(该样品的有效氯含量=
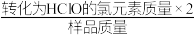 ×100%)
×100%)③下列操作导致有效氯含量测定值偏低的是
a.加入稀硫酸的量过少
b.滴定前滴定管未排气泡,滴定后气泡消失
c.滴定管使用前,未用
 标准溶液润洗
标准溶液润洗d.读数时,滴定前平视,滴定后俯视
您最近一年使用:0次
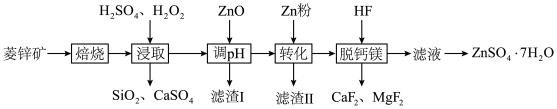
3 . 硫酸锌晶体(ZnSO4·7H2O)在防腐、电镀、医学上有诸多应用。由菱锌矿(主要成分为ZnCO3,含有少量SiO2以及Ca、Mg、Fe、Cu的化合物)制备硫酸锌晶体的工艺流程如下。
②该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“焙烧”生成ZnO的化学方程式为______ ;“浸取”过程中H2O2的作用为______ 。
(2)用ZnO调pH的原理为______ (用离子方程式表示);调溶液pH为5.5,则滤渣I的主要成分为______ 。
(3)“转化”过程中加入锌粉的作用是______ ;“脱镁”过程中生成MgF2的离子方程式为______ 。
(4)将分离出硫酸锌晶体后的母液收集、循环使用,其意义是______ 。
②该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Zn2+ | Mg2+ | Fe2+ | Fe3+ | Cu2+ | Ca2+ |
| 开始沉淀的pH | 6.2 | 8.9 | 6.8 | 2.2 | 4.7 | 10.6 |
| 完全沉淀的pH | 8.2 | 10.9 | 8.3 | 3.2 | 6.7 | 12.6 |
(1)“焙烧”生成ZnO的化学方程式为
(2)用ZnO调pH的原理为
(3)“转化”过程中加入锌粉的作用是
(4)将分离出硫酸锌晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
解题方法
4 . 锌电池具有能量密度大、功率高等优点。一种新型锌电池的工作原理如图所示,在放电的同时得到较高浓度的 溶液。下列说法错误的是
溶液。下列说法错误的是
 溶液。下列说法错误的是
溶液。下列说法错误的是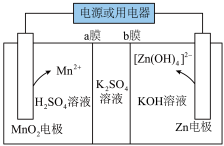
| A.a膜是阴膜,b膜是阳膜 |
| B.充电时,阳极区溶液pH减小 |
C.放电时,负极反应为 |
D.充电时,电路中每转移 电子,阴极区溶液质量减少 电子,阴极区溶液质量减少 |
您最近一年使用:0次
5 . 氯化铁是一种重要的化工原料,实验室用如下装置(加热、夹持装置略)制备无水氯化铁。
回答下列问题:
(1)装置连接顺序为______ 。A→______→______→______→______;装置D的作用是______ 。
(2)装置A中a的作用是______ ;圆底烧瓶中发生反应的离子方程式为______ 。
(3)测定FeCl3的质量分数:称取mgFeCl3样品,配成溶液,加入稍过量的KI溶液充分反应,再滴加cmol/L的Na2S2O3溶液,最终消耗VmLNa2S2O3溶液(已知:I2+2 =2I-+
=2I-+ )。
)。
①加入稍过量的KI溶液后,检验溶液中是否存在Fe3+的试剂为______ 。
②样品中FeCl3的质量分数为______ (用含m、c、V的代数式表示)。
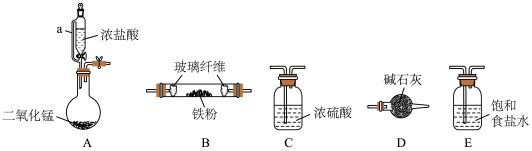
回答下列问题:
(1)装置连接顺序为
(2)装置A中a的作用是
(3)测定FeCl3的质量分数:称取mgFeCl3样品,配成溶液,加入稍过量的KI溶液充分反应,再滴加cmol/L的Na2S2O3溶液,最终消耗VmLNa2S2O3溶液(已知:I2+2
 =2I-+
=2I-+ )。
)。①加入稍过量的KI溶液后,检验溶液中是否存在Fe3+的试剂为
②样品中FeCl3的质量分数为
您最近一年使用:0次
6 . 二水合醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体难溶于冷水,常用作氧气吸收剂。其制备方法是先利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬,实验装置如图所示。
(1)仪器a的名称是______ ;装置丙中水的作用是______ 。
(2)将过量锌粒和氯化铬固体置于甲中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3.锌粒与CrCl3反应的化学方程式为______ ;同时三颈烧瓶中有气体产生,该气体的作用是______ 。
(3)为使生成的CrCl2溶液与醋酸钠溶液接触,应进行的操作为______ ;装置乙中析出砖红色沉淀,使沉淀充分析出并分离的方法是______ 、洗涤、干燥。
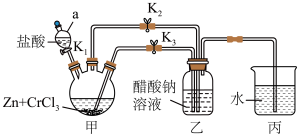
(1)仪器a的名称是
(2)将过量锌粒和氯化铬固体置于甲中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3.锌粒与CrCl3反应的化学方程式为
(3)为使生成的CrCl2溶液与醋酸钠溶液接触,应进行的操作为
您最近一年使用:0次
7 . 硼可形成许多结构和性质特殊的化合物。回答下列问题:
(1)基态B原子的价电子轨道表示式为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形; 是一种常用的储氢材料,由
是一种常用的储氢材料,由 和
和 组成,则Na、B、H的电负性由大到小的顺序为
组成,则Na、B、H的电负性由大到小的顺序为_______ 。
(2)已知硼酸 为弱酸,与过量
为弱酸,与过量 溶液反应生成
溶液反应生成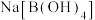 ,则
,则 为
为_______ 元酸(填“一”“二”或“三”), 溶于水的电离方程式为
溶于水的电离方程式为_______ 。
(3)硼砂 是制取含硼化合物的基本原料。常温下,
是制取含硼化合物的基本原料。常温下, 硼砂溶液中,
硼砂溶液中, 水解成
水解成 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为_______ ;测得溶液的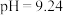 ,则硼酸的电离常数
,则硼酸的电离常数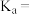
_______ 。
(1)基态B原子的价电子轨道表示式为
 是一种常用的储氢材料,由
是一种常用的储氢材料,由 和
和 组成,则Na、B、H的电负性由大到小的顺序为
组成,则Na、B、H的电负性由大到小的顺序为(2)已知硼酸
 为弱酸,与过量
为弱酸,与过量 溶液反应生成
溶液反应生成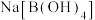 ,则
,则 为
为 溶于水的电离方程式为
溶于水的电离方程式为(3)硼砂
 是制取含硼化合物的基本原料。常温下,
是制取含硼化合物的基本原料。常温下, 硼砂溶液中,
硼砂溶液中, 水解成
水解成 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为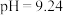 ,则硼酸的电离常数
,则硼酸的电离常数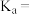
您最近一年使用:0次
8 .  加氢制甲酸可实现
加氢制甲酸可实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:
(1) 电催化加氢是极具前景的甲酸合成工艺,利用电催化反应器合成甲酸的装置如图所示。
电催化加氢是极具前景的甲酸合成工艺,利用电催化反应器合成甲酸的装置如图所示。_______ 极,生成甲酸的电极反应式为_______ 。
②若控制 的流速为
的流速为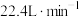 ,且
,且 气体稍过量,通气
气体稍过量,通气 后,Sn电极出口收集到
后,Sn电极出口收集到 和CO共
和CO共 ,Pt电极出口收集到
,Pt电极出口收集到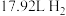 ,则生成
,则生成 的物质的量为
的物质的量为_______ mol(气体体积均在标准状况下测定)。
(2) 电催化加氢合成甲酸的反应历程如图所示。
电催化加氢合成甲酸的反应历程如图所示。 生成CO的选择性
生成CO的选择性_______ (填“高于”或“低于”)生成 的选择性,理由是
的选择性,理由是_______ 。
(3)温度为 ℃时,将
℃时,将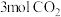 和
和 充入体积为
充入体积为 的刚性容器中发生反应:
的刚性容器中发生反应: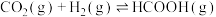
 。实验测得
。实验测得 ,
, ,
, 、
、 为速率常数。
为速率常数。
①已知 的平衡转化率为60%,则
的平衡转化率为60%,则 ℃时,
℃时,
_______  。
。
②温度为 ℃时,
℃时, ,则
,则
_______ (填“>”“<”或“=”) 。
。
 加氢制甲酸可实现
加氢制甲酸可实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:(1)
 电催化加氢是极具前景的甲酸合成工艺,利用电催化反应器合成甲酸的装置如图所示。
电催化加氢是极具前景的甲酸合成工艺,利用电催化反应器合成甲酸的装置如图所示。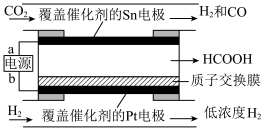
②若控制
 的流速为
的流速为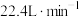 ,且
,且 气体稍过量,通气
气体稍过量,通气 后,Sn电极出口收集到
后,Sn电极出口收集到 和CO共
和CO共 ,Pt电极出口收集到
,Pt电极出口收集到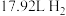 ,则生成
,则生成 的物质的量为
的物质的量为(2)
 电催化加氢合成甲酸的反应历程如图所示。
电催化加氢合成甲酸的反应历程如图所示。
 生成CO的选择性
生成CO的选择性 的选择性,理由是
的选择性,理由是(3)温度为
 ℃时,将
℃时,将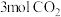 和
和 充入体积为
充入体积为 的刚性容器中发生反应:
的刚性容器中发生反应: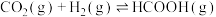
 。实验测得
。实验测得 ,
, ,
, 、
、 为速率常数。
为速率常数。①已知
 的平衡转化率为60%,则
的平衡转化率为60%,则 ℃时,
℃时,
 。
。②温度为
 ℃时,
℃时, ,则
,则
 。
。
您最近一年使用:0次
9 . 为探究 的性质,进行如下实验(所用试剂浓度均为
的性质,进行如下实验(所用试剂浓度均为 ),依据上述实验现象,下列说法错误的是
),依据上述实验现象,下列说法错误的是
 的性质,进行如下实验(所用试剂浓度均为
的性质,进行如下实验(所用试剂浓度均为 ),依据上述实验现象,下列说法错误的是
),依据上述实验现象,下列说法错误的是| 实验 | 操作与现象 |
| ① | 在 水中滴加2滴 水中滴加2滴 溶液,呈棕黄色;煮沸,溶液变红褐色。 溶液,呈棕黄色;煮沸,溶液变红褐色。 |
| ② | 在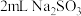 溶液中滴加2滴 溶液中滴加2滴 溶液,溶液变红褐色。 溶液,溶液变红褐色。 |
| ③ | 将②中反应后溶液分成两等份,一份立即滴加 溶液,无明显现象;另一份放置 溶液,无明显现象;另一份放置 后,滴加 后,滴加 溶液,有蓝色沉淀生成。 溶液,有蓝色沉淀生成。 |
A.实验①中发生的反应为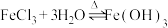 (胶体) (胶体) |
B.实验①②说明 促进了 促进了 的水解反应 的水解反应 |
C.实验②③说明 水解反应速率大于还原反应速率 水解反应速率大于还原反应速率 |
D.可用等浓度的 溶液代替 溶液代替 溶液进行实验 溶液进行实验 |
您最近一年使用:0次
解题方法
10 . 25℃时,用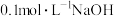 溶液滴定
溶液滴定 溶液,测得溶液中分布系数
溶液,测得溶液中分布系数 、
、 随
随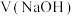 的变化关系如下图所示,[比如
的变化关系如下图所示,[比如 的分布系数:
的分布系数: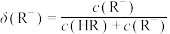 ],下列说法正确的是
],下列说法正确的是
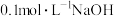 溶液滴定
溶液滴定 溶液,测得溶液中分布系数
溶液,测得溶液中分布系数 、
、 随
随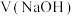 的变化关系如下图所示,[比如
的变化关系如下图所示,[比如 的分布系数:
的分布系数: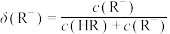 ],下列说法正确的是
],下列说法正确的是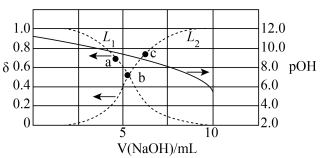
A.曲线 表示 表示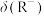 |
| B.水的电离程度:c>b>a |
C.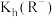 的数量级为 的数量级为 |
D.a点溶液中: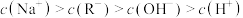 |
您最近一年使用:0次



