13-14高二·全国·课后作业
名校
解题方法
1 . 在可逆反应:2A(g)+3B(g)=xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5 mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是
| A.2min末时A和B的浓度之比为5:3 |
| B.x=1 |
| C.2min末时B的浓度为1.5mol/L |
| D.2min末时A的消耗浓度为0.5mol/L |
您最近一年使用:0次
2024-04-04更新
|
748次组卷
|
50卷引用:海南省琼海市嘉积中学2023-2024学年高二上学期期末考试化学试题A卷
海南省琼海市嘉积中学2023-2024学年高二上学期期末考试化学试题A卷甘肃省张掖市高台县第一中学2018-2019学年高二上学期期末考试理科化学试题内蒙古自治区土默特左旗第三中学2020-2021学年高二上学期期末考试化学试题(已下线)2014年高二化学人教版选修四 5化学反应速率练习卷2014-2015福建省南安第一中学高二下学期期中考试化学试卷2015-2016学年福建省仙游一中高二上期中测试化学试卷2016-2017学年湖北沙市中学高二上第一次双周练化学卷2016-2017学年湖北省武钢三中高二上月考一化学卷黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省大庆市东风中学2017-2018学年高二上学期期中考试化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题河北省香河县第三中学2018-2019学年高二上学期第一次(10月)月考化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期12月月考化学试题新疆哈密市第十五中学2019-2020学年高一上学期期末考试化学试题北京市朝阳区陈经纶中学 2019-2020学年高二下学期期中自主检测化学试题(已下线)2.1.1 化学反应速率的表示方法(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题河北省黄骅中学2020-2021学年高二上学期第一次月考化学试题黑龙江省双鸭山市第一中学2020-2021学年高二上学期期中考试化学试题陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题(已下线)2.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版选修4)江西省宜春市第九中学2021-2022学年高二上学期第一次月考化学试题甘肃省玉门市2021-2022学年高二上学期 “研课标读教材”期中学业质量监测化学试题甘肃省玉门市2021-2022学年高二下学期 “研课标读教材”期中学业质量监测试化学试题(一)山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题山东省滨州市沾化区实验高级中学2022-2023学年高二上学期开学考试化学试题四川省泸州市泸县第五中学2023-2024学年高二上学期11月期中考试化学试题2015届河北省邯郸市高三上学期1月教学质量检测化学试卷2015届湖南省长沙市长郡中学高三上学期第五次月考化学试卷黑龙江省哈尔滨市第三中学2018届高三上学期(10月)第二次验收考试化学试题江西省上饶市横峰中学2019-2020学年高一(自招班)下学期入学考试化学试题辽宁省锦州市凌海市第三高级中学2019-2020学年高一6月月考化学试题辽宁省大石桥市第三高级中学2020-2021学年高一4月月考化学试题湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题辽宁省阜新市第二高级中学2020-2021学年高一下学期期中考试化学试题(已下线)专题21 化学反应速率(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)河南省南阳市第六完全学校高级中学2021-2022学年高一下学期第三次考试化学试题山西省太原市山西现代双语学校2021-2022学年高一下学期5月月考化学试题云南省保山市腾冲市第八中学2022-2023学年高一下学期期中考试化学试卷山东省青岛市平度第一中学2023-2024学年高一下学期4月月考化学试题6.2.1 化学反应的速率 随堂练习6.2.2 化学反应的限度 随堂练习四川省德阳外国语学校2023-2024学年高一下学期期中考试化学试题内蒙古呼和浩特市回民区2023-2024学年高一下学期期中考试化学试题
解题方法
2 . 回答下列问题。
(1)基态N原子的电子排布式为___________ 。基态P原子中,电子占据的最高能级原子轨道形状为___________ 。
(2)H2O中心原子杂化轨道类型为___________ ,说明H2O沸点大于H2S的原因___________ 。
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为___________ (填“发射”或“吸收”)光谱。
(4)下列氧原子电子排布图表示的状态中,能量最高的是___________ (填标号,下同),能量最低的是___________ 。
A.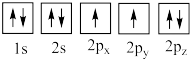 B.
B.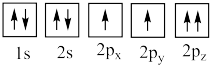
C. D.
D.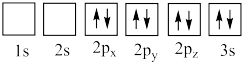
(1)基态N原子的电子排布式为
(2)H2O中心原子杂化轨道类型为
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为
(4)下列氧原子电子排布图表示的状态中,能量最高的是
A.
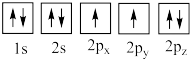 B.
B.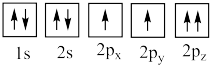
C.
 D.
D.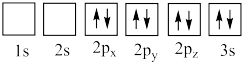
您最近一年使用:0次
2024-03-22更新
|
487次组卷
|
2卷引用:海南中学白沙学校2022-2023学年高二下学期期末考试化学试题
3 . 铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为___________ 。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。在蒸气中也容易双聚,据此判断三氯化铁晶体为___________ (填“分子晶体”或“离子晶体”)。
(3)(NH4)2Fe(SO4)2∙6H2O俗称摩尔盐,其阴离子 的空间构型为
的空间构型为___________ 。
(4)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为___________ 。CO的沸点高于N2的原因是___________ 。
(5)CuCl2和CuCl是铜的两种氯化物。
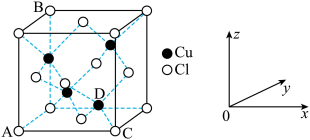
①图中表示的是___________ (填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为 (0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为___________ 。
(1)基态Fe原子的价层电子的电子排布图为
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。在蒸气中也容易双聚,据此判断三氯化铁晶体为
(3)(NH4)2Fe(SO4)2∙6H2O俗称摩尔盐,其阴离子
 的空间构型为
的空间构型为(4)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为
(5)CuCl2和CuCl是铜的两种氯化物。

①图中表示的是
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为 (0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为
您最近一年使用:0次
4 . 1-溴丁烷常用作稀有元素萃取剂、烃化剂及合成染料和香料的有机原料。实验室制备1-溴丁烷的反应、主要装置和有关数据如下:
NaBr+H2SO4 NaHSO4+HBr↑、CH3CH2CH2CH2OH+HBr
NaHSO4+HBr↑、CH3CH2CH2CH2OH+HBr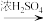 CH3CH2CH2CH2Br+H2O。
CH3CH2CH2CH2Br+H2O。
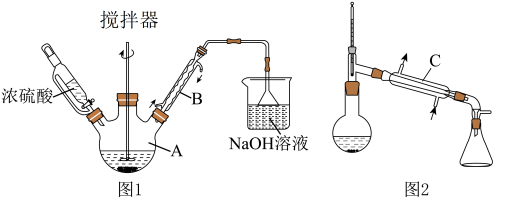
实验步骤:在仪器A中加入10mL水,边搅拌边缓慢滴加20mL过量的浓硫酸,冷却至室温。再依次加入7.4g正丁醇、16.5g研细的溴化钠和几粒沸石。在不断搅拌下,用图1所示装置小火加热回流90min,得到粗品。将粗品依次用15mL水、7mL浓硫酸、10mL水、10mL饱和碳酸氢钠溶液、10mL水洗涤并分液,分出的产物用无水氯化钙充分干燥,滤除氯化钙固体,用图2所示装置加热蒸馏,收集99~103℃的馏分,得纯净1-溴丁烷9.3g。
回答下列问题:
(1)仪器B的名称是___________ 。仪器B与仪器C___________ (填“能”或“不能”)交换使用。
(2)在用浓硫酸洗涤、分液的操作中,待液体分层后,产物应从分液漏斗的___________ (填“上口倒出”或“下口放出”)。
(3)本实验最可能产生两种有机副产物,任写其中一种副产物的结构简式___________ 。
(4)本实验中,1-溴丁烷的产率为___________ (保留三位有效数字)。
NaBr+H2SO4
 NaHSO4+HBr↑、CH3CH2CH2CH2OH+HBr
NaHSO4+HBr↑、CH3CH2CH2CH2OH+HBr CH3CH2CH2CH2Br+H2O。
CH3CH2CH2CH2Br+H2O。
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g/cm3) | 溶解性 | |
| 正丁醇 | 74 | -89.8 | 117.7 | 0.81 | 微溶于水,易溶于浓 硫酸和有机溶剂 |
| 1-溴丁烷 | 137 | -112.4 | 101.6 | 1.28 | 不溶于水,易溶于醇、 醚等有机溶剂 |
| 浓硫酸 | 98 | 10.3 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)仪器B的名称是
(2)在用浓硫酸洗涤、分液的操作中,待液体分层后,产物应从分液漏斗的
(3)本实验最可能产生两种有机副产物,任写其中一种副产物的结构简式
(4)本实验中,1-溴丁烷的产率为
您最近一年使用:0次
解题方法
5 . 用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
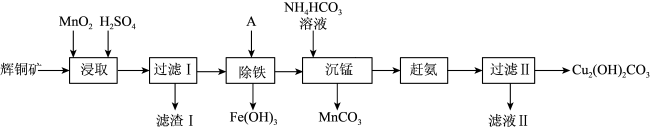
(1)下列措施能加快浸取速率的是___________ 。(填字母)
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:___________ 。
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(5)滤液Ⅱ所含溶质主要是___________ (填化学式)。

(1)下列措施能加快浸取速率的是
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
| A.CO2 | B.CuO | C.氨水 | D.HCl |
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(5)滤液Ⅱ所含溶质主要是
您最近一年使用:0次
23-24高二下·全国·课后作业
6 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
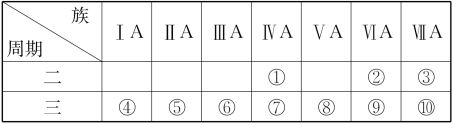
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。

(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
7 . 下列关于NA说法正确的是
| A.28g乙烯与环丙烷混合物,其H原子数目为4NA |
| B.工业上通过环氧乙烷与水直接化合生成乙二醇,体现了“绿色化学”理念 |
C.常温下,向0.1mol•L-1NH4Cl溶液中通NH3至中性,则溶液中NH 数目为0.1NA 数目为0.1NA |
| D.0.1molCH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA |
您最近一年使用:0次
8 . 下列说法正确的是
| A.工业酒精直接蒸馏可制得无水乙醇 |
| B.教材中苯甲酸重结晶实验操作步骤:热溶解→趁热过滤→冷却结晶再过滤 |
| C.溴乙烷与NaOH水溶液加热充分反应后,取上层清液,先加稀硝酸酸化再加入AgNO3溶液有淡黄色沉淀生成 |
| D.向硫酸铜溶液中滴加少量NaOH溶液,再加入葡萄糖溶液并加热,一定生成砖红色沉淀 |
您最近一年使用:0次
9 . 化学与生产、生活密切相关。下列说法不正确的是
| A.我国成功研制出多款新冠疫苗,采用冷链运输疫苗,以防止蛋白质变性 |
| B.北斗卫星导航系统由中国自主研发、独立运行,其所用芯片的主要成分为SiO2 |
| C.福尔马林具有杀菌、防腐性能,可用于制作生物标本 |
| D.TNT是一种烈性炸药,广泛用于国防、采矿、筑路、水利建设等 |
您最近一年使用:0次
10 . 完成下列问题
(1)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一,最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:___________ ;汽油燃料电池最大的障碍是氧化反应不完全产生___________ (填化学式)堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
(2)某温度下0.1mol/LNa2CO3溶液中,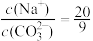 >2,其原因是(用离子方程式说明):
>2,其原因是(用离子方程式说明):_________ ,常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则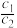 =
=___________ ;
(3)恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g) C(g);
C(g);
①若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为___________ mol;
②若开始时放入XmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是Ymol和3amol,则X=___________ ,Y=___________ 。
(1)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一,最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:
(2)某温度下0.1mol/LNa2CO3溶液中,
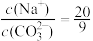 >2,其原因是(用离子方程式说明):
>2,其原因是(用离子方程式说明):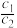 =
=(3)恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)
 C(g);
C(g);①若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为
②若开始时放入XmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是Ymol和3amol,则X=
您最近一年使用:0次



