1 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有___________ 种不同能量的电子,具有___________ 种不同空间运动状态的电子,具有___________ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为___________ ,基态Se原子的价电子轨道表示式为___________ ,基态Mn2+的价电子排布式为___________ 。
(1)下列有关说法错误的是___________。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
您最近一年使用:0次
2 . I.某学生用 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
②量取20.00 mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是___________ (填编号),该步骤错误操作会导致测定结果___________ (填“偏大”“偏小”或“无影响”)。
(2)下列操作会导致上述所测盐酸溶液的浓度偏高的是___________(填正确答案标号)。
II.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(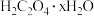 )进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(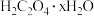 )中的x值。
)中的x值。
通过查阅资料和网络查询得,草酸易溶于水,水溶液可以用酸性 溶液进行滴定:
溶液进行滴定: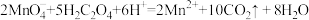
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00 mL水溶液为待测液
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀
③用浓度为 的
的 标准溶液进行滴定,达到终点记录消耗体积。
标准溶液进行滴定,达到终点记录消耗体积。
(3)滴定时,将酸性 标准液装在如图中的
标准液装在如图中的___________ (填“甲”或“乙”)滴定管中。___________ 。
(5)本实验滴定达到终点的标志是___________ 。
(6)为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
通过上述数据,可知消耗的 溶液体积为
溶液体积为___________ mL,该“一定质量”草酸晶体中含n(H2C2O4)=___________ mol,则草酸晶体(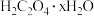 )中x值为
)中x值为___________ 。
 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,注入
 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
②量取20.00 mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是
(2)下列操作会导致上述所测盐酸溶液的浓度偏高的是___________(填正确答案标号)。
| A.滴定达到终点时,俯视滴定管内液面读数 |
| B.碱式滴定管尖嘴部分开始有气泡,滴定后消失 |
| C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液 |
| D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
II.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(
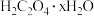 )进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(
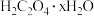 )中的x值。
)中的x值。通过查阅资料和网络查询得,草酸易溶于水,水溶液可以用酸性
 溶液进行滴定:
溶液进行滴定: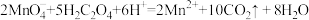
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00 mL水溶液为待测液
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀

③用浓度为
 的
的 标准溶液进行滴定,达到终点记录消耗体积。
标准溶液进行滴定,达到终点记录消耗体积。(3)滴定时,将酸性
 标准液装在如图中的
标准液装在如图中的
(5)本实验滴定达到终点的标志是
(6)为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
| 待测液/mL | 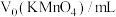 | 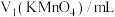 |
| 25.00 | 0.00 | 9.95 |
| 25.00 | 1.05 | 11.10 |
| 25.00 | 0.50 | 13.50 |
 溶液体积为
溶液体积为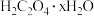 )中x值为
)中x值为
您最近一年使用:0次
解题方法
3 . 回答下列问题:
(1)一定温度下,向1 L恒容密闭容器中加入1 mol HI(g),发生反应2HI(g) H2(g)+I2(g),H2的物质的量随时间的变化如图所示。
H2(g)+I2(g),H2的物质的量随时间的变化如图所示。___________ 。
②该温度下,H2(g)+I2(g) ⇌2HI(g)的平衡常数K=___________ 。
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ 移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的___________ (填字母序号),产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(3)以H2为燃料,KOH溶液为电解质溶液可制得氢氧燃料电池。该电池负极反应式为___________ 。已知2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ·mol-1.若该氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,则该电池的能量转化率为___________ 。
(1)一定温度下,向1 L恒容密闭容器中加入1 mol HI(g),发生反应2HI(g)
 H2(g)+I2(g),H2的物质的量随时间的变化如图所示。
H2(g)+I2(g),H2的物质的量随时间的变化如图所示。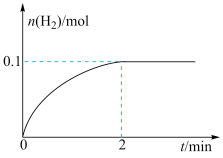
②该温度下,H2(g)+I2(g) ⇌2HI(g)的平衡常数K=
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(3)以H2为燃料,KOH溶液为电解质溶液可制得氢氧燃料电池。该电池负极反应式为
您最近一年使用:0次
4 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.2.4 g Mg与足量稀硫酸反应,转移的电子数为0.1NA |
| B.3.2 g O2和O3混合气体中的氧原子数为0.3NA |
| C.1.6 g CH4含有的共价键数为0.4NA |
| D.5.6 L CO中含有的分子数为0.25NA |
您最近一年使用:0次
10-11高二上·河南新乡·阶段练习
名校
解题方法
5 . 下列溶液一定呈中性的是
A. mol⋅L mol⋅L 的溶液 的溶液 |
B. 的溶液 的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
您最近一年使用:0次
2024-04-12更新
|
89次组卷
|
55卷引用:河北省邢台市第八中学2017-2018学年高二上学期期末考试化学试题
河北省邢台市第八中学2017-2018学年高二上学期期末考试化学试题(已下线)2010—2011学年湖北省黄冈中学高二上学期期末考试化学试卷(已下线)2010-2011年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2011—2012河北省南宫中学高二期中考试化学(理)试卷(已下线)2011-2012学年天津市青光中学高二第一学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高二下学期期末考试化学试卷(已下线)2013-2014学年贵州省遵义四中高二上学期期末考试化学试卷(已下线)2013-2014学年安徽省宿州市高二上学期期末考试化学试卷2014-2015学年河北省高阳中学高二12月月考化学试卷河北省永年县第二中学2017-2018学年高二12月月考化学试题甘肃省永昌四中2019-2020学年高二上学期期末考试化学试题广东省珠海市北京师范大学珠海分校附属外国语学校2019-2020学年高二上学期期末考试化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期末考试化学试题宁夏青铜峡市高级中学2020-2021学年高二上学期期末考试化学试题北京市平谷区2021-2022学年高二上学期期末化学试题甘肃省武威市凉州区2021-2022学年高二上学期期末考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期末考试化学试题 天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题(已下线)2011年河南省卫辉市第一中学高二1月月考化学试卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期中考试化学试题(已下线)2012-2013学年呼伦贝尔牙林一中高二上学期期中理科考试化学试卷(已下线)2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)10月月考化学试题【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期第二次月考化学试题内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题黑龙江省安达市第七中学2019-2020学年高二3月月考化学试题宁夏贺兰县景博中学2019-2020学年高二上学期期中考试化学试题黑龙江省齐齐哈尔三立高级中学有限公司2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】4. 莲塘一中 孙晖洪内蒙古自治区乌兰察布市集宁一中(西校区)2020-2021学年高二上学期期中考试化学试题广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题(已下线)全册综合检测(一)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)湖北省宜城市第三高级中学2020-2021学年高二上学期期中考试化学试题山东省烟台市中英文学校2020-2021学年高二10月月考化学试题重庆市朝阳中学高2020-2021学年高二上学期期中考试化学试题江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题(已下线)【浙江新东方】高中化学20210304-002北京东城区2019-2020学年高二下学期期中考试化学试题山东省淄博市高青县第一中学2021-2022学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期11月测试化学试题新疆乌苏市第一中学2021-2022学年高二12月月考化学试题浙江省嘉兴市第五高级中学2021-2022学年高二上学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题甘肃省定西市文峰中学2021-2022学年高二上学期期中考试化学(理科)试题湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题北京市清华大学附属中学2023-2024学年高二上学期第三单元化学统练广东省广州市广雅集团2023-2024学年高二上学期11月期中考试化学试题青海省西宁市海湖中学2023-2024学年高二上学期第二次阶段考试化学试题山东省烟台爱华高级中学2023-2024学年高二上学期期中考试化学试题天津北京师范大学静海附属学校2023-2024学年高二上学期第三次月考化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题云南省保山第九中学2021届高三上学期开学考试化学试题
名校
解题方法
6 . 元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的价电子排布式为nsn-1npn+1,则下列说法不正确的是
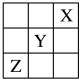
| A.Y元素原子的价电子排布式为4s24p4 |
| B.Y元素在元素周期表的第三周期VIA族 |
| C.X元素所在周期中所含非金属元素最多 |
| D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
您最近一年使用:0次
2024-04-04更新
|
215次组卷
|
46卷引用:河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题
河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷2016-2017学年四川省资阳市高二上学期期末化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第1课时河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题河南省驻马店市2020-2021学年高二上学期期终考试化学试题河北省张家口市宣化第一中学2022-2023学年高二下学期6月月考化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷名校期末好题汇编-原子结构与性质(选择题)2014-2015福建省宁德市五校教学联合体高二下学期期中化学试卷黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题人教化学选修3第一章第二节课时1课时2 核外电子排布与元素周期表、原子半径——A学习区 夯实基础(鲁科版选修3)四川省越西中学2019-2020学年高二5月月考化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题宁夏大学附属中学2020-2021学年高二上学期期中考试化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时1 原子结构与元素周期表(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第2课时 核外电子排布与元素周期表(已下线)1.1 原子结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)1.2.2 核外电子排布与元素周期表-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表吉林省长春外国语学校2021-2022学年高二下学期阶段测试化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题浙江省绍兴蕺山外国语学校2021-2022学年高二下学期第一次月考化学试题天津市静海区四校2022-2023学年高二下学期3月阶段性检测化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题安徽省蚌埠第二中学2023-2024学年高二下学期3月月考化学试题江苏省镇江市句容高级中学2023-2024学年高二下学期3月考试化学试题四川省成都市简阳实验学校2023-2024学年高二下学期3月月考化学试题(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题(已下线)考向36 原子结构与性质-备战2022年高考化学一轮复习考点微专题
名校
7 . 光学性能优良的高分子材料聚础酸异山梨醇酯可由如下反应制备。
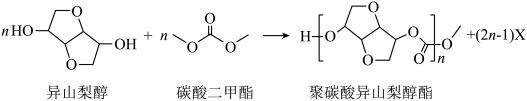
下列说法错误的是
| A.涉及元素的电负性:H<C<O | B.异山梨醇分子中有4个手性碳 |
| C.反应式中化合物X为甲醇 | D.异山梨醇中所有碳原子共平面 |
您最近一年使用:0次
名校
解题方法
8 . 氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示,下列叙述正确的是


| A.NH3与BF3都是由极性键构成的极性分子 |
| B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有8个氮原子、8个硼原子 |
| C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1molNH4BF4含有配位键的数目为2NA |
| D.立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝 |
您最近一年使用:0次
2024-03-21更新
|
250次组卷
|
2卷引用:河北省石家庄市第二十四中学2023-2024高二上学期期末考试化学试题
名校
解题方法
9 . 硫在不同温度下的状态和分子结构不同,单质硫S8环状分子的结构如图。隔绝空气,717.6K时硫变为蒸气,蒸气中存在3S8 4S6
4S6 6S4
6S4 12S2,温度越高,蒸气的平均相对分子质量越小。下列说法正确的是
12S2,温度越高,蒸气的平均相对分子质量越小。下列说法正确的是
 4S6
4S6 6S4
6S4 12S2,温度越高,蒸气的平均相对分子质量越小。下列说法正确的是
12S2,温度越高,蒸气的平均相对分子质量越小。下列说法正确的是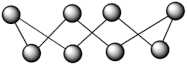
A.对于3S8 4S6 4S6 6S4 6S4 12S2,△H<0 12S2,△H<0 |
| B.S8分子中,原子数与共价键数之比为1:2 |
| C.S8分子中S-S-S的键角为109°28′ |
| D.S8、S6、S4、S2互为同素异形体,其相互转化为化学变化 |
您最近一年使用:0次
2024-03-21更新
|
86次组卷
|
5卷引用:河北正定中学本部2023-2024学年高二上学期期末考试化学试题
河北正定中学本部2023-2024学年高二上学期期末考试化学试题河北省石家庄市河北正定中学2023-2024年高二上学期期末考试化学试题江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题(已下线)2.1.2 键参数——键能、键长与键角课堂例题(已下线)清单02 分子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
10 . 锂离子电池的开发与应用是新能源汽车走向实用的关键。
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为___________ 。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B为___________ 过程(填“充电”或“放电”)。 )。
)。
①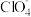 的键角
的键角___________ (填“等于”大于”或“小于”) 的键角。
的键角。 的VSEPR模型为
的VSEPR模型为___________ 。
②Htrz分子为平面结构,N原子的杂化轨道类型为___________ ,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是___________ 。
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是___________ 。
(4)LiAsF6、LiPF6、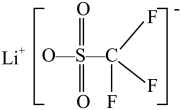 等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是___________ 。
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为
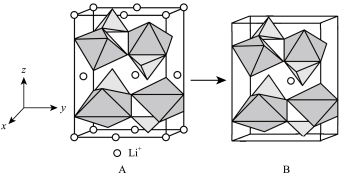
 )。
)。①
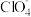 的键角
的键角 的键角。
的键角。 的VSEPR模型为
的VSEPR模型为②Htrz分子为平面结构,N原子的杂化轨道类型为
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是
(4)LiAsF6、LiPF6、
 等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
您最近一年使用:0次
2024-03-16更新
|
310次组卷
|
2卷引用:河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题



