名校
1 . 噻唑衍生物是重要的药物中e间体,一种噻唑衍生物 P 的合成路线如下:
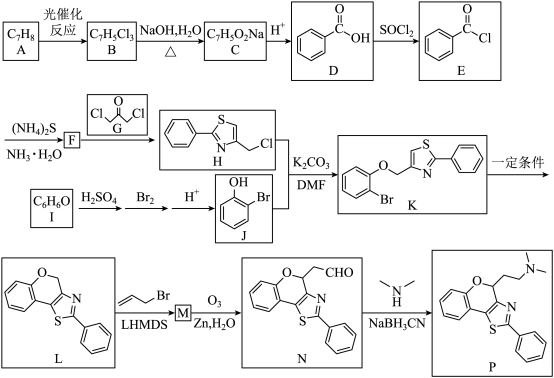
已知:①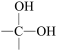 →
→ +H2O
+H2O
②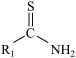 +
+  →
→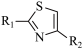
③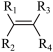
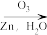
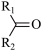 +
+ 
回答下列问题:
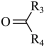
(1)I(C6H6O)合成酚醛树脂的过程中会生成中间体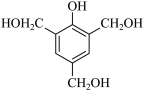 , 此物质的名称是
, 此物质的名称是_______ 。
(2)B 生成 C 的化学方程式为_______ 。
(3)N 中含氧官能团的名称是_______ 。
(4)F、M 的结构简式分别为_______ 。
(5)H 与 J 反应生成 K 的反应类型为_______ 。
(6)Q 是 D 与甲醇酯化后的产物,同时满足下列条件的 Q 的同分异构体有_______ 种,其中核磁共振氢谱峰面积之比为 1:2:2:2:1 的结构是_______ 。
①能发生银镜反应 ②含有苯环 ③与 FeCl3 能发生显色反应
(7)参照上述合成路线,设计以 和
和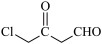 为原料合成
为原料合成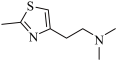 的合成路线。
的合成路线。______

已知:①
 →
→ +H2O
+H2O②
 +
+  →
→
③

 +
+ 
回答下列问题:
(1)I(C6H6O)合成酚醛树脂的过程中会生成中间体
 , 此物质的名称是
, 此物质的名称是(2)B 生成 C 的化学方程式为
(3)N 中含氧官能团的名称是
(4)F、M 的结构简式分别为
(5)H 与 J 反应生成 K 的反应类型为
(6)Q 是 D 与甲醇酯化后的产物,同时满足下列条件的 Q 的同分异构体有
①能发生银镜反应 ②含有苯环 ③与 FeCl3 能发生显色反应
(7)参照上述合成路线,设计以
 和
和 为原料合成
为原料合成 的合成路线。
的合成路线。
您最近一年使用:0次
2022-09-16更新
|
1324次组卷
|
2卷引用:黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题
名校
解题方法
2 . Co、Ni 元素及其化合物有着很多优良的性能和特性,回答下列问题:
(1)基态 Ni 原子的价电子排布图为_______ ;金属镍的原子堆积方式如图所示,则金属镍的晶胞俯视图为_______ (填字母)。

a. b.
b. c.
c. d.
d.
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液,N 原子的杂化方式是_______ ,[Ni(NH3)6]SO4晶体中不存在的化学键类型包括_______ (填序号)。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键 F.氢键
(3)Co3+通常易形成六配位的配合物,已知 CoCl3·6H2O 有多种结构,若取 1mol CoCl3·6H2O溶解于水后滴加足量的硝酸银溶液,能够形成 2mol 沉淀,则 CoCl3·6H2O 中配离子的结构示意图为(不考虑空间结构)_______ 。
(4)Co3O4 晶体中 O 作面心立方最密堆积(如图),Co 随机填充在晶胞中 O 构成的 8 个四面体空隙和 4 个八面体空隙中,则 Co 的配位数分别为_______ 、_______ ,如果晶胞边长为a nm,Co3O4的摩尔质量为 M g/mol,NA为阿伏加德罗常数的值,则Co3O4 的晶体密度为_______ g/cm3(列出计算式)。

(1)基态 Ni 原子的价电子排布图为

a.
 b.
b. c.
c. d.
d.
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液,N 原子的杂化方式是
A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键 F.氢键
(3)Co3+通常易形成六配位的配合物,已知 CoCl3·6H2O 有多种结构,若取 1mol CoCl3·6H2O溶解于水后滴加足量的硝酸银溶液,能够形成 2mol 沉淀,则 CoCl3·6H2O 中配离子的结构示意图为(不考虑空间结构)
(4)Co3O4 晶体中 O 作面心立方最密堆积(如图),Co 随机填充在晶胞中 O 构成的 8 个四面体空隙和 4 个八面体空隙中,则 Co 的配位数分别为

您最近一年使用:0次
3 . Ⅰ.中国提出力争于2030年前实现碳达峰,2060年前实现碳中和,因此CO2的捕集和利用成了研究的重点。
(1)以金属钌作催化剂,可以从空气中捕获CO2直接转化为甲醇,这是实现碳中和的一种技术,其转化原理如图所示。
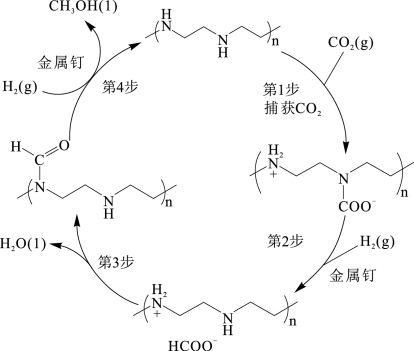
该过程的总反应为_______ 。第1步生成高分子产物链节的分子式_______ 。
(2)CH4—CO2催化重整对温室气体的减排具有重要意义,某温度下在体积为2 L 的容器中加入3 mol CH4、3 mol CO2以及催化剂,同时进行反应:
①CH4+CO2 2CO+2H2
2CO+2H2
②CO+3H2 CH4+H2O(g),
CH4+H2O(g),
达到平衡时测得出现水蒸气的质量为9 g,容器内CO物质的量为1.5 mol,则CO2的转化率是_______ ;(保留2位有效数字),反应①平衡常数为_______ 。(保留2位有效数字)。
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图所示。写出b极CO2和H2O(体积比1:1)的电极反应式_______ , 当有2 mol 电子流出a极时,产生标准状况下O2_______ L。

Ⅱ.氮硫氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。已知NO2与SO2能发生反应 NO2(g)+SO2(g) SO3(g)+NO(g),在一恒容密闭容器中,改变原料气配比n0 (NO2):n0(SO2)进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率部分实验结果如图所示。
SO3(g)+NO(g),在一恒容密闭容器中,改变原料气配比n0 (NO2):n0(SO2)进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率部分实验结果如图所示。
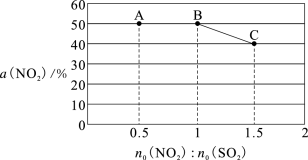
(4)当容器内_______ (填字母)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
(5)已知:2NO(g)+O2(g) 2NO2(g) ΔH1= -113.0 kJ/moL
2NO2(g) ΔH1= -113.0 kJ/moL
2SO2(g)+O2(g) 2SO3(g) ΔH2= -196.6 kJ/moL
2SO3(g) ΔH2= -196.6 kJ/moL
若要使图中 B 点的平衡状态变为 A 点的平衡状态,则应采取的措施是_________ 。
(1)以金属钌作催化剂,可以从空气中捕获CO2直接转化为甲醇,这是实现碳中和的一种技术,其转化原理如图所示。

该过程的总反应为
(2)CH4—CO2催化重整对温室气体的减排具有重要意义,某温度下在体积为2 L 的容器中加入3 mol CH4、3 mol CO2以及催化剂,同时进行反应:
①CH4+CO2
 2CO+2H2
2CO+2H2②CO+3H2
 CH4+H2O(g),
CH4+H2O(g),达到平衡时测得出现水蒸气的质量为9 g,容器内CO物质的量为1.5 mol,则CO2的转化率是
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图所示。写出b极CO2和H2O(体积比1:1)的电极反应式

Ⅱ.氮硫氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。已知NO2与SO2能发生反应 NO2(g)+SO2(g)
 SO3(g)+NO(g),在一恒容密闭容器中,改变原料气配比n0 (NO2):n0(SO2)进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率部分实验结果如图所示。
SO3(g)+NO(g),在一恒容密闭容器中,改变原料气配比n0 (NO2):n0(SO2)进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率部分实验结果如图所示。 
(4)当容器内_______ (填字母)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
| A.气体的压强 | B.气体的平均摩尔质量 |
| C.气体的密度 | D.NO2的体积分数 |
 2NO2(g) ΔH1= -113.0 kJ/moL
2NO2(g) ΔH1= -113.0 kJ/moL 2SO2(g)+O2(g)
 2SO3(g) ΔH2= -196.6 kJ/moL
2SO3(g) ΔH2= -196.6 kJ/moL 若要使图中 B 点的平衡状态变为 A 点的平衡状态,则应采取的措施是_________ 。
| A.适当增加NO2的量,同时降温 |
| B.适当增加SO2的量,同时升温 |
| C.适当减小NO2的量,同时降温 |
| D.适当减小SO2的量,同时升温 |
您最近一年使用:0次
名校
4 . 葡萄糖酸钙是一种有机钙盐,外观为白色结晶性或颗粒性粉末,无臭,无味,易溶于沸水,微溶于冷水,不溶于乙醇或乙醚等有机溶剂。葡萄糖酸钙临床上用于治疗骨质疏松症。实验室制备葡萄糖酸钙主要步骤如下:
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
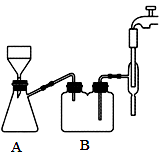
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。
回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为_______ 。
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是_______ 。
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是_______ ;装置 B 的作用是_______ 。
(4)洗涤操作洗涤剂最合适的是_______ _(填序号),理由是_______ 。
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色) MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+
Mg2+ + H2Y2- MgY2- + 2H+
MgY2- + 2H+
MgIn-(酒红色)+ H2Y2- MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色)
(iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN- Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是_______ 。
(6)滴定终点的颜色变化为_______ 。
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为_______ ,_______ 。
(8)葡萄糖酸钙中钙的质量分数为_______ 。(用 V1、V2、m、c 的代数式表示)
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。

回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是
(4)洗涤操作洗涤剂最合适的是
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色)
 MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+ Mg2+ + H2Y2-
 MgY2- + 2H+
MgY2- + 2H+ MgIn-(酒红色)+ H2Y2-
 MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色) (iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN-
 Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是
(6)滴定终点的颜色变化为
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为
(8)葡萄糖酸钙中钙的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 氯化亚铜 CuCl 是一种无机物,可用作催化剂、杀菌剂、媒染剂、脱色剂。它难溶于水,溶于浓盐酸和氨水,不溶于乙醇,在潮湿空气中可被迅速氧化成 Cu2(OH)3Cl。制备方法如下:

Ⅰ.途径一,以海绵铜(主要成分是 Cu 和少量的 CuO)为原料,回答下列问题:
(1)海绵铜在溶解之前进行“预处理”操作以去除表面的矿物油污,可以选择_______ 。
A.纯碱溶液浸泡 B.NaOH 溶液浸泡 C.酒精清洗
(2)溶解步骤温度控制在 60℃的原因是_______ 。
(3)反应步骤的离子方程式_______ 。
Ⅱ.途径二,以刻蚀废液(主要成分是 FeCl3、FeCl2、CuCl2)为原料,回答下列问题:
(4)刻蚀废液进行“预处理”时,先加入合适的氧化剂,再加入 Na2CO3溶液。加入Na2CO3调节溶液至微酸性而不是碱性的原因是_______ 。
(5)析出的氯化亚铜晶体要立即水洗后醇洗,在真空干燥机内于 60℃干燥 2 小时,冷却后真空包装,否则会发生反应的化学方程式为_______ 。
Ⅲ.在湿法炼锌的电解循环溶液中,较高浓度的 Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。已知:Cu+Cu2+ 2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6
2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6
(6)通过计算说明上述除Cl-的反应能完全进行的原因_______ 。
(7)若用Zn替换Cu可加快除Cl-的速率,但需控制溶液的 pH。若pH过低,除 Cl-效果下降的原因是_______ 。

Ⅰ.途径一,以海绵铜(主要成分是 Cu 和少量的 CuO)为原料,回答下列问题:
(1)海绵铜在溶解之前进行“预处理”操作以去除表面的矿物油污,可以选择
A.纯碱溶液浸泡 B.NaOH 溶液浸泡 C.酒精清洗
(2)溶解步骤温度控制在 60℃的原因是
(3)反应步骤的离子方程式
Ⅱ.途径二,以刻蚀废液(主要成分是 FeCl3、FeCl2、CuCl2)为原料,回答下列问题:
(4)刻蚀废液进行“预处理”时,先加入合适的氧化剂,再加入 Na2CO3溶液。加入Na2CO3调节溶液至微酸性而不是碱性的原因是
(5)析出的氯化亚铜晶体要立即水洗后醇洗,在真空干燥机内于 60℃干燥 2 小时,冷却后真空包装,否则会发生反应的化学方程式为
Ⅲ.在湿法炼锌的电解循环溶液中,较高浓度的 Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。已知:Cu+Cu2+
 2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6
2Cu+ K =7.6×10-7;Ksp(CuCl) = 2.0×10-6(6)通过计算说明上述除Cl-的反应能完全进行的原因
(7)若用Zn替换Cu可加快除Cl-的速率,但需控制溶液的 pH。若pH过低,除 Cl-效果下降的原因是
您最近一年使用:0次
2022-09-16更新
|
701次组卷
|
3卷引用:黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题
黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题(已下线)2022年北京高考真题化学试题变式题(工业流程题)新疆维吾尔自治区和田地区洛浦县2022-2023学年高三上学期11月期中考试化学试题
名校
6 . MOH 为一元弱碱,向 MCl 的稀溶液中不断加入蒸馏水,c(H+)随 c(M+)而变化。实验发现,某温度下,c2 (H+)~c(M+)为线性关系,如下图实线所示。
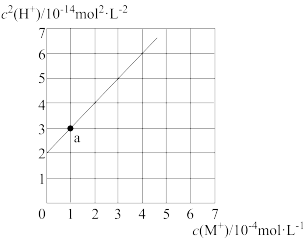
下列叙述错误的是

下列叙述错误的是
| A.当 c(M+) = 2 ×10-4 mol·L-1时,c(OH-) = 1×10-7 mol·L-1 |
| B.溶液中存在:c(M+) + c(H+) = c(Cl- ) + c(OH-) |
| C.该温度下,M+的水解平衡常数 Kh = 1×10-10 |
| D.a 点溶液中:c(Cl-) > c(M+) > c(H+) > c(MOH) > c(OH-) |
您最近一年使用:0次
2022-09-16更新
|
1353次组卷
|
3卷引用:黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题
7 . 羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 CO2 和 H2O 的原电池-电解池组合装置(如下图所示),该装置能实现发电、环保二位一体。下列说法错误的是
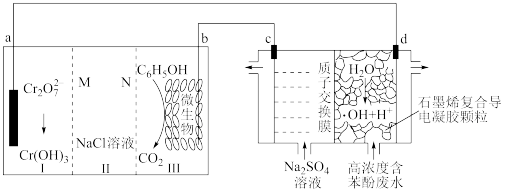

| A.系统工作时,电流由 b 极经 III、II、I 室流向 a 极 |
| B.d 极区苯酚被氧化的化学方程式为 C6H5OH+28·OH = 6 CO2↑+17 H2O |
| C.系统工作时,每转移 28mol e-消耗 1mol 苯酚 |
D.a 电极的电极反应式:7H2O + Cr2O + 6 e-=2 Cr(OH)3 + 8 OH- + 6 e-=2 Cr(OH)3 + 8 OH- |
您最近一年使用:0次
8 . 下列实验操作、现象及得出的结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向两支盛有KI3溶液的试管中分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀生成 | KI3溶液中存在平衡:I  I2+I- I2+I- |
| B | 向两支盛有5mL6%H2O2溶液的试管中分别加入1mL0.1mol/LFeCl3溶液和1mL0.1mol/LCuSO4溶液 | 滴加FeCl3溶液比滴加CuSO4溶液的试管中相同时间内产生气泡多 | Fe3+催化效果好 |
| C | 向盛有Fe(NO3)2溶液的试管中加入1mol/L的硫酸 | 试管口出现红棕色气体 | 溶液中的NO 被Fe2+还原为NO2 被Fe2+还原为NO2 |
| D | 常温下,用pH计分别测定等体积1mol/LCH3COONH4溶液和0.1mol/L CH3COONH4溶液的pH | pH均为7 | 两种CH3COONH4溶液中水的电离程度相同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-16更新
|
811次组卷
|
4卷引用:黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题
名校
解题方法
9 . 短周期主族元素 X、Y、Z、W、Q 原子序数依次增大,其中 Y、Z 同周期,W、Q 同周期,W 与 Y 同主族,W 与 Z 形成的化合物是玻璃工业的主要原料。Q 的最外层电子数等于 X、Z 的最外层电子数之和。下列说法正确的是
| A.最高价氧化物对应的水化物的酸性:Q>W>Y |
| B.原子半径:W>Z>Y>X |
| C.Y 和 W 形成的化合物硬度很大,可用作砂纸、砂轮的磨料 |
| D.Z 分别与 Y、W 形成的化合物一定为酸性氧化物 |
您最近一年使用:0次
2022-09-16更新
|
610次组卷
|
3卷引用:黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题
10 . 苯乙醛可用于制备工业香料,工业上通过以下途径制备苯乙醛。下列说法正确的是
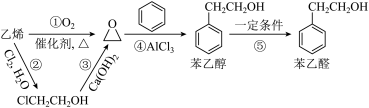
| A.反应①、②和④符合绿色化学的原则 |
| B.乙烯、苯乙醇、苯乙醛均能因反应而使酸性高锰酸钾溶液和溴水褪色 |
| C.向 2 mL10%的硫酸铜溶液中滴加 5 滴 2%的氢氧化钠溶液,再加入 0.5 mL 苯乙醛溶液,加热,有砖红色沉淀出现 |
D.预测可以发生反应 |
您最近一年使用:0次
2022-09-16更新
|
732次组卷
|
7卷引用:黑龙江省佳木斯市第一中学2022届高三第三次模拟理科综合化学试题



